外周血淋巴细胞绝对值和单核细胞绝对值的比值对胃癌患者预后的预测价值
2019-10-18侯杰耿熠赵亚宁刘尧汪华闫晓红杨乔
侯杰,耿熠,赵亚宁,刘尧,汪华,闫晓红,杨乔
宝鸡市中心医院肿瘤内科,陕西宝鸡721008
随着胃癌分子水平研究的不断发展,更多更好的靶向治疗药物相继问世,胃癌患者的生存期获得了一定程度的延长[1-2]。随着病情的进展,接受手术治疗的胃癌患者的生存时间逐渐缩短,因此临床医师需准确预测患者的预后,以提高患者的生存率。肿瘤的发生不仅取决于肿瘤的相关因素,还取决于宿主的免疫状态,机体炎性反应和免疫状态的变化与肿瘤的发生、发展及预后密切相关[3-4]。因此,发现一种方便、简单、可对预后进行危险分层的生物标志物具有重要意义[5]。改良的Glasgow预后评分、平均血小板体积(mean platelet volume,MPV)、中性粒细胞绝对值(absolute neutrophil count,ANC)、单核细胞绝对值(absolute monocyte count,AMC)、淋巴细胞绝对值(absolute lymphocyte count,ALC)、中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)及血小板与淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)已被报道是胃癌的独立预后因素[6]。近年来,外周血ALC与AMC比值(lymphocyte-to-monocyte ratio,LMR)已被证实对淋巴瘤、结直肠癌、乳腺癌及鼻咽癌的预后具有一定的预测价值[7-10],但有关该指标对胃癌预后的预测价值报道较少。本研究探讨了LMR对胃癌患者预后的预测价值,现报道如下。
1 资料与方法
1.1 一般资料
选择2007年1月至2017年12月于宝鸡市中心医院接受胃癌根治术治疗的胃癌患者。纳入标准:①经病理学检查确诊为胃癌;②接受胃癌根治术,且术前未接受放化疗、免疫治疗;③临床资料完整。排除标准:①合并其他部位恶性肿瘤的患者;②复发性胃癌患者;③有明显出血、感染、严重梗阻等影响外周血实验室检查结果的患者。依据纳入和排除标准,本研究共纳入110例胃癌患者。其中,男72例,女38例;年龄28~62岁,中位年龄为50岁,年龄≥60岁23例,<60岁87例;肿瘤位置:胃窦部56例,贲门胃底部35例,胃体19例;组织学类型:腺癌45例,鳞状细胞癌52例,腺鳞癌13例;分化程度:低分化43例,中分化39例,高分化28例;浸润深度:T1~T271例,T3~T439例;TNM分期:Ⅰ期15例,Ⅱ期64例,Ⅲ期31例。
1.2 样本采集
采用乙二胺四乙酸二钾抗凝真空采集管于患者住院后第2天采集清晨空腹静脉血3 ml,使用XS-500i全自动血液分析仪对样本进行血细胞分析。标本采集后4 h内完成检测。
1.3 观察指标
收集患者的临床资料,包括性别、年龄、病理类型、浸润深度、淋巴结转移情况、TNM分期、ALC、AMC及LMR,分析胃癌患者预后的影响因素。采用受试者工作特征(receiver operating characteristic,ROC)曲线确定术前外周血ALC、AMC、LMR预测胃癌患者总生存期的最佳临界值[11]。
1.4 随访方法
所有患者均进行门诊或电话随访,随访截止时间为2018年11月1日。总生存期定义为从疾病确诊至患者死亡或随访截止时间。无病生存期定义为从辅助化疗开始至疾病复发或由于疾病进展导致患者死亡的时间。
1.5 统计学方法
采用SPSS 21.0软件对数据进行统计分析。采用Cox比例风险回归模型进行单因素和多因素分析。采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 ROC曲线分析
ROC曲线分析结果显示,ALC和AMC预测胃癌患者总生存期的最佳临界值分别为1.73×109/L[曲线下面积(area under curve,AUC)为0.661,P<0.01)]和0.63×109/L(AUC为0.605,P<0.05),LMR预测胃癌患者总生存期的最佳临界值为3.9(AUC为0.870,P<0.01)。(图1)
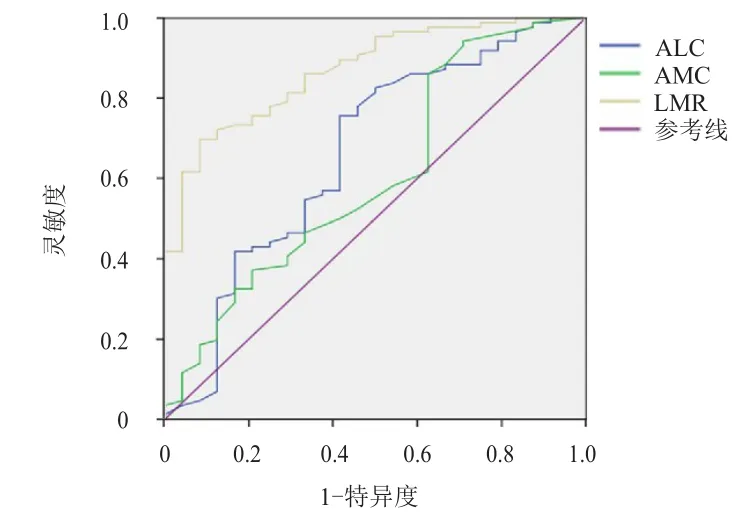
图1 ALC、AMC、LMR预测胃癌患者总生存期的ROC曲线
2.2 胃癌患者预后影响因素的Cox比例风险回归分析
110例患者均完成随访,无失访患者,随访时间为10~119个月,中位随访时间为57个月,86例患者死亡,24例患者生存。以性别、年龄、分化程度、浸润深度、淋巴结转移情况、TNM分期、ALC、AMC、LMR为自变量,以胃癌患者的预后为因变量,采用Cox比例风险回归模型进行单因素和多因素分析。结果显示,TNM分期和LMR均是胃癌患者预后的独立影响因素(P<0.01)。(表1)
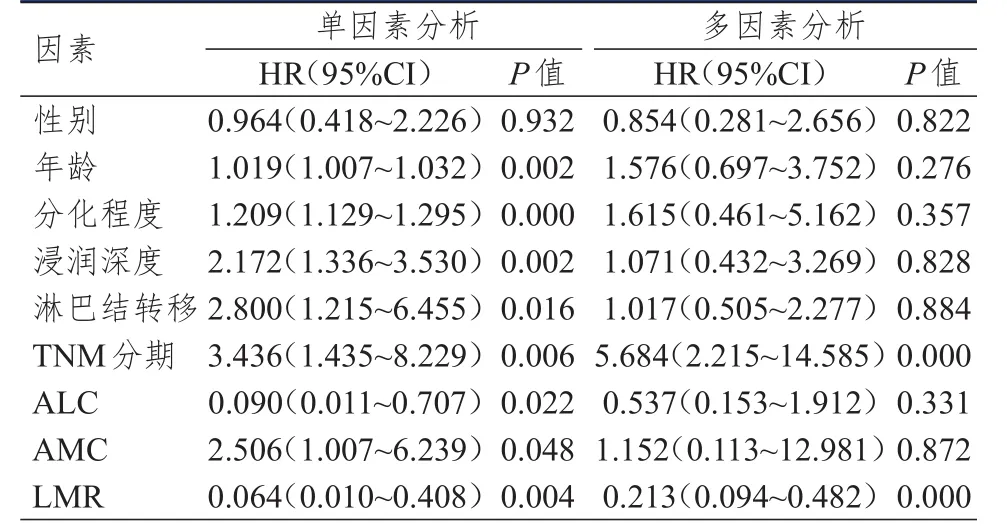
表1 110例胃癌患者预后影响因素的单因素和多因素分析
2.3 高LMR组和低LMR组胃癌患者预后的比较
根据术前LMR最佳临界值将患者分为高LMR组(LMR≥3.9)和低LMR组(LMR<3.9);其中,高LMR组61例,低LMR组49例。高LMR组患者的5年生存率为51.2%,高于低LMR组患者的18.5%,差异有统计学意义(χ2=32.232,P<0.05);高LMR组患者的5年无病生存率为42.6%,高于低LMR组患者的16.2%,差异有统计学意义(χ2=20.438,P<0.05)。(图2、图3)
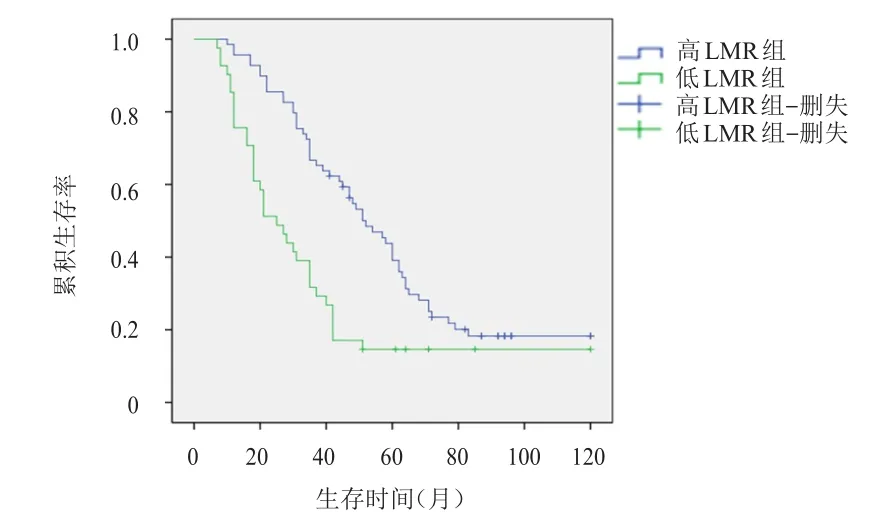
图3 高LMR组(n=61)和低LMR组(n=49)胃癌患者的无病生存曲线
3 讨论
Bruckner等[12]首次报道ANC、AMC和ALC是转移性胃癌患者预后的独立影响因素。临床上可将ANC和ALC作为胃癌的预后因素,并以此来确定NLR[13]。此外,ALC联合血小板计数对胃癌患者近期疗效的评估及预后指导也具有一定的意义[14-15],而AMC在胃癌中的预后价值尚未得到证实。
淋巴细胞是人类机体免疫的重要组成部分,其在抵抗肿瘤发生发展的过程中具有重要作用,可以抑制肿瘤细胞的增殖和迁移。肿瘤细胞在机体内属于异己细胞,机体主要以T淋巴细胞的特异性细胞免疫进行免疫清除,发挥抗肿瘤作用。单核细胞则能抑制宿主对肿瘤细胞的免疫功能,并促进肿瘤血管生成,有利于肿瘤细胞逃避免疫细胞的杀伤作用,并进行增殖、迁移和侵袭[16-17]。血液中单核细胞比例与肿瘤细胞的发生和发展密切相关,可能与其抑制T淋巴细胞增殖、阻碍淋巴细胞分化成熟有关[18]。因此,ALC及AMC的变化可以反映细胞的免疫功能是否处于正常状态,ALC减少或AMC增加可作为机体细胞免疫功能异常的信号。研究表明,LMR对肿瘤患者的预后具有一定的预测价值,LMR在评估胃癌患者预后以及肿瘤的发生、发展过程中具有重要作用[19]。本研究的多因素分析结果显示,TNM分期和LMR均是胃癌患者预后的独立影响因素(P<0.01)。高LMR组胃癌患者的5年生存率和5年无病生存率均高于低LMR组患者(P<0.05),提示LMR与胃癌患者的预后密切相关,对胃癌患者的预后具有一定的预测价值。
尽管研究表明ALC、AMC、LMR可用来评估恶性肿瘤的预后,但目前尚无明确的标准进行衡量[20]。对于不同的肿瘤患者,ALC、AMC、LMR的临界值可能不同,例如年龄、免疫功能状态均可能产生一定的影响。
综上所述,外周血LMR对胃癌患者的预后具有较好的预测价值,然而本研究纳入的样本量较小,仍需要大样本量的前瞻性研究进一步验证。
