固相萃取-GC/LC-MS/MS测定茶叶中79种农药残留
2019-10-15曾艳郎红杨巧慧李霞雪史朝婷
曾艳,郎红,杨巧慧,2,李霞雪,史朝婷
固相萃取-GC/LC-MS/MS测定茶叶中79种农药残留
曾艳1,郎红1,杨巧慧1,2,李霞雪1,史朝婷1
1. 雅安市农产品质量监测检验中心,四川 雅安 625000;2. 四川农业大学食品学院,四川 雅安 625000
建立了一套以一次固相萃取前处理方法,运用气相色谱-串联质谱(GC-MS/MS)和液相色谱-串联质谱(LC-MS/MS)两种检测技术,测定茶叶中79种农药残留的可靠、快速、高通量检测方法。该方法用20 mL乙腈一次均质提取,分取提取液10 mL,用乙腈+甲苯(3∶1)20 mL洗脱过Carbon/NH2小柱净化,用5 mL乙腈定容混匀,于GC-MS/MS和LC-MS/MS同时检测。结果表明,79种农药在0.01~0.40 mg·L-1范围内线性良好,相关系数(R)在0.995以上;高、低、中3种水平加标回收率在67.3%~130.8%内;相对标准偏差(RSD)在15%内;98.7%的农药定量限(LOQ)≤0.01 mg·kg-1;使用多种类茶叶实际检测,结果均合格。因此,该方法能同时检测含有机磷、有机氯、拟除虫菊酯类、氨基甲酸酯类和有机杂环类5大类农药,更有利于大批量茶叶样品的多农残检测。
茶叶;GC-MS/MS;LC-MS/MS;农药残留
中国是世界茶文化的发源地,茶叶也是中国重要的经济作物和出口农产品,欧洲国家和日本是我国茶叶的重要进口国。在茶产业快速发展的同时,其卫生质量和安全也引起了各国的广泛关注,其中尤以农药残留限量关注度最高[1]。国际食品法典委员会(CAC)、欧盟和日本等组织和国家制定的茶叶中最高农药残留限量(MRL)标准极为严苛,并在不断发布新的茶叶进口标准,增加茶叶农残检测项目,提高茶叶农残限量标准[2]。2014年,欧盟共对EC396/2005法规进行了22次修订,附录Ⅱ、Ⅲ、Ⅳ中涉及茶叶农残限量标准分别为242、193和40个,共计475个[3-4]。农药残留检测已成为茶叶贸易中最大的技术壁垒。
目前,茶叶农残检测方法中多为液相色谱-串联质谱法[5-6]和气相色谱-质谱法[7],这些方法只能单一检测某类农药,如有机磷类、氨基甲酸酯类或有机氯类、拟除虫类,且前处理多为QuEChERS法;检测茶叶农残的国标方法多为液相色谱-质谱法[8]和气相色谱-质谱法[9],前处理太过冗长繁锁、试剂用量大,较难满足大批量样品快速分析,其所用检测器为单级质谱,对于基质复杂的茶叶而言,定性较为困难。为了把农药残留控制在MRLs内,迫切需要制定一套可靠、快速、高通量的检测方法。本试验以不同品种茶叶为研究对象,参考了中国[10]、欧盟[11]和日本[12]的残留限量标准(没有限量的农药按日本“一律限量0.01 mg·kg-1”执行),共选择了79种农药(表1),以固相萃取法为前处理手段,采用气相色谱-串联质谱(GC-MS/MS)和液相色谱-串联质谱(LC-MS/MS)两种检测技术联用,建立了茶叶中5大农药类型、79种农药同时检测的高通量方法,实现了短时间内批量样品的多种类农残准确定性定量检测。
2 材料与方法
2.1 仪器与试剂
7890B-7000C型气相色谱-串联质谱仪、1290-6470型超高液相色谱-串联质谱仪,美国安捷伦科技有限公司;T25型高速匀浆机,广州仪科实验室技术有限公司;KL-512型氮吹仪,北京康宁科技有限责任公司;TP-215D型电子天平,北京赛多得期仪器系统有限公司;XH-B型旋涡混合器,江苏姜堰市康健医疗器械有限公司;K600型食品粉碎机,德国博朗公司;TDL-40B型离心机,上海线安亭科学仪器厂。
79种标准溶液(表1)购自国家标准物质中心,质量浓度为100 mg·L-1。固相萃取小柱Mega BE Carbon/NH2购自安捷伦科技有限公司。TPT小柱购自月旭科技(上海)股份有限公司。乙腈、丙酮、乙酸乙酯、甲苯(色谱级)购自美国天地有限公司。其他试剂为分析纯,所用水均为超纯水。
标准溶液的配制:将79种农药标准溶液用1∶1(∶)的乙腈+丙酮稀释成2 mg·L-1的混合标准溶液。
标准曲线的配制:取混合空白茶叶样经前处理后的溶液作为空白基质,分别加入2 mg·L-1的混合标准溶液0.05、0.25、0.5、1、2 mL至10 mL容量瓶后,用空白基质定容混匀,即得到含量为0.01、0.05、0.1、0.2、0.4 mg·L-1的混合农药标准系列溶液。
实际样品测试为实验室随机取样样品,含红茶、绿茶、藏茶、黑茶、黄茶和花茶。
2.2 样品前处理
取试样于食品粉碎机里粉碎,过60目筛(0.25 mm),混匀。称取粉碎混匀试样5.00 g于50 mL离心管中,每个处理1个混合空白样,3个平行样(加入混合标准溶液0.2 mg·kg-1作为试样),加20 mL乙腈,高速匀浆1.5 min,6 000 r·min-1离心6 min。用移液枪取10 mL滤液于150 mL鸡心瓶中,40℃旋转蒸发尽干。加5 mL乙腈+甲苯(3∶1)溶液溶解样品,混匀并洗3次,收集全部洗涤液40℃蒸干,用5 mL乙腈溶解试样,漩涡混匀过微孔膜,装瓶检测。

表1 79种农药在茶叶中限量值
2.3 色谱质谱条件
2.3.1 GC-MS/MS条件
采用Agilent 7890B-7000C气相色谱串联质谱仪,使用Agilent HP-5MS 30 m×250 μm×0.25 μm毛细管柱;进样口温度:270℃;进样量1 μL,不分流进样;柱温箱梯度升温程序:80℃保持2 min后,15℃·min-1升至310℃,保持5 min,共计22.33 min;载气N2≥99.999%,1 mL·min-1恒流模式;离子源温度,230℃;四极杆温度,150℃;电子轰击源电压,70 eV;传输线:280℃;淬灭气,He≥99.999%,2.25 mL·min-1;碰撞气,N2≥99.999%,1.5 mL·min-1;扫描方式,动态多反应监测(DMRM)。
2.3.2 LC-MS/MS条件
采用Agilent 1290-6470超高液相色谱串联质谱仪,使用Agilent C1850 mm×0.30 mm×1.8 µm柱子;进样量1.0 µL;流动相A为甲醇,B为水(含0.1%甲酸);梯度洗脱程序:0~1 min,10% A;1~6.6 min,10%~80% A;6.6~7.0 min,80%~90% A;7.0~7.10 min,90%~98% A;7.10~11.60 min,98% A;11.60~15.00 min,98%~10% A;流速:0.3 mL·min-1;柱温30℃;电喷雾电离(ESI)源,正离子模式;干燥气温度,350℃;干燥气流速10 mL·min-1;雾化器压力,15 psi;鞘气温度,300℃;鞘气流速,11 mL·min-1;毛细管电压,4 000 V;扫描方式,DMRM。
3 结果与分析
3.1 仪器条件优化
3.1.1 GC-MS/MS仪器条件优化
GC-MS/MS通过反复调整色谱柱升温程序和载气流量等关键性气相参数;在保证所有农药有较好分离度的同时,尽量缩短分析时间(44个农药组分19 min内全部检出,图1),在优化好的气相色谱条件下,使用高浓度的混合标准溶液(2 mg·L-1),用全扫描(MS2Scan)方式,NIST谱库搜索比对,得到各待测农药的质谱图。选择1~2个相对丰度较高、质荷比较大、无背景干扰的离子作为母离子进行产物离子扫描(Product ion scan),同时给予不同的碰撞能量电压(Collision energy,CE),找到丰度高的子离子和最佳CE。最后,用选择好的离子对和优化好的CE进行DMRM。最佳色谱质谱条件见2.3.1章节,44种农药组分的保留时间、MRM离子对及最佳CE见表3,MRM总离子图见图1。
3.1.2 LC-MS/MS仪器条件优化
LC-MS/MS反复调整流动相及梯度洗脱程序等关键性液相参数;在优化好的色谱条件下,采用单一标准溶液(2 mg·L-1)对母离子进行全扫描(MS2Scan),同时设置几组不同的裂解电压(Frangment),对照每种标样的相对分子量,找到与相对分子量一致的质荷比作为其母离子,选择母离子响应最大值下的裂解电压,作为后续最优裂解电压;然后进行产物离子扫描,并同时优化CE,找到特征子离子及其最佳CE。最后采用优化好的条件,进行DMRM分析。优化好的最佳色谱质谱条件见2.3.2章节,35种农药组分的保留时间、MRM离子对及最佳CE见表3,MRM总离子图见图2。
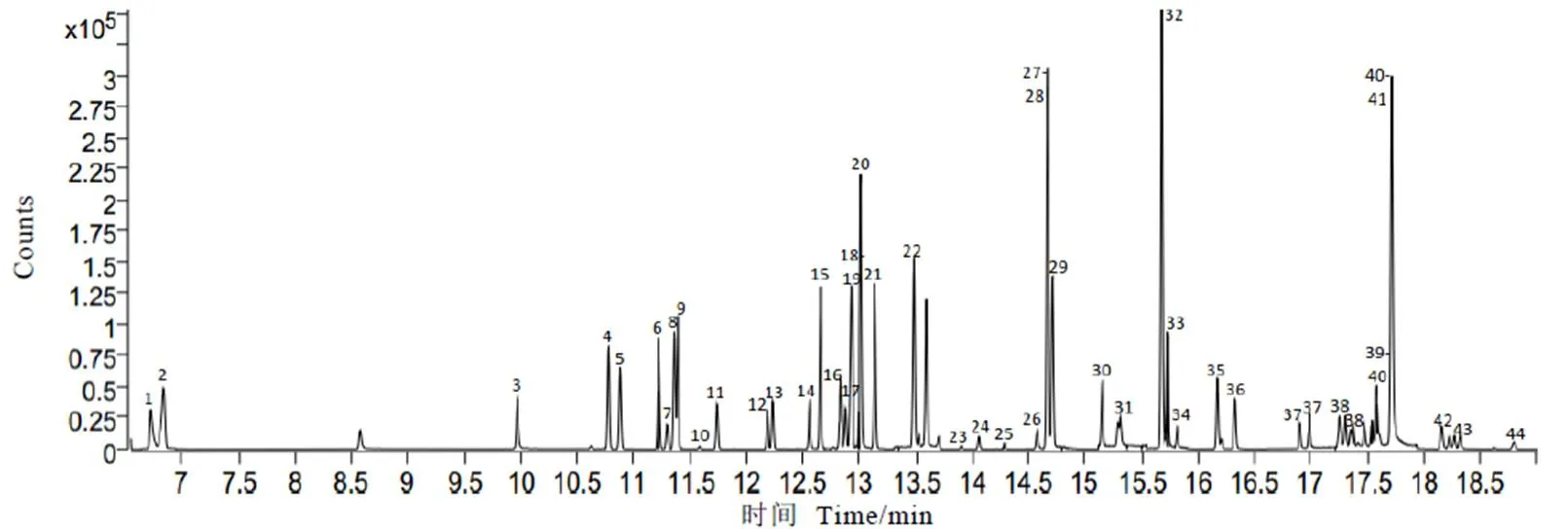
注:图中色谱峰编号对应农药详见表1
3.2 提取方式及提取剂比较
茶叶中的农残提取方式主要有超声[13]、振荡[14]和均质提取[15]等,但超声和振荡提取都不能完全破坏茶叶的细胞壁,对于内吸性农药,难以提取完全。均质提取则可以完全破坏茶叶细胞壁使内吸性农药完全释放,但国标中均质提取两次,使用大量的有机溶剂,操作复杂。因此,本试验采用有机溶剂一次均质提取后,分取适量溶液后续净化。目前,植物性样品中农残检测主要提取溶剂有丙酮、乙酸乙酯、乙腈、甲醇和正己烷[13-14]等。甲醇和正己烷对茶叶组织渗透力不足,难以将极性农药从植物组织中完全萃取,提取效率低,因此本文比较了乙腈、丙酮和乙酸乙酯3种有机试剂均质提取效果。
如表2所示,经乙腈1次均质提取后的农药,在两种仪器上的平均回收率分别为80.9%和103.9%,经丙酮提取的分别为82.4%、174.7%,经乙酸乙酯提取后的分别为82.1%、164.9%。分别经丙酮和乙酸乙酯提取后的农药于LC-MS/MS上检测(35个),分别有6个和3个回收率小于70%,说明提取不完全;于GC-MS/MS上检测(44个)回收率普遍偏大,分别有35个和36个的农药回收率超过130%,另有极小部分农药(百菌清、p.p′-DDD、三氯杀螨醇)在两种提取剂中回收率均低于70%。由此可见,丙酮和乙酸乙酯对大多数农药的提取效果不错,但提取的杂质也较多,后续净化难度大,由此导致大量农药回收率超过130%。以上结果同时表明,用乙腈一次均质提取,效果也很佳,不需要再次加入乙腈进行提取。因此,本试验最终选择乙腈作为提取试剂,一次均质提取。
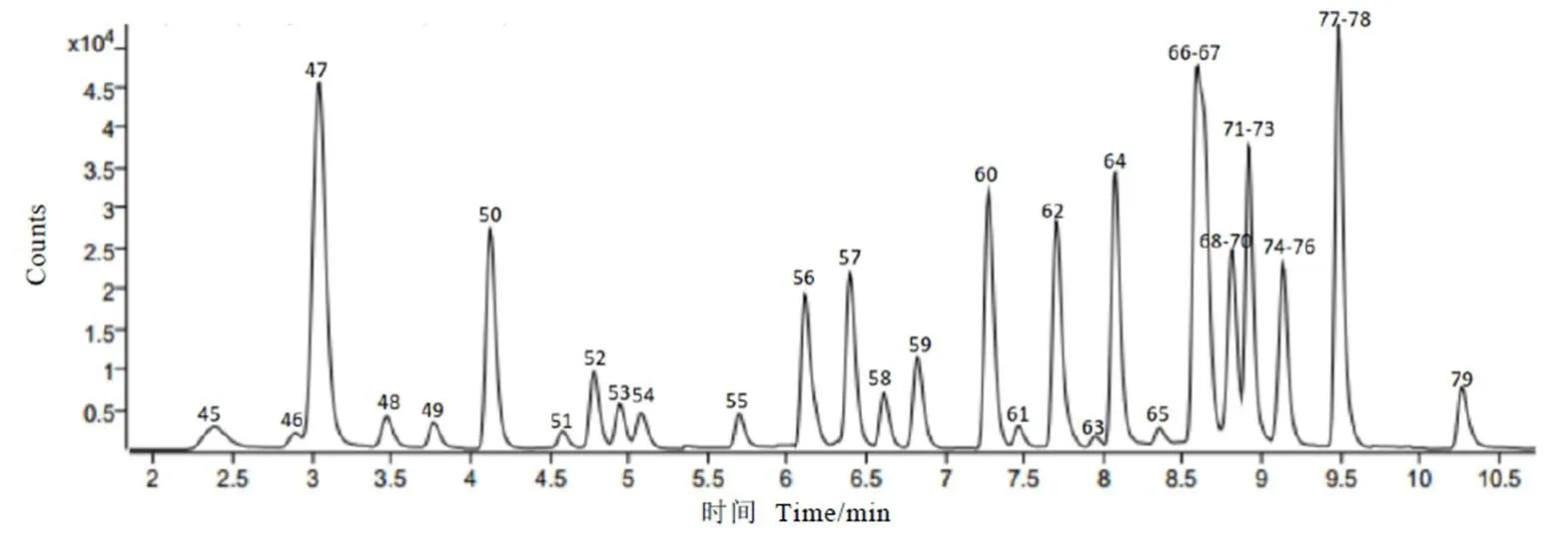
注:图中色谱峰编号对应农药详见表1
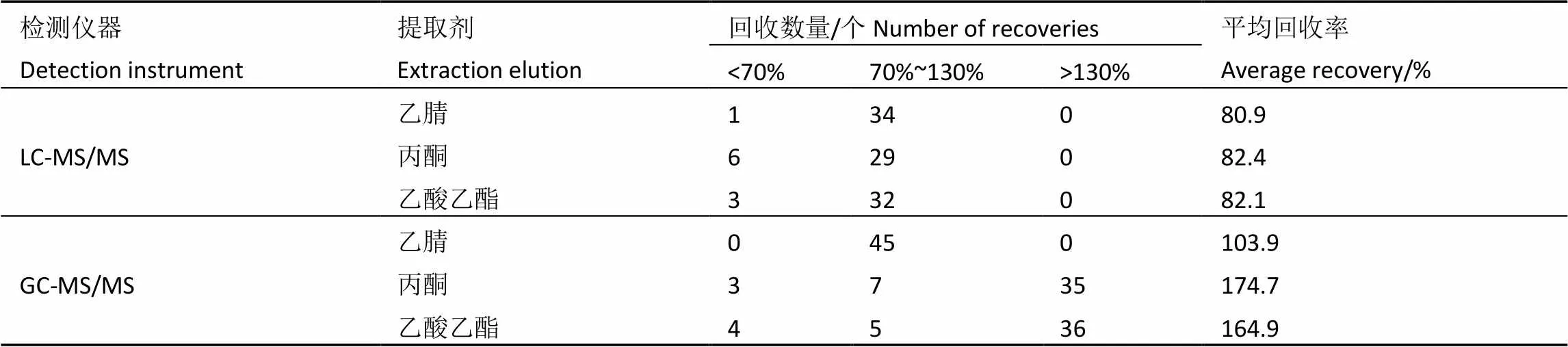
表2 不同提取剂对79种农药回收率的影响
注:农药的添加水平为0.2 mg·kg-1
Note: Pesticide addition level is 0.2 mg·kg-1
3.3 净化洗脱液及净化小柱比较
国标中,对于蔬菜、水果、食用菌的净化为Florisil和Envi-Carbon小柱[15-16],使用正己烷和正己烷加丙酮进行洗脱,洗脱液用量为10 mL;茶叶净化通常使用Cleanert TPT柱[8],采用乙腈加甲苯进行洗脱,用量为25 mL;文献报道固相萃取中常用Cleanert TPT和Envi-Carbon小柱[13,17-18],洗脱液也为正己烷、乙腈、乙腈加甲苯。Florisil柱的色素去除能力较差,不适用于茶叶基质;Carbon/NH2柱除了有较强的色素去除能力外,还有-NH2结构,具有较高的离子交换容量,能有效去除有机酸等极性杂质,使得基质干扰降低许多。因此,本试验以Cleanert TPT和Carbon/NH2小柱进行净化效果比较。洗脱液选择,一是尽量去除非目标物,保留目标物;二是尽量较少溶剂置换,减少溶剂对部分农药的影响。由于Carbon对平面型农药(如百菌清等)有一定的吸附能力,而甲苯是较强极性的洗脱液,能够将吸附在小柱上的农药强有力的洗脱下来。因此,本试验以纯乙腈和乙腈+甲苯(3∶1)作为洗脱液,进行了净化效果比较。
由表3可知,用乙腈作洗脱液时,在LC-MS/MS上检测的农药全部表现为回收率偏低,在GC-MS/MS上检测的农药,有部分偏低(6个),有部分偏高(11个);用TPT小柱进行净化时,在LC-MS/MS上检测的农药,总体回收率表现为偏低(平均回收率为51.99%和70.59%);在GC-MS/MS上检测的农药总体偏高(平均回收率为104.6%和126.7%),总体效果最差,且TPT小柱成本远高于Carbon/NH2,不适合于批量样品检测;使用乙腈+甲苯(3∶1)洗脱,用Carbon/NH2作净化小柱时,效果达到最佳,回收率在70%~130%之间的农药有76个,平均回收率为81.6%和109.0%。综合考虑,本试验选用乙腈+甲苯(3∶1)作洗脱液,用Carbon/NH2作为净化小柱。
3.4 净化洗脱液体积比较
试验中用乙腈+甲苯(3∶1)作洗脱液、Carbon/NH2小柱进行净化,分别使用10、15、20、25、30 mL的乙腈+甲苯(3∶1)进行洗脱。图3为随机选择在GC-MS/MS和LC-MS/MS上检测农药的洗脱体积梯度回收率。5个洗脱梯度下,79种农药的平均回收率分别为:81.3%、83.0%、82.3%、87.4%和86.6%,均在80%~90%,随着洗脱液体积的增加,其平均回收率总体呈上升趋势;但20 mL之后,在GC-MS/MS上检测农药的回收率仍在增大,洗脱体积为30 mL时,回收率在105.4%~151.8%,超过130%的农药有4个;而LC-MS/MS上检测农药的回收率则整体表现为下降,到30 mL洗脱体积时,其平均回收率在34.1%~80.8%,有33个农药回收率低于70%。这主要的原因是茶叶中的复杂基质干扰直接影响了待测物定量的准确性,目标农药在较低洗脱液的使用下,已经完全洗脱下来,随着洗脱体积的增大,一部分干扰物被洗脱下来(如色素),影响了目标农药的准确定量。因此,本试验选择20 mL的乙腈+甲苯(3∶1)洗脱液净化,以适应所有试验农药的检测。

表3 不同洗脱液和净化小柱对79种农药回收率的影响
注:农药的添加水平为0.2 mg·kg-1
Note: Pesticide addition level is 0.2 mg·kg-1

注:(A)GC-MS/MS检测农药,(B)LC-MS/MS检测农药 Note: (A) detected by GC-MS/MS, (B) detected by LC-MS/MS
3.5 标准曲线、加标回收率及定量限
按以上方法配制了标准曲线,以目标组分的响应面积()对相应的质量浓度(,mg·L-1)绘制了标准曲线。结果发现,在0.01~0.40 mg·L-1范围内线性良好,相关系数均大于0.995。用本方法进行了0.02、0.20、0.40 mg·kg-1的加标回收试验,3种加标水平下,其回收率达到67.3%~130.8%,相对标准偏差(RSD)<15%;以信噪比(S/N)>10确定79种农药的定量限(LOQ),除甲胺磷定量限为0.02 mg·kg-1外,其他均可达到0.01 mg·kg-1,特别是LC-MS/MS检出农药,其定量限在0.000 2~0.009 0 mg·kg-1,比GC-MS/MS定量限更低(表4)。
3.6 实际样品检测
对于茶叶的检测,茶叶中的基质干扰较为严重,不同种类的茶叶,其内容物质差异也较大,对农残检测的干扰也不同,为了排除这些干扰,本研究将上一年度检测无该79种农药残留的红茶、绿茶、藏茶、黑茶、黄茶和花茶样品作为空白试验样本,减少了不同茶叶基质对试验方法的干扰。
应用本研究所建立的方法对2018年实验室随机抽取茶叶样品:绿茶52份,红茶19份,藏茶17份,黑茶5份,黄茶5份,花茶2份共100份进行了检测。结果表明,100份样品中GC-MS/MS共检出农药166次:联苯菊酯60次,氯氟氰菊酯49次,甲氰菊酯22次,三氯杀螨醇22次,硫丹1次,氯菊酯1次;LC-MS/MS上共检出农药207次:毒死蜱59次,噻嗪酮45次,吡虫啉39次,哒螨灵32次,多菌灵19次,啶虫脒13次,其他农药均未检出,所有检出农药均未超出国家限量值,合格率100%。由检出的农药种类可见,高毒、高残留的有机磷类农药均未检出,检出率最高的是低毒、低残留的拟除虫菊酯类农药(检出132次),表明这是茶叶常用农药类。

表4 茶叶中79种农药的仪器采集条件、相关系数、添加回收率和定量限(n=3)
注:*标注为定量离子对
Note: Marked*are the quantitative ion pairs
续表4

农药名称Pesticide name保留时间/minRetention time离子对/m·z-1Tranisition裂解电压Fragment/V碰撞能量电压CE/VR2添加水平Add level/mg·kg-1定量限LOQ/mg·kg-1 0.020.20.4 回收率/%RSD/%回收率/%RSD/%回收率/%RSD/% p.p′-DDD14.72235.0-199.1/235.0-165.2*/20/150.999 189.112.4117.88.099.84.10.041 7 p.p′-DDE15.16235.0-199.1/235.0-165.2*/20/150.999 172.310.7121.18.2103.32.00.011 6 炔螨特Propargite15.31149.9-135.1/135.0-77.1*/30/50.999 4105.113.5105.15.8113.52.10.015 2 联苯菊酯Bifenthrin15.69181.2-166.2/181.2-165.2*/25/100.999 4108.010.4124.87.896.11.40.011 4 亚胺硫磷Phosmet15.74160.0-133.1/160.0-77.1*/20/100.999 2118.18.2124.18.7110.72.00.011 4 甲氰菊酯Fenpropathrin15.83181.0-127.0/207.9-181.0*/5/350.998 299.411.6129.010.997.30.60.010 2 伏杀硫磷Phosalone16.19182.0-102.1/182.0-111.0*/15/150.999 2109.211.1126.910.0107.61.80.010 9 氯氟氰菊酯Cyhalothrin16.32197.0-141.0/208.0-181.1*/5/100.999 0106.711.873.610.2103.30.90.010 9 氯菊酯Prermethrin16.96183.1-165.1/183.1-168.1*/10/100.999 397.514.174.14.2102.21.30.006 2 氟氯氰菊酯Cyfluthrin17.32162.9-90.9/162.9-127.0*/5/150.999 0110.89.4114.38.7100.30.10.006 6 氯氰菊酯Cypermethrin17.56164.9-91.01/63.0-127.0*/5/100.999 1115.08.1111.47.6102.11.90.008 1 氟氰戊菊酯Flucythrinate17.67198.9-157.9/156.9-107.1*/15/100.999 2113.17.8109.55.4101.90.50.010 9 醚菊酯Ethofenprox17.73163.0-135.1/163.0-107.1*/20/100.999 0112.312.0117.36.2100.80.00.011 4 氰戊菊酯Fenvalerate18.26167.0-89.0/167.0-125.1*/15/400.999 2130.35.1117.95.4105.20.70.007 0 氟胺氰菊酯Tau-fluvalinate18.26250.0-200.0/250.0-55.0*/15/200.999 3110.19.5128.810.2107.10.80.008 9 溴氰菊酯Deltamethrin18.81250.7-172.0/252.9-93.0*/10/50.999 5115.24.4127.710.4112.11.40.012 2 涕灭威亚砜Aldicarb-sulfoxide3.77207.0-89.0/207.0-132.0*805/50.999 891.74.883.52.288.82.90.000 5 涕灭威砜Aldicarb-sulfone4.16223.0-148.0/223.0-86.0*1105/150.999 881.53.588.76.291.60.30.005 3 多菌灵Carbendazim4.38192.0-132.0/192.0-160.0*10025/150.999 484.48.274.81.498.94.40.000 5 灭多威Methomyl4.61163.1-106.2/163.1-88.2*705/50.999 380.84.982.76.189.61.10.000 6 噻虫嗪Thiamethoxam4.82292.1-181.1/292.1-211.1*8025/100.999 582.56.585.10.992.10.90.000 3 久效磷Monocrotophos5.07224.1-127.1/224.1-192.9*8010/50.999 3127.51.5115.25.1116.63.20.000 6 吡虫啉Imidacloprid5.53256.0-175.0/256.0-209.0*8010/100.999 879.414.481.53.593.80.50.001 0 乐果Dimethoate5.93230.0-125.1/230.0-199.0*8020/50.999 578.39.991.42.391.50.00.007 7 3-克百威3-Hydroxycarbofuran5.93238.0-181.0/238.0-163.0*805/100.999 478.54.287.49.178.53.90.000 4 啶虫脒Acetamiprid5.96223.1-90.1/223.1-126.0*11040/250.999 378.013.685.61.791.01.30.000 5 涕灭威Aldicarb6.77116.0-70.0/116.0-89.0*805/50.999 181.12.182.32.387.52.00.000 4 磷胺Phosphamidon6.96300.1-227.0/300.1-174.1*11010/150.999 276.310.388.51.392.51.70.001 6 克百威Carbofuran7.42222.0-123.1/222.0-165.1*10020/100.999 583.46.182.94.288.10.10.000 3 甲萘威Carbaryl7.64202.0-117.9/202.0-145.0*805/50.999 682.85.779.54.677.48.60.000 2 嘧霉胺Pyrimethanil8.16200.2-82.1/200.2-107.1*12030/250.999 288.37.783.91.491.52.00.001 1 甲霜灵Metalaxyl8.20280.2-248.1/280.2-220.1*9010/100.999 587.08.385.72.992.60.20.000 2
续表4
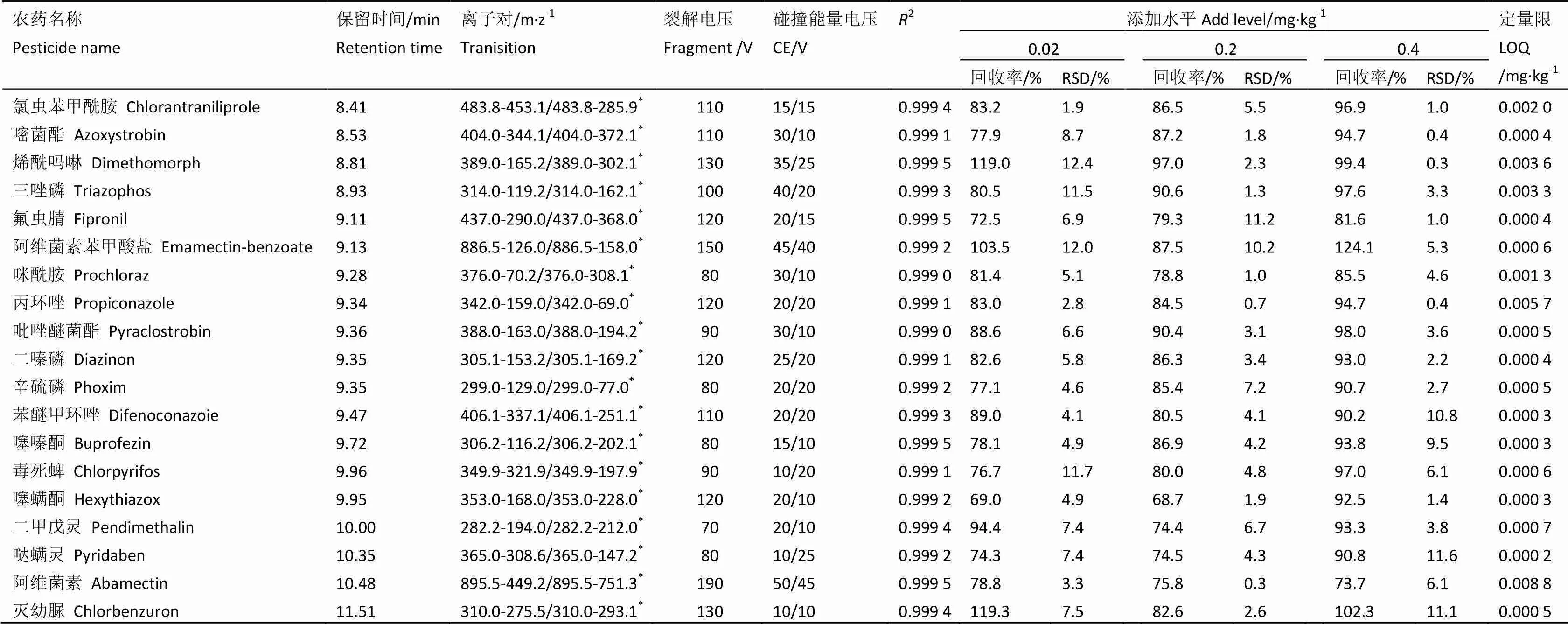
农药名称Pesticide name保留时间/minRetention time离子对/m·z-1Tranisition裂解电压Fragment /V碰撞能量电压CE/VR2添加水平Add level/mg·kg-1定量限LOQ/mg·kg-1 0.020.20.4 回收率/%RSD/%回收率/%RSD/%回收率/%RSD/% 氯虫苯甲酰胺Chlorantraniliprole8.41483.8-453.1/483.8-285.9*11015/150.999 483.21.986.55.596.91.00.002 0 嘧菌酯Azoxystrobin8.53404.0-344.1/404.0-372.1*11030/100.999 177.98.787.21.894.70.40.000 4 烯酰吗啉Dimethomorph8.81389.0-165.2/389.0-302.1*13035/250.999 5119.012.497.02.399.40.30.003 6 三唑磷Triazophos8.93314.0-119.2/314.0-162.1*10040/200.999 380.511.590.61.397.63.30.003 3 氟虫腈Fipronil9.11437.0-290.0/437.0-368.0*12020/150.999 572.56.979.311.281.61.00.000 4 阿维菌素苯甲酸盐Emamectin-benzoate9.13886.5-126.0/886.5-158.0*15045/400.999 2103.512.087.510.2124.15.30.000 6 咪酰胺Prochloraz9.28376.0-70.2/376.0-308.1*8030/100.999 081.45.178.81.085.54.60.001 3 丙环唑Propiconazole9.34342.0-159.0/342.0-69.0*12020/200.999 183.02.884.50.794.70.40.005 7 吡唑醚菌酯Pyraclostrobin9.36388.0-163.0/388.0-194.2*9030/100.999 088.66.690.43.198.03.60.000 5 二嗪磷Diazinon9.35305.1-153.2/305.1-169.2*12025/200.999 182.65.886.33.493.02.20.000 4 辛硫磷Phoxim9.35299.0-129.0/299.0-77.0*8020/200.999 277.14.685.47.290.72.70.000 5 苯醚甲环唑Difenoconazoie9.47406.1-337.1/406.1-251.1*11020/200.999 389.04.180.54.190.210.80.000 3 噻嗪酮Buprofezin9.72306.2-116.2/306.2-202.1*8015/100.999 578.14.986.94.293.89.50.000 3 毒死蜱Chlorpyrifos9.96349.9-321.9/349.9-197.9*9010/200.999 176.711.780.04.897.06.10.000 6 噻螨酮Hexythiazox9.95353.0-168.0/353.0-228.0*12020/100.999 269.04.968.71.992.51.40.000 3 二甲戊灵Pendimethalin10.00282.2-194.0/282.2-212.0*7020/100.999 494.47.474.46.793.33.80.000 7 哒螨灵Pyridaben10.35365.0-308.6/365.0-147.2*8010/250.999 274.37.474.54.390.811.60.000 2 阿维菌素Abamectin10.48895.5-449.2/895.5-751.3*19050/450.999 578.83.375.80.373.76.10.008 8 灭幼脲Chlorbenzuron11.51310.0-275.5/310.0-293.1*13010/100.999 4119.37.582.62.6102.311.10.000 5
4 讨论与结论
本研究采用1次均质提取,固相萃取净化技术进行前处理,利用GC-MS/MS和LC-MS/MS同时测定茶叶中79种农药残留。试验用20 mL乙腈1次均质提取,分取提取液10 mL,用乙腈+甲苯(3∶1)20 mL洗脱过Carbon/NH2小柱净化,用乙腈定容混匀,于GC-MS/MS和LC-MS/MS同时检测。结果表明,79种农药在0.01~0.40 mg·L-1范围内线性良好,相关系数(R)在0.995以上;高、低、中3种水平加标回收率在67.3%~130.8%内;相对标准偏差(RSD)在15%内;满足多农残检测的准确度和精密度,98.7%的农药定量限(LOQ)≤0.01 mg·kg-1,定量准确;使用多种类茶叶实际检测,结果合格,应用可靠。
该方法只测试了79种农药,局限于笔者实验室现有农药标准品,但种类齐全,涵盖了欧盟、日本和中国标准中茶叶限量的5种主要农药类型(有机磷、有机氯、拟除虫菊酯、氨基甲酸酯和有机杂环类),避免了只单一检测其中某类农药的弊端。在以后试验中,可增加更多的农药标准品,以期更有利于大批量茶叶样品的多农残检测。
[1] 徐田华. 我国茶叶出口面临的问题及对策[J]. 茶叶通讯, 2016, 43(4): 55-58.
[2] 焦广霞, 肖颖. 欧盟茶叶限量标准对茶叶出口的影响及建议[J]. 农业开发与装备, 2016(9): 47.
[3] 文洋, 谭君, 谭斌, 等. 茶叶中农药残留检测方法研究进展[J]. 食品安全质量检测学报, 2017, 8(3): 1-5.
[4] European Commission. Commission regulation (EC) No 149/2008 of 29 January 2008 amending Regulation No 396/2005 of the European Parliament and of the Council by establishing Annexes Ⅱ, Ⅲ and Ⅳ setting maximum residue levels for products covered by Annex I thereto [J]. Official Journal of the European Union, 2008, 3(1): L58).
[5] 贾玮, 黄峻榕, 凌云, 等. 高效液相色谱-串联质谱法同时测定茶叶中290种农药残留组分[J]. 分析测试学报, 2013, 32(1): 9-22.
[6] 周利, 罗逢健, 张新忠, 等. 纳米竹炭分散固相萃取/超高效液相色谱-串联质谱法测定绿茶中的农药多残留[J]. 分析测试学报, 2014, 33(6): 642-647.
[7] 李霞, 王兰兰, 张季, 等. 一种基于GC-MS的茶叶中13种农残的同时检测方法[J]. 广州化工, 2017, 45(7): 84-86.
[8] 国家食品药品监督管理总局. 食品安全国家标准茶叶中448种农药及相关化学品残留量的测定液相色谱-质谱法: GB 23200.13—2016[S]. 北京: 中国标准出版社, 2016.
[9] 中华人民共和国国家质量监督检验检疫总局. 茶叶中519种农药及相关化学品残留量的测定气相色谱-质谱法: GB/T 23204—2008[S]. 北京: 中国标准出版社, 2009.
[10] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准食品中农药最大残留限量: GB 2763—2016[S]. 北京: 中国标准出版社, 2017.
[11] European Commission. Commission Regulation (EU) No 79/2014 of 29 January 2014 amending Annexes Ⅱ, Ⅲ and Ⅴ to Regulation (EC) No 396/2005 of the European Parliament and of the Council as regards maximum residue levels for bifenazate, chlorpropham, esfenvalerate, fludioxonil and thiobencarb in or on certain products [J]. Official Journal of the European Union, 2014, 1(30): L27.
[12] 《食品中农业化学品残留限量》编委会. 食品中农业化学品残留限量: 药品卷日本肯定列表制度[M]. 北京: 中国标准出版社, 2006.
[13] 颜鸿飞, 王美玲, 陈练, 等. 固相萃取-气相色谱-串联质谱法测定茶叶中9种农药残留量[J]. 化学分析计量, 2016, 25(6): 62-66.
[14] 褚能明, 孟霞, 康月琼, 等. 分散固相萃取-气相色谱-串联质谱法测定茉莉花茶中86种农药残留[J]. 食品科学, 2016, 37(24): 239-246.
[15] 中华人民共和国国家质量监督检验检疫总局. 水果和蔬菜中450种农药及相关化学品残留量的测定液相色谱-串联质谱法: GB/T 20769—2008[S]. 北京: 中国标准出版社, 2009.
[16] 中华人民共和国农业部. 蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定: NY/T 761—2008[S]. 北京: 中国农业出版社, 2008.
[17] 陈玉珍. 一种优化检测茶叶中14种有机磷农残的新技术[J].福建茶叶,2011, 33(4): 15-17.
[18] 蒋永祥, 叶丽, 汤淼荣. 茶叶中7种有机磷农残留量的同时测定[J]. 分析实验室, 2007, 26(1): 97-101.
Determination of 79 Pesticide Residues in Tea by Solid Phase Extraction with GC-MS/MS and LC-MS/MS
ZENG Yan1, LANG Hong1, YANG Qiaohui1,2, LI Xiaxue1, SHI Chaoting1
1. Ya'an Quality Inspection of Agricultural Products Monitoring Center, Ya'an 625000, China;2. College of Food Science, Sichuan Agricultural University, Ya'an 625000, China
In order to detect various pesticide residues in tea, a reliable, rapid and high throughput detection method was established: a solid phase extraction was developed for the determination of 79 pesticide residues in tea by gas chromatography-tandem mass spectrometry (GC-MS/MS) and liquid chromatography-tandem mass spectrometry (LC-MS/MS). These samples were extracted by 20 mL acetonitrile. 10 mL extracts were cleaned by Carbon/NH2column with 20 mL acetonitrile + toluene (3∶1) and then mixed with 5 mL acetonitrile, then these procdssed samples were detected by GC-MS/MS and LC-MS/MS, respectively. The results show that the concentrations of 79 pesticide residues had good linearity relationships in the range of 0.01-0.40 mg·L-1, with the correlation coefficients (R) above 0.995, the recoveries of high, low and medium levels were ranged from 67.3%-130.8%, the relative standard deviations (RSDs) were less than 15%, the limits of quantification (LOQs) of 98.7 % pesticides were less than or equal to 0.01 mg·kg-1, multiple types of tea were detected, and the results were proved to be qualified. Consequently, the method can simultaneously detect 5 kinds of pesticides, including organophosphorus, organochlorine, pyrethroids, carbamates and organic heterocyclic pesticides, which would be useful to determine multi-pesticide residues in high numbers of tea samples.
tea, GC-MS/MS, LC-MS/MS, pesticide residues
S571.1;O657.63
A
1000-369X(2019)05-576-11
2019-03-01
2019-04-24
雅安市重点科技项目(2017yyjskf05)
曾艳,女,硕士研究生,高级农艺师,主要从事农产品及产地环境质量安全研究,Email: 276874503@qq.com
