葡萄糖调节蛋白78在卵巢癌侵袭转移中的作用
2019-10-14余美玲肖成炜张苗苗王才智
顾 雪,余美玲,肖成炜,张苗苗,王才智
卵巢癌是女性生殖器官最常见的三大恶性肿瘤之一,在妇科恶性肿瘤中发病率居第2位,其病死率居首位[1],其中卵巢浆液性癌占卵巢癌的75%。由于卵巢位置较深,早期病变不易发现,缺乏特异的早期临床表现及诊断方法,约70%的卵巢癌病人在发现时已属晚期,并有广泛的盆腔、腹腔、淋巴结转移或腹水形成[2]。
研究[3]表明,内质网应激(ERS)反应可能与肿瘤的发生、发展、转移及预后密切相关。而葡萄糖调节蛋白78(GRP78)是一种内质网分子伴侣,在ERS出现时其表达上调[4]。GRP78的主要功能包括促进新合成蛋白的折叠、聚集,识别内质网中的异常折叠蛋白并诱导其降解,充当内质网应激感受器等。随着对GRP78 细胞内定位认识的不断深入,研究[5-6]发现除内质网外,肿瘤细胞表面也存在 GRP78 的表达。细胞表面 GRP78 被认为是一种受体样多功能蛋白,可以通过与不同的配体结合,在肿瘤细胞的增殖、凋亡、侵袭转移和耐药性中发挥重要的调节作用[7-8]。目前,细胞表面 GRP78 在调节肿瘤侵袭转移中的作用及可能的分子机制已成为研究的热点。本研究拟通过免疫组织化学法和Western blot检测GRP78在卵巢浆液性癌及卵巢浆液性囊腺瘤的表达情况,探讨GRP78在卵巢癌的发生发展、侵袭转移中的临床意义。
1 材料与方法
1.1 实验材料 低转移潜能卵巢癌细胞HO-8910、高转移潜能卵巢癌细胞HO-8910PM购于上海通派生物科技公司。二甲基亚砜从Sigma-Aldrich公司购买。GRP78一抗以及二抗从Cell Signaling公司购买。shRNA-GRP78、pcDNA-GRP78和LipofectamineTM2000均从上海吉玛基因公司购买。
收集2013年12月至2018年12月蚌埠医学院第二附属医院存档的60例卵巢浆液性癌组织及同时期40例卵巢浆液性囊腺瘤组织标本。卵巢癌病人年龄46~72岁;组织学类型均为浆液性腺癌;病理分级低级23例,高级37例;临床分期Ⅰ、Ⅱ期25例,Ⅲ、Ⅳ期35例;术后经病理证实有淋巴转移者13例,无淋巴转移者47例;有盆腔转移者36例,无盆腔转移者24例;盆腔外转移者19例,无盆腔外转移者41例。卵巢囊腺瘤病人年龄20~66岁,均为浆液性囊腺瘤。病例均经手术和病理确诊,术前均未接受放疗、化疗和免疫治疗等相关治疗,有完整临床及病理资料。
1.2 方法
1.2.1 免疫组织化学染色 采用免疫组织化学法测定GRP78的表达,样本经10%甲醛固定,常规石蜡包埋,制成5 μm连续切片;然后依次经过脱蜡、脱苯、水化、抗原修复、封闭内源性过氧化物酶后,于室温下静置20 min,随后在4 ℃孵育一抗过夜。然后切片孵育带荧光标记的二抗,室温下孵育20 min,PBS洗片3次,每次5 min,滴加DAB显色溶液染色2 min,并将切片置于显微镜下观察显色结果;终止反应后以苏木素复染1 min,盐酸乙醇分化、脱水、二甲苯透明、中性树胶封片,待中性树胶干后,置于显微镜下观察拍片,并对阳性染色进行观察。对染色的细胞进行如下评分:显色细胞≤10%,为阴性(-);显色细胞>10%~25%,为阳性(+);显色细胞>25%~50%,为阳性(2+);显色的细胞≥50%,为阳性(3+)。按GRP78表达情况进行分层,显色阳性细胞<50%为低表达GRP78组,而显色阳性细胞≥50%为高表达GRP78组,比较2组卵巢浆液性癌病人临床指标之间的关系。
1.2.2 Western blotting法检测蛋白表达 组织蛋白提取操作步骤如下:取-80 ℃保存的卵巢浆液性癌组织和卵巢浆液性囊腺瘤组织标本,在液氮下碾成粉状,冰上裂解30 min,匀质,1 000 r/min离心10 min,收集上清液。细胞蛋白提取操作如下:取生长状态良好的细胞,使用胰酶消化细胞,收集细胞悬液于4 mL的离心管中,2 500 r/min离心10 min,弃上层液体,加细胞裂解液,冰上裂解30 min,4 ℃、12 000 r/min离心收集样品。BCA法检测样品蛋白含量,蛋白定量后与上样缓冲液1∶1混合,100 ℃煮沸5 min,变性的蛋白于-20 ℃保存。每道上样30 μg蛋白,经聚丙稀酰胺凝胶电泳后湿式转膜。PVDF膜放入5%脱脂奶粉中,室温封闭2 h,一抗4 ℃孵育过夜,二抗室温孵育2 h,最后在暗室中显影、定影、洗净、晾干。采用图像分析软件Gene Tools V3.04b分析蛋白条带灰度,以β-actin作为内参对照。
1.2.3 HO-8910、HO-8910PM细胞株转染 转染细胞分为3组:对照组、阴性对照组和shRNA-GRP78或pcDNA-GRP78组。依据试剂盒操作步骤,将细胞接种于6孔板中培养24 h,使用LipofectamineTM2000将shRNA-GRP78、pcDNA-GRP78分别转染至HO-8910细胞、HO-8910PM细胞,再加入无血清培养液培养6 h,吸去上述液体,加入正常培养基进行培养。
1.2.4 Transwell法检测细胞侵袭、迁移能力 取对数生长期细胞接种于铺有30 μL Matrigel基质胶的Transwell 板上室。下室为600 μL含10%胎牛血清的RPMI 1640培养基。常规培养48 h后,用棉签擦去上层细胞,下层细胞用4%多聚甲醛固定并用结晶紫染色。将固定染色的细胞置于倒置显微镜下观察拍照,任选5个视野进行计数,取平均值。
1.3 统计学方法 采用两独立样本t检验、χ2检验、方差分析和q检验。
2 结果
2.1 GRP78在卵巢浆液性癌和卵巢浆液性囊腺瘤组织中的表达 免疫组织化学结果显示,GRP78蛋白定位于细胞质中,呈棕黄色颗粒(见图1),40例卵巢浆液性囊腺瘤组织中GRP78阴性表达30例(75%),GRP78阳性表达10例(25%),60例卵巢浆液性癌组织中GRP78阴性表达6例(10%),阳性表达54例(90%);卵巢浆液性癌组织中GRP78阳性表达明显高于卵巢浆液性囊腺瘤组织(χ2=44.01,P<0.01)。Western blotting结果显示,GRP78在卵巢浆液性癌组织的蛋白表达明显高于卵巢浆液性囊腺瘤组织(见图2)。


2.2 GRP78的表达与卵巢浆液性癌临床病理指标之间的关系 GRP78的表达量与病人的病理分级相关,GRP78表达量越高,卵巢浆液性癌病人病理分级程度越高,临床病理分期分析结果与病理分级结果一致。且与低表达GRP78的卵巢癌病人相比,高表达GRP78组的病人,糖类抗原125(CA125)指标更高。发生淋巴结转移、盆腔转移、盆腔外转移的比例更高(P<0.01)(见表1)。
2.3 GRP78在HO-8910细胞和HO-8910PM细胞中的表达 结果显示,与HO-8910细胞比较,HO-8910PM细胞中GRP78的表达明显增加(见图3)。Transwell法检测结果表明,与HO-8910细胞比较,HO-8910PM细胞的侵袭、迁移能力明显升高(见图4~5、表2)(P<0.01)。
表1浆液性卵巢癌临床指标与GRP78的表达水平的关系[n;百分率(%)]

项目GRP78表达量<50%(n=28)GRP78表达量≥50%(n=32)χ2P年龄/岁 57.57±11.15 60.16±11.34-0.89∗>0.05肿瘤直径/cm11.00±6.1213.54±5.24-1.10∗>0.05CA125/(U/mL)144.00±121.25647.31±499.98-5.51∗<0.01病理分级 低级 高级20(86.92)8(21.63)3(13.17)29(78.43)24.33<0.01临床病理分期 Ⅰ、Ⅱ期 Ⅲ、Ⅳ期22(88.01)6(17.12)3(12.04)29(82.93)29.42<0.01淋巴结转移 无 有28(60.93)0(0.02)18(39.17)14(100.01)15.98<0.01盆腔转移 无 有22(91.76)6(16.75)2(8.34)30(83.33)32.54<0.01盆腔外转移 无 无25(62.06)3(15.83)16(38.02)16(84.28)10.650.01
*示t值



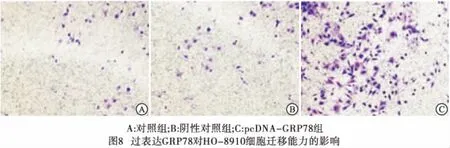
2.4 改变GRP78的表达水平对卵巢癌细胞侵袭、迁移潜能的影响 在HO-8910细胞中过表达GRP78,细胞的侵袭、迁移能力明显升高(P<0.01)(见图6~8、表3)。而在HO-8910PM细胞中干扰GRP78的表达,细胞的侵袭、迁移能力明显降低(P<0.01)(见图9~11、表4)。


分组 侵袭细胞数 迁移细胞数HO-8910细胞 34.20±8.23 16.60±6.35HO-8910PM细胞 113.00±14.21 69.40±4.16t -10.73 -15.56P <0.01 <0.01



分组 侵袭细胞数 迁移细胞数 对照组 34.20±8.23 16.60±6.35 阴性对照组 34.40±9.56 17.80±5.98 pcDNA-GRP78组 108.60±18.89 64.80±10.35F 53.51 61.86P <0.01 <0.01MS组内 9 200.867 3 778.067


分组 侵袭细胞数 迁移细胞数 对照组 111.40±14.28 69.40±4.16 阴性对照组 106.00±6.33 66.40±8.30 shRNA-GRP78组 39.80±8.44 19.80±5.68F 75.70 98.07P <0.01 <0.01MS组内 7 948.467 3 867.267

3 讨论
正常细胞在缺氧、酸中毒等应激状态下会产生ERS,ERS可导致细胞内GRP78含量增加,使细胞的耐受性增强,保护细胞抵抗有害刺激的损伤,保持内环境稳态[9]。在肿瘤细胞中,ERS成为其主要反应方式,从而导致GRP78持续升高,使肿瘤细胞对缺氧、酸中毒等因素的耐受性增加[10]。GRP78高表达存在于多种肿瘤中,包括泌尿系、消化系、乳腺、脑和呼吸系统肿瘤等[11]。ZHANG等[12]在消化系统肿瘤研究中发现,GRP78的表达升高与胃癌的淋巴结转移呈正相关关系,并导致病人的不良预后。使用RNAi技术定向下调GRP78表达,可明显降低胃癌细胞的淋巴转移能力。同样在头颈部肿瘤研究中,CHIU等[13]以RNAi技术定向基因敲除GRP78在多个头颈部鳞癌培养细胞系中的表达发现,在基因敲除鳞癌细胞系中,反映肿瘤转移能力的局部细胞克隆团块形成能力从53%下降至12%,并且在原位体外肿瘤转移抑制率可达到67%,抑制肝转移率降低约90%。


本研究检测了GRP78在卵巢浆液性癌及卵巢浆液性囊腺瘤标本中的表达,免疫组织化学检测结果显示卵巢浆液性癌组织中GRP78阳性细胞的比例明显高于卵巢浆液性囊腺瘤组织。在本研究中,首次观察到了GRP78表达量高的卵巢浆液性癌病人,肿瘤分级和临床病理分期更高,CA125水平更高、肿瘤体积更大。且GRP78表达量高的病人,发生淋巴结转移、盆腔转移、盆腔外转移所占比例更高。以上结果说明GRP78可能为卵巢癌病人重要的预后因子。
体外研究中,Western blot结果显示,与转移潜能低的HO-8910细胞相比,转移潜能高的HO-8910PM细胞GRP78表达明显升高。在HO-8910细胞中过表达GRP78,细胞发生侵袭、迁移能力增强;相反,在HO-8910PM细胞中沉默GRP78可以降低细胞的侵袭、迁移能力。
本研究仅揭示了GRP78可促进卵巢癌的侵袭、迁移,但GRP78如何促进卵巢癌的转移尚不清楚。有研究报道,GRP78的表达水平与肝癌细胞的恶性程度呈正相关关系,它通过激活FAK及MMP-2促进肝癌的侵袭转移[14-15]。在前列腺癌中,GRP78 与活化的α2巨球蛋白结合,激活 PAK2,导致 LIMK 和 Cofillin磷酸化,从而促进肿瘤细胞的增殖、侵袭和转移;在人畸胎瘤和乳腺癌中,GRP78与 Cripto-1直接结合,抑制TGF-β介导的Smad2/3磷酸化,激活MAPK/PI3K信号通路,下调E-cadherin的表达,促进肿瘤细胞增殖、 侵 袭 和 转 移;在 结 肠 癌 中,GRP78与β1- Integrin结合,活化FAK,激活尿激酶型纤溶酶原,促进细胞外基质的降解,调节肿瘤侵袭和转移[16-18]。
总之,该研究揭示了GRP78可以影响卵巢癌细胞的侵袭迁移能力,提示GRP78可能是卵巢癌病人重要的预后因子之一,但还需要体内实验和对病人随访进一步证实。
