黑鱼鱼片复合保鲜剂的选择及其保鲜效果
2019-10-12任丽琨李婷婷赫彬彬于海凤王当丰熊善柏励建荣
任丽琨 李婷婷 赫彬彬 于海凤 王当丰 刘 楠 谢 晶 熊善柏 励建荣*
(1渤海大学食品科学与工程学院 辽宁省食品安全重点实验室 辽宁锦州 121013
2大连民族大学生命科学学院 辽宁大连 116600
3上海海洋大学食品学院 上海 201306
4华中农业大学食品科技学院 武汉 430070)
黑鱼学名乌鳢(Ophiocephalus argus Cantor),属鲈形目,鳢科,乌鳢种[1],是我国常见的淡水经济鱼类。黑鱼营养价值丰富,富含人体所需的钙、铁等多种微量元素[2],具有很好的药用价值,可促进伤口愈合[3]。黑鱼鱼肉中富含营养物质,蛋白、脂肪含量高,使其在贮藏过程中极易腐败变质,严重制约了其经济发展。寻找适合黑鱼的保鲜方法成为解决这一问题的关键。复合保鲜剂是指应用栅栏理论[4],将不同作用及来源的保鲜剂按一定的比例混合,使其产生协同作用,以达到增强保鲜效果的目的。本文主要选用鱼精蛋白、花椒提取物及菊芋提取物配制复合保鲜剂,以冷藏鱼肉优势腐败菌荧光假单胞菌(Pseudomonas Fluorescens)作为指示菌,经荧光酶标仪测定光密度值(optical density,OD),确定其最佳浓度并进行检验。
鱼精蛋白是从鱼白(鱼精巢)中提取的一种碱性蛋白质,由约30个氨基酸组成,其中三分之二为精氨酸[5],对革兰氏阴性菌具有较好的抑菌效果。鱼精蛋白由于具有安全性高,热稳定性强,抗菌谱广[6]等特点,使其在临床和食品行业中得到广泛应用。李燕等[7]研究表明,鱼精蛋白可以很好地抑制多种腐败菌,安全性较高,作为食品防腐剂具有极大的开发价值。我国近几年来对鱼精蛋白的研究较多,而将其作为复合保鲜剂的组分之一应用于黑鱼鱼片的保鲜研究较少。花椒作为一种常见的食用香料,其主要成分为挥发油、黄酮类、香豆素等抑菌物质[8]。孙伟等[9]研究表明花椒提取物对鲫鱼具有良好的保鲜作用,可作为一种保鲜剂应用于水产品保鲜。菊芋又名洋姜、鬼子姜,是一种多年宿根性草本植物[10]。菊芋除具有观赏价值外,还具有较高的药用价值。刘海伟等[11]研究表明菊芋水提物具有抑菌性。本文将鱼精蛋白及上述两种植物提取物进行复合,通过菌落总数、电导率、白度、质构、低场核磁、挥发性盐基氮(total volatile basic nitrogen,TVB-N)、K 值等指标判断其对黑鱼的保鲜效果并确定其最佳复合比例,为生黑鱼片的保鲜提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验原料及药品 鲜活黑鱼,购于锦州水产市场(每条约2 500 g);食品级花椒水提物、菊芋水提物、鱼精蛋白,均购自陕西森弗天然制品有限公司;氧化镁、高氯酸、氢氧化钾(均为分析纯),国药集团化学试剂有限公司;PCA平板计数琼脂,北京奥星生物技术有限责任公司。
1.1.2 试验仪器及设备 LRH-250A型生化培养箱,上海一恒科技有限公司;imark酶标仪,美国BIO-RAD;LDZX-50F型立式高压灭菌锅,上海申安医疗器械厂;TA-XT2i型质构分析仪,英国Stable Micro Systems公司;CM-14斩拌机,西班牙MAINCA公司;FE20型pH计,梅特勒-托利多仪器(上海)有限公司;FE30型电导率仪,梅特勒-托利多仪器(上海)有限公司;CR-400型色彩色差计,杭州祥盛科技有限公司;Agilent 1100型液相色谱,美国 Agi-lent公司;T25DS25型均质机,上海申鹿均质机有限公司;Kjeltec 8400型全自动凯氏定氮仪,丹麦福斯公司;Stratos型冷冻高速离心机,德国 Thermo Fisher Scientific公司;NMI20核磁共振分析仪,上海纽迈电子科技有限公司。
1.2 试验方法
1.2.1 保鲜剂最佳配比试验 试验组为150 μL保鲜剂+150 μL培养至二代的指示菌及 150 μL无菌水+150 μL培养至二代的指示菌;空白组为150 μL 保鲜剂+150 μL LB 液体培养基、150 μL无菌水+150 μL LB液体培养基。将试验组与空白组加入酶标板中培养24 h后用酶标仪测定在595 nm波长下的OD值。培养液的OD值与培养液中细菌繁殖速度呈正相关,通过培养液OD值的大小可以得知细菌的生长繁殖情况。最终OD595=试验组OD595-对应空白组OD595。
1.2.1.1 单因素试验 根据前期预试验设计单因素试验表,单因素试验设计3组平行。
1.2.1.2 正交试验 利用单因素试验选出最佳的浓度,选用L16(43)正交表设计正交试验,正交试验设置3组平行。
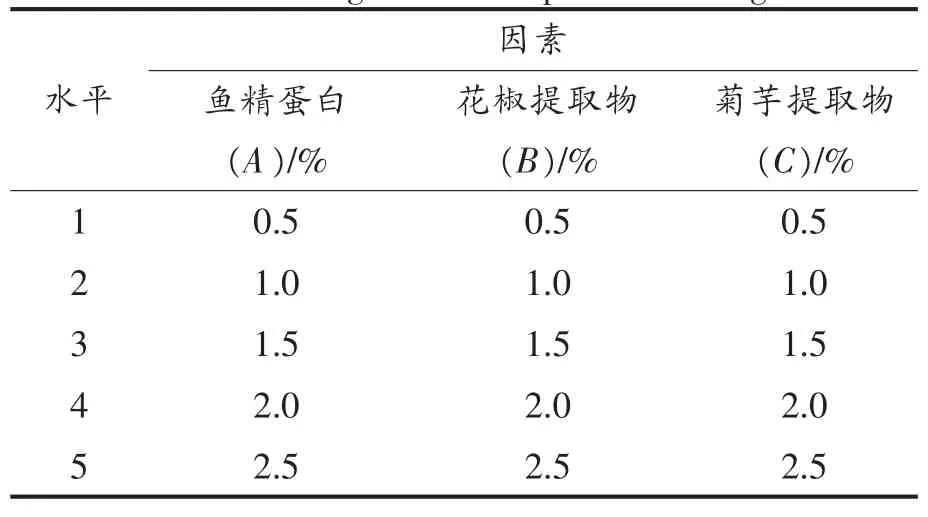
表1 单因素试验设计表Table 1 Single factor experiment design
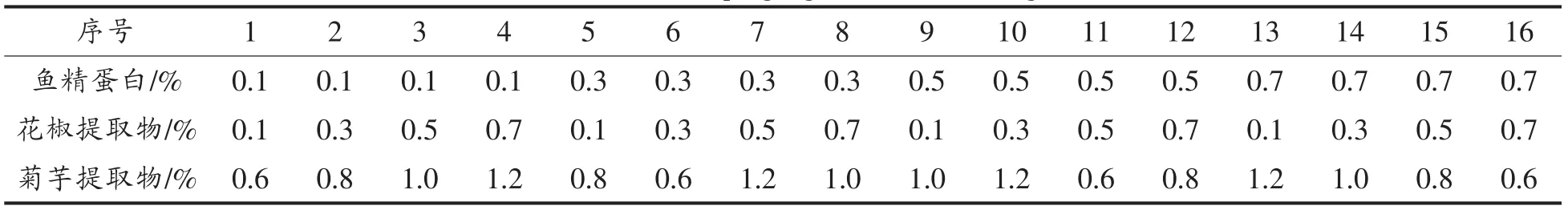
表2 黑鱼复合保鲜剂 L16(43)正交试验因素水平表Table 2 Snakehead fresh keeping agent L16(43)orthogonal test table
用选出的单一保鲜剂最佳浓度及复合保鲜剂最佳配比对黑鱼鱼片进行保鲜试验,验证其保鲜效果。
1.2.2 样品处理 鲜活黑鱼,即杀,去鳞,去内脏,去皮后取脊背肉,切成8~10 cm长的鱼片,并将鱼片分别浸泡于最佳浓度的单一及复合保鲜剂溶液中30 min,4℃±1℃温度下沥水20 min后,用无菌蒸煮袋密封包装,并立即于4℃±1℃温度下贮藏,以无菌水浸泡30 min的黑鱼片作为空白组。在贮藏过程中,每隔2 d进行指标测定。
1.2.3 细菌菌落总数 根据GB 4789.2-2010《食品安全国家标准 食品微生物学检验 菌落总数测定》[12]进行稀释平板计数法测定。
1.2.4 pH值测定 参考Arashisar等[13]的方法稍加修改。取5 g绞碎的鱼肉置于烧杯中,加入45 mL煮沸后冷却的蒸馏水,均质后过滤,取滤液用pH计测定。
1.2.5 电导率测定 取10 g绞碎的黑鱼鱼肉置于烧杯中,加入90 mL去离子水,用均质机均质后静置30 min,取上清液用电导率仪进行测定。
1.2.6 白度测定 使用CR-400色差计测定鱼肉表面 L*、a*和b*。参照Fujii[14]提出的公式计算白度。白度=100-[(100-L*)2+a*2+b*2]1/2。
1.2.7 质构测定 参照Cai[15]的方法将鱼肉切成大小为1.5 cm×1.5 cm×1.5 cm的立方体,选用P/50探头用质构分析仪在室温下测定鱼肉的硬度,咀嚼度,弹性等。测试前速率35 mm/s,测试速度为1 mm/s,恢复2 s,压缩程度50%,停留间隔时间5 s,触发力值5 g。
1.2.8 水分迁移检测 将鱼肉剪成长度约为2 cm长的长方条,置于核磁管中并设置参数:磁场强度为 0.5 T,τ值(90°~180°脉冲)110 μs,重复间隔TR 2 000 ms,接收信号光子数4 500,重复采样NS为8,回波数为10 000,质子共振频率22.6 MHz,温度32℃,弛豫时间用CPMG序列测定。
1.2.9 持水性测定 参考米洪波[16]的试验方法,将鱼肉切成5 g左右的长方体,精确称重(W1)后用两层滤纸包裹,装入50 mL离心管中,在4℃,5 000 r/min下离心10 min。离心完毕后立即对样品进行称量(W2)。并用如下公式计算:
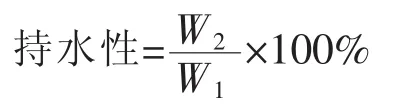
1.2.10 TVB-N测定 准确称取10 g搅碎的鱼肉置于蒸馏管中,依次加入50 mL蒸馏水和1 g氧化镁粉末,用FOSS定氮仪进行测定。
1.2.11 K值测定 采用李颖畅[17]的高效液相色谱法进行测定。色谱条件:色谱柱 BDS C18(250 mm×4.6 mm),以 0.04 mol/L KH2PO4和0.06 mol/L K2HPO4混和溶液作为流动相,进样量为20 μL,液相流速1 mL/min,柱温37℃,紫外检测器波长254 nm。
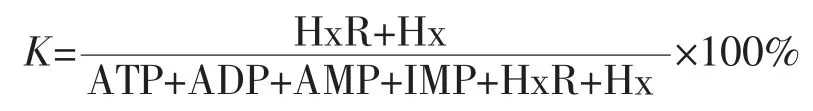
式中:HxR——次黄嘌呤核苷酸含量;Hx——次黄嘌呤含量;ATP——三磷酸腺苷含量;ADP——二磷酸腺苷含量;AMP——腺苷含量;IMP--肌苷酸含量。单位均为μmol/g。
1.3 数据分析
以上试验均设置3次平行。用EXCEL2013软件及Origin8.5软件进行数据统计及作图。用SPSS17.0进行方差分析。
2 结果与分析
2.1 单因素试验结果
OD是光密度(optical density)的缩写,表示被检测物吸收掉的光密度,可反映酶活力及菌活性[18]。OD值越小表示菌吸收的光越少,菌密度越小,即保鲜剂的抑菌性越强。表3表示单因素试验所获得的OD595结果。从表中可以看出每种保鲜剂在试验所设的5个浓度中,最终OD值均小于无菌水组的最终OD值。这表明试验所选择的保鲜剂及所设置的试验浓度能够有效抑制指示菌的生长,从而证明其具有一定的保鲜效果,试验获得的最佳抑制浓度依次为鱼精蛋白0.5%、花椒提取物0.5%、菊芋提取物1%。
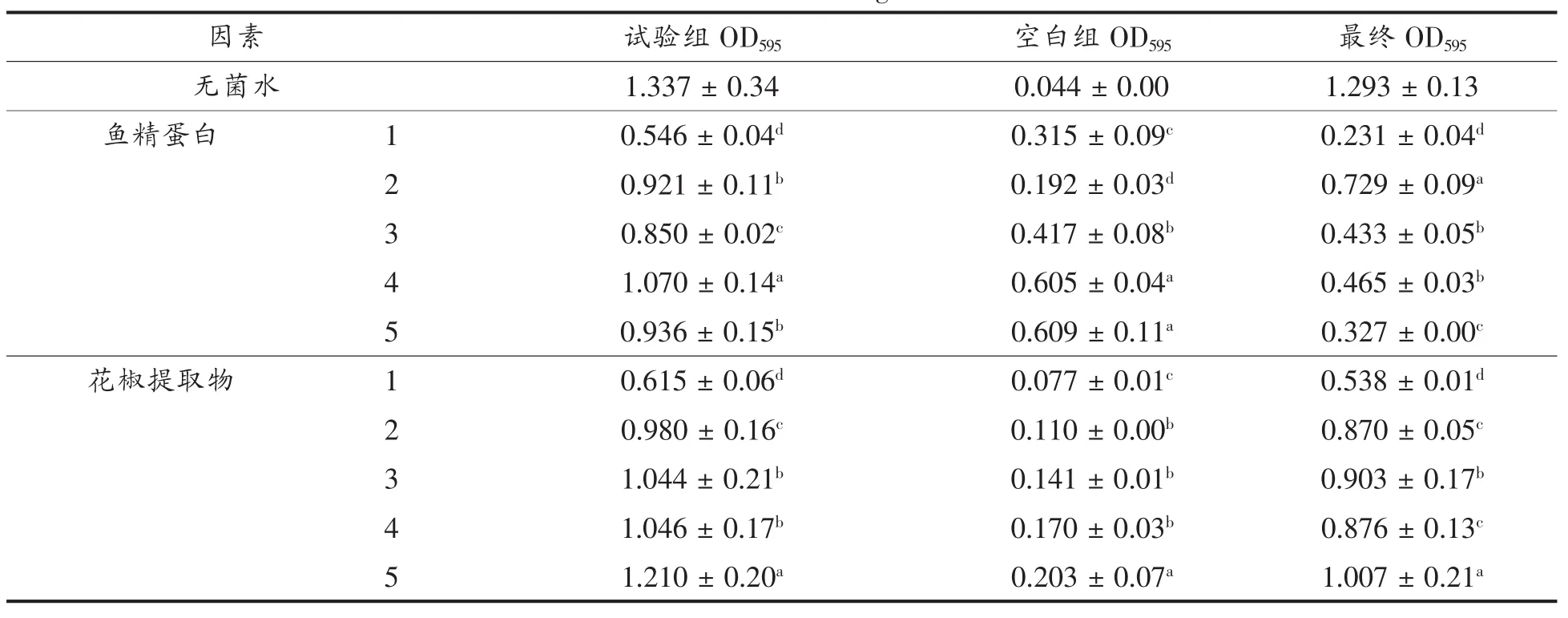
表3 单因素试验结果表Table 3 The results of single factor test

(续表3)
2.2 正交试验结果
表4为复合保鲜剂抑菌正交试验结果。根据OD595值大小可选出最佳配比。由表4可知序号6得到的最终OD595值为0.655±0.01,均小于其它试验组的最终OD595值,因此最佳保鲜剂配比为花椒提取物0.3%,鱼精蛋白0.3%及菊芋提取物0.6%。
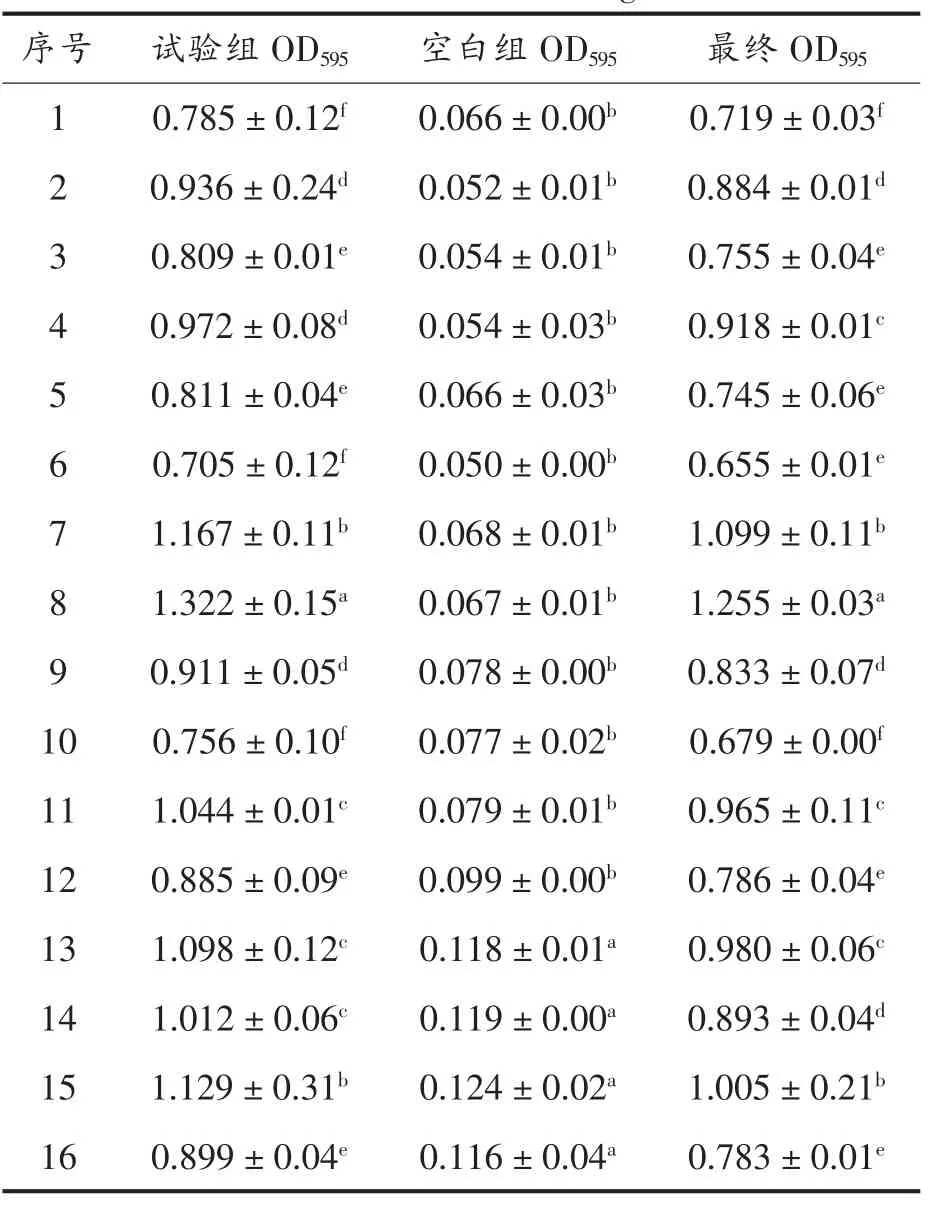
表4 正交试验结果表Table 4 The results of orthogonal test
2.3 菌落总数分析
微生物生长过程中自身代谢产物及所分泌的蛋白酶、脂肪酶会分解鱼肉中的蛋白质、脂肪,使其腐败变质,因此菌落总数可以作为指示鱼肉腐败变质程度的指标。《国际微生物规格委员会(ICMSF)食品微生物限量规定》[19]白皮中指出5.69 lgCFU/g为鱼菌落计数可接受值,7 lgCFU/g即为安全限量值。图1为贮藏过程中处理组与对照组的菌落总数值变化趋势。由图可知,0 d的菌落总数为3.18 lgCFU/g,说明样品在运输及处理过程中未受到污染,且3.18 lgCFU/g的值符合励建荣等[20]研究所得的鲜鱼菌落总数值。从图中可以看出9 d前菌落总数的增长相对较快,说明第9天为微生物生长的拐点,这是由于贮藏初期,鱼肉中的蛋白质、脂肪等营养成分含量较为丰富,能够为微生物生长提供充足的营养。但随着贮藏时间的延长,鱼肉中的营养物质被逐渐分解消耗,使微生物对其的利用率有所降低,从而限制了微生物的生长速率;此外,贮藏后期随着微生物的不断繁殖,其相互之间的竞争作用不断增强,从而使其生长速率减慢。在贮藏过程中,处理组的菌落总数始终低于空白组,且经复合保鲜剂处理的样品值最低,其中空白组在第7天时已达到规定的安全限量值。而处理组在第9天开始陆续达到安全限量值,其中复合处理组在13 d时才达到安全限量值。这说明复合保鲜剂能够有效抑制黑鱼片在贮藏过程中菌落总数的增长,从而延缓其腐败速率。
2.4 pH分析
鱼体死后会依次经历僵直、自溶以及腐败3个阶段。鱼肉pH的变化与这3个阶段及微生物生长繁殖有紧密的关系。图2为贮藏过程中,处理组与对照组的pH变化趋势图。从图中可以看出,处理组与对照组的pH总体均呈现先下降后上升的趋势,其原因主要是由于鱼死后初期,机体中的酶进行无氧呼吸使糖类和ATP降解并产生乳酸等酸性物质,导致pH持续下降。而pH的上升是由于随着储藏时间的延长,鱼体内微生物不断分解蛋白质产生胺类等碱性物质,如二甲胺、三甲胺等,且pH越高,表明鱼肉腐败程度越高[21]。由图可知,空白组在第6天时pH达到最小值6.55,并转而呈现上升趋势,而处理组则在第9天时pH才开始上升,这表明保鲜处理能够一定程度上延缓样品pH的上升。贮藏期间鱼精蛋白处理组的pH相对于空白组较高,而花椒提取物处理组的pH较低,这是由鱼精蛋白及花椒提取物水溶液自身酸碱性所决定的。鱼肉通过这两种保鲜液浸泡后pH相对于空白组呈现一定的变化,但在上升阶段空白组pH的上升速率明显高于处理组,且复合保鲜剂的增长速率最慢,这说明处理组能够降低黑鱼贮藏后期pH值的上升速率,且复合保鲜剂的保鲜效果最为明显。这与本试验中菌落总数的测定结果相同。

图1 贮藏过程中黑鱼鱼片的菌落总数变化Fig.1 Changes in total viable counts(TVC)of snakehead during cold storage

图2 贮藏过程中黑鱼pH的变化Fig.2 Changes in snakehead pH during cold storage
2.5 电导率变化分析
随着鱼肉肉片保藏时间的延长,微生物产生的酶类会不断分解鱼肉中的蛋白质、脂肪等成分,产生大量的自由离子,使其具有导电性[22]。周冬香等[23]的研究显示,电导率越大表明鱼肉分解的自由离子越多、腐败越严重。图3为贮藏过程中试验组与空白组电导率变化趋势图。从图3可看出,空白组的电导率值始终高于处理组,且经复合保鲜剂处理的试验组电导率最低。空白组第18天的电导率值为1 389,而试验组第18天的电导率值仅为1 084。这说明其鱼肉中自由离子较少,蛋白质、脂肪降解程度低,保鲜效果较优。这与李婷婷等[24]的研究结果一致。在基础保鲜剂中经花椒提取物浸泡后的黑鱼鱼片电导率相较其它较低,也具有一定的保鲜效果。
2.6 白度变化分析
鱼肉的白度是影响消费者购买欲的重要因素之一,可以直观反应鱼肉腐败变质的程度。这使其成为评价样品保鲜效果的重要参考指标。本试验所用的3种单一保鲜剂中,鱼精蛋白水溶液和花椒提取物水溶液分别呈现浅黄色和酒红色,可能会对鱼肉产生一定的影响。白度仪所显示的数值中L*代表明度,其数值由0至100,数字越大代表颜色越黑,a*代表红绿值,b*代表黄蓝值[25]。图4表示在贮藏过程中黑鱼的白度变化,从图中可以看出用菊芋提取物浸泡过的鱼肉肉片白度与空白组基本相同,无颜色变化。但其它保鲜剂浸泡黑鱼鱼片后都使其白度降低。但与空白组差异不大,肉眼难以看出,不会影响其销售。
2.7 质构变化分析
质构检测是评价鱼肉口感的重要检测手段,其结果主要受到脂肪、蛋白质含量和水分含量的影响[26]。鱼肉在贮藏期间,腐败微生物代谢会产生脂肪酶及蛋白酶。这些酶类会分解鱼肉中的脂肪和蛋白质,使鱼肉的肌原纤维、肉质等发生改变,即体现为硬度、弹性、粘聚性、咀嚼性和回复性的变化。表3为黑鱼鱼片在贮藏期间质构的变化表。从表3中可以看出,随着贮藏时间的延长,样品的硬度、咀嚼性和回复性均总体呈现降低趋势,这主要是由于蛋白酶和脂肪酶将鱼肉中的蛋白及脂肪分解,使其结构遭到破坏。粘聚性则先下降后上升,而弹性处于波动状态无明显趋势。处理组的粘聚性与弹性始终优于空白组。空白组第0天时的硬度、回复性值高于处理组。可能是由于浸泡过程中保鲜剂中的成分进入鱼肉内部,与鱼肉发生化学反应致使其结构改变,具体原因需进一步试验探究。综上所述保鲜剂可以有效延缓酶类作用,保护肉质不受破坏,且效果最佳的是复合保鲜剂。试验中硬度、咀嚼度等指标的结果与郑瑞生[27]的试验结果一致。

图3 贮藏过程中黑鱼的电导率变化Fig.3 Changes in snakehead conductivity during cold storage

图4 贮藏过程中黑鱼的白度变化Fig.4 Changes in snakehead whiteness during cold storage
2.8 水分迁移分析
低场核磁共振(Low-field nuclear magnetic resonance,LF-NMR)可有效检测食品中的水分变化[28]。鱼肉中各水分的组成比例能够对其外观及品质造成很大的影响,鱼肉贮藏过程中水分迁移过程的实质是,结合水与不易流动水向自由水的转移。表4表示贮藏过程中黑鱼的水分变化,从表中可以看出所有试验组结合水的数据处于波动中但最终小于第0天的值,不易流动水随着贮藏时间的延长逐渐减少。而自由水随着贮藏时间的延长逐渐增多。这是由于贮藏期间黑鱼肌肉内发生无氧反应,导致通透性增加破坏了组织结构使其对水分的束缚力降低[29],水分逐步向外部迁移,自由水增多。自由水的增加量由大到小依次为空白组11.5、菊芋提取物组 9.31、鱼精蛋白组8.11、花椒提取物组6.94、复合保鲜剂组6.6,通过以上数据可知保鲜剂能够通过抑制微生物的活动增强其对水的束缚能力[30]。复合保鲜剂相较于单一保鲜剂可有效地减少水分的迁移,减缓腐败,其效果优于空白组、其它处理组。
2.9 持水性分析
持水性是指在加工及贮藏过程中,鱼肉对其自身水分的保持能力,其主要与鱼肉中不易流动水、蛋白质凝胶及所带静电荷数量密切相关。持水性越高,表明鱼肉的网络结构对水分等物质的束缚能力越强,即表示凝胶的空间网络结构越致密[31]。图5表示经不同保鲜剂处理的鱼肉在贮藏期间持水性的变化。从图中可以看出,随着贮藏时间的延长,空白组与试验组的持水性均呈现下降趋势,且空白组始终低于试验组。这是由于鱼肉开始腐败后,微生物代谢能够产生大量蛋白酶,其可以分解蛋白质并破坏蛋白质凝胶结构,从而导致鱼肉持水性降低。黑鱼的持水性初始值为90.01%±0.01%,贮藏18 d后空白组持水性的下降率最高,达到24%,而花椒提取物处理组、菊芋提取物处理组、鱼精蛋白处理组及复合保鲜剂处理组的下降率相对较低,依次为18%,22%,20%,16%。这表明,保鲜剂处理能够通过抑制微生物生长及其蛋白酶代谢物的产生,从而保护鱼肉蛋白质的凝胶结构,进而延缓其持水性的下降速率,且复合处理组的效果最为明显,这与本试验菌落总数及低场核磁试验结果相同。
2.10 TVB-N值分析
由于酶类和细菌的作用,贮藏期内动物性食品的蛋白质会逐渐发生分解并产生氨以及胺类等碱性物质,其总量称为TVB-N[32]。TVB-N值的大小可以有效反应出鱼肉的腐败程度,且值越大代表腐败程度越高。各组样品在贮藏过程中TVB-N值的变化如图6所示。由图可知,贮藏初期黑鱼的TVB-N值为10.97 mg/100 g,随着贮藏时间的延长,各组样品TVB-N值均呈现上升趋势,其中空白组的上升幅度最大,这与吕飞[33]的试验结果相同。从图中可以看出空白组在第9天时TVB-N为24.76 mg/100 g。已超出GB2733-2015[34]要求的淡水鱼虾TVB-N临界值(20 mg/100 g),而复合保鲜剂组则在第15天时才超出临界值。这表明复合保鲜剂可有效减少微生物的生长,从而减少蛋白酶分泌,降低蛋白质分解,进而降低样品贮藏过程中TVB-N值的上升速率。
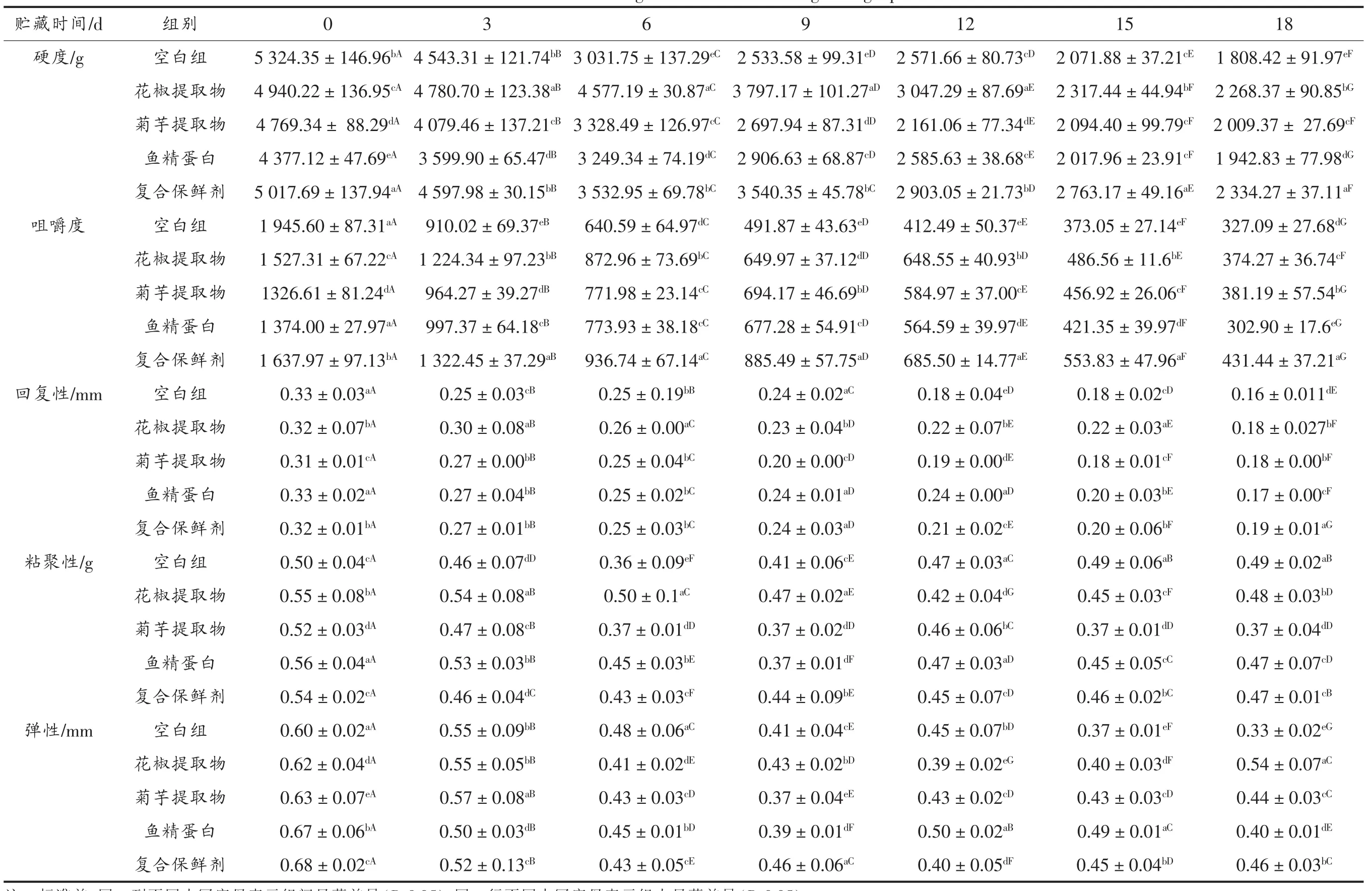
表5 贮藏过程中黑鱼质构变化表Table5 The texture change of snakehead during storage process

表6 贮藏过程中黑鱼的水分变化Table 6 The moisture change of snakehead during storage

图5 贮藏过程中黑鱼的持水性变化Fig.5 Changes in snakehead water holding capacity during cold storage
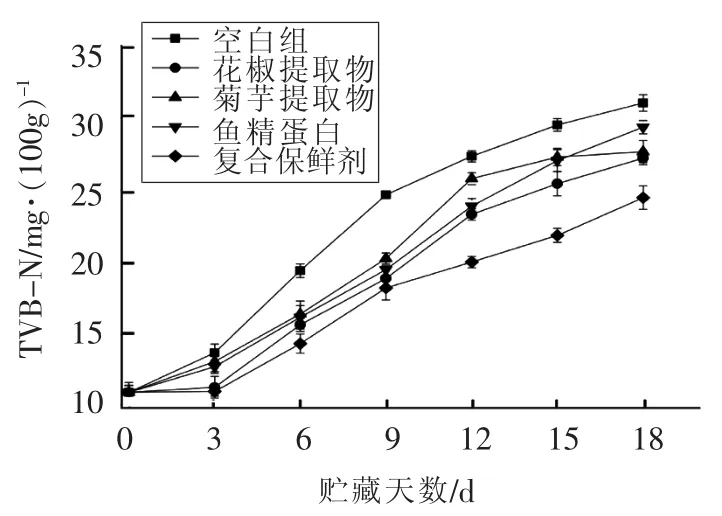
图6 贮藏过程中黑鱼片的TVB-N变化Fig.6 Changes in TVB-N of snakehead during cold storage
2.11 K值分析
鱼类死亡后,体内的ATP逐渐降解为ADP、AMP、IMP、HxR和Hx。K值能够有效地表征其降解程度,因此经常作为评价鱼体新鲜度的重要指标。一般认为即杀鱼的K值小于10%为一级鲜度,在20%~40%之间为二级鲜度,若高于60%则已开始腐败,不可接受[35]。如图7所示,黑鱼鱼片的初始K值为7.94%,处于一级鲜度。随着贮藏时间的延长,各组样品的K值均呈现上升趋势,这是由于微生物的生长代谢加速了ATP的降解,从而使K值迅速增高。空白组在第7天时便开始腐败,不可加工食用。单一保鲜剂处理组在贮藏达到第11天时K值已接近60%,趋于腐败。而复合保鲜剂处理组的黑鱼鱼片在第15天时,K值才达到64.44%。由此可知复合保鲜剂可明显抑制样品ATP的降解,延缓K值的增长。试验结果与李颖畅等[17]的研究结果一致。

图7 贮藏过程中黑鱼的K值变化Fig.7 Changes in K value of snakehead during cold storage
3 结论
通过对黑鱼鱼片样品菌落总数、pH、电导率、TVB-N、K值、质构、白度、持水性及水分分布等指标进行分析,比较各组保鲜剂对(4±1)℃冷藏条件下黑鱼鱼片的保鲜效果。试验结果表明,处理组的菌落总数、TVB-N、pH值、质构、K值、电导率及持水性均优于空白组,且复合处理组(花椒提取物0.3%,鱼精蛋白0.3%及菊芋提取物0.6%)的效果最为明显。经鱼精蛋白、花椒提取物和复合保鲜剂处理的鱼片白度低于空白组,但是颜色变化不显著(P>0.05)。以上结果表明复合保鲜处理可有效抑制鱼肉贮藏过程中微生物的生长繁殖,减缓ATP和蛋白质的降解,从而显著延长其保鲜期,并通过协同作用达到更好的保鲜效果。因此,该复合生物保鲜剂在黑鱼鱼片保鲜中拥有广阔市场前景。
