一株产α-葡萄糖苷酶抑制剂的牛类芽孢杆菌BD3526
2019-10-11吴正钧刘振民
韩 瑨,吴正钧,刘振民,赵 勇
1上海海洋大学食品学院,上海 201306;2上海乳业生物工程技术研究中心,乳业生物技术国家重点实验室,光明乳业股份有限公司乳业研究院,上海 200436
糖尿病(diabetes mellitus)是一类由胰岛素分泌不足或外周组织对胰岛素不敏感引发的,以高血糖为特征性指标的慢性代谢紊乱疾病,其患者长期处于高血糖、高尿糖状态,若不及时介入控制血糖水平,可导致各种组织、脏器(如眼、肾等)功能障碍甚至衰竭,严重时可致残甚至危及患者生命,因此,糖尿病又被称为“万病之源”。
Ⅱ型糖尿病,又称为非胰岛素依赖型糖尿病(non-insulin-dependent diabetes mellitus,NIDDM),是临床上较多见的糖尿病类型(占糖尿病患者总量的85%以上),目前治疗NIDDM药物主要有磺脲类药物、双胍类药物、格列奈类药物、噻唑烷二酮类药物、DPP-Ⅳ抑制剂以及α-葡萄糖苷酶抑制剂(α-glucosidase inhibitor,α-GI),其中α-GI以其效果温和、副作用小等特点受到患者的青睐[1]。据统计,除米格列醇(Miglitol)有芽孢杆菌来源[2]外,大部分临床上使用的α-GI,如阿卡波糖(Acarbose)[3]、伏格列波糖(Voglibose)[4],均来自真菌类微生物(放线菌),由此可见,有关细菌类微生物发酵产α-GI的开发利用仍然处于较低水平。
本文以体外模型为检测手段,从西藏生牦牛乳中筛选得到一株可发酵脱脂乳、产α-GI的菌株,并将其与常规乳酸菌进行降糖活性比较,同时考察了产α-GI的最适条件(好氧/厌氧,30/37 ℃)与遗传稳定性,最后对该菌株在脱脂乳中发酵及其产α-GI特性进行了初步研究,旨在填补类芽孢杆菌产α-GI相关领域的相对空白。
1 材料与方法
1.1 材料与仪器
用于筛选菌株的生牦牛乳取样自中国西藏当雄地区。
PaenibacillusbovisBD3526、LeuconostocmesenteroidesBD1710、LeuconostoccitreumBD1707、LactobacillushelveticusBD3809(由光明乳业股份有限公司提供)、LactobacilluscaseiATCC 334、LactobacillusrhamnosusGG ATCC 53103(购买自ATCC)、LactobacillusacidophilusNCFM、LactobacillusbulgaricusLB340、BifidobacteriumanimalisBL-04(由丹尼斯克公司提供)、StreptococcusthermophilusST-BODY-3(由科汉森公司提供)。
M17琼脂培养基、M17液体培养基、乳糖(OXOID LTD.,英国)、脱脂乳粉(光明乳业股份有限公司,中国)、NaOH、Na2CO3、乳酸 (国药集团化学试剂有限公司,上海)、α-葡萄糖苷酶(E.C 3.2.1.20)、pNPG(4-硝基酚-α-D-吡喃葡萄糖苷)(Sigma公司,美国)、MRS培养基(merck公司,德国)、TPY培养基(海博生物科技有限公司,中国)。
HVE-50型高压灭菌锅 日本HIRAYAMA公司;SG-402TX型超净工作台 美国THE BAKER COMPANY公司;AVANTI J30I型高速冷冻离心机 美国BECKMAN COULTER公司;HZQ-F160型摇床 苏州培英实验设备有限公司;GNP-9270型隔水式恒温培养箱 上海精宏实验设备有限公司;PHS-25型pH计 美国奥立龙公司;XW-80A型漩涡混合仪 上海青浦沪西仪器厂;Spectra Max M5多功能酶标仪 美国Molecular Devices公司。
1.2 培养基的制备
分离培养基:取M17琼脂培养基4.8 g溶解于100 mL蒸馏水中,118 ℃灭菌15 min,冷却备用。
种子培养基:取M17液体培养基3.7 g,乳糖1 g溶解于100 mL蒸馏水中,118 ℃灭菌15 min,冷却备用。
发酵培养基:取脱脂乳粉10 g溶解于90 mL蒸馏水中,118 ℃灭菌15 min,冷却备用。
1.3 实验方法
1.3.1 菌株的分离与纯化
菌株的分离与纯化:采用逐级稀释法将西藏生牦牛乳稀释至原浓度的10-4,分别取原液以及各级稀释液0.1 mL均匀涂布于分离培养基上,于37 ℃厌氧培养2天后,观察并用接种环挑出菌落形态(形状、大小、颜色等)有显著差异的菌株,再次划线于分离培养基上,置于37 ℃厌氧培养2天进行纯化。
1.3.2 发酵种子的制备
从平板上挑取一环已纯化菌株接种于10 mL种子培养基中,于37 ℃静置培养12 h后,10 000 rpm离心15 min,取沉淀(菌饼),以相同体积的无菌蒸馏水反复洗涤三次后重悬,即得发酵用的种子。
1.3.3α-葡萄糖苷酶抑制活性及IC50的测定
α-葡萄糖苷酶抑制活性的测定:在体外测定模型PNPG法[5]的基础上加以改良,简言之: 100 μL待测样品与50 μLα-葡萄糖苷酶(100 mU/mL)混匀,37 ℃水浴15 min,加入80 μL pNPG(2 mmol/L)混匀,再次37 ℃水浴15 min,最后加入80 μL Na2CO3(0.2 mol/L)终止反应。该反应体系于4 ℃、10 000 rpm离心2 min后,取200 μL上清于96孔微孔板中,利用酶标仪测定OD405。
为了规避脱脂乳/发酵乳对反应体系产生的影响,本研究采用脱脂乳上清作为阴性对照,具体制备方法如下:脱脂乳(10%,w/v)以乳酸调节至待测样品相同pH,10 000 rpm离心2 min,取上清,1 mol/L NaOH回调pH至6.80,10 000 rpm离心2 min后取上清,即得阴性对照。取三次平行实验的平均OD405值,代入以下公式计算α-葡萄糖苷酶抑制活性:
α-葡萄糖苷酶抑制率=
式中:阴性对照组为脱脂乳上清。
阴性空白组为PBS替代阴性对照组中的α-葡萄糖苷酶。
样品空白组为PBS替代待测样品组中的α-葡萄糖苷酶。
IC50的测定:将冻干粉末溶解于PBS(0.1 mol/L,pH6.8)的缓冲液中,制得浓度为80、40、20、10、5 mg/mL的待测样品组,测定各样品对α-葡萄糖苷酶的抑制活性。以样品浓度为橫坐标,抑制率为纵坐标作图,通过回归方程拟合并计算可得抑制α-葡萄糖苷酶半数活性所需的样品浓度,即IC50。
1.3.4 降糖菌株的初筛与复筛
初筛:分别挑取一环已纯化的菌株于10 mL发酵培养基中,经涡旋震荡后将菌体均匀分布于发酵体系中,37 ℃静置培养24 h得发酵乳。将发酵乳置于沸水浴中加热5 min灭活菌体,10 000 rpm离心15 min,取上清,以1 mol/L NaOH调节pH至6.8,再次10 000 rpm离心15 min,取上清,检测其α-葡萄糖苷酶抑制活性(n=3)。
复筛:将发酵种子以2%(v/v)接种量接种于发酵培养基中,37 ℃静置培养24 h得发酵乳。参照初筛的方法由发酵乳制备获得上清,检测其α-葡萄糖苷酶抑制活性(n=3)。
1.3.5 不同乳酸菌制备的发酵乳对α-葡萄糖苷酶的抑制作用
取不同菌株的冻干粉少量,分别划线于对应的培养基上(BD1710、BD1707、BD3809、ATCC334、NCFM、LB340、LGG/MRS培养基,BD3526、ST-BODY-3/M17培养基,BL-04/TPY培养基),37 ℃厌氧培养2天形成菌落,随后参照1.3.4初筛所述方法,测定不同乳酸菌制备的发酵乳对α-葡萄糖苷酶的抑制作用。
1.3.6 菌株的鉴定
将菌株送至中国普通微生物菌种保藏管理中心(CGMCC)进行生理生化与16S rDNA等菌株分型的相关测定。
1.3.7 发酵条件对BD3526产α-GI的影响
参照1.3.4初筛所述方法,在接种后,置于30 ℃和37 ℃条件下分别进行厌氧(静置)和好氧(180 rpm摇床振荡)培养24 h得发酵乳,进而检测并比较两者的α-葡萄糖苷酶抑制活性。
1.3.8 传代稳定性实验
将复筛获得的菌株以每周一次频率的传代25次,参照1.3.4初筛所述方法,以原代菌株为对照,检测第5、10、15、20和25代菌株所制备的发酵乳的α-葡萄糖苷酶抑制活性。
1.3.9 BD3526在脱脂乳中的发酵特性
将发酵种子以2%(v/v)接种量接种于发酵培养基中,30 ℃、180 rpm摇床振荡培养,于0、3、6、9、12、24、36 h取样,观察发酵过程中脱脂乳的颜色变化,并测定不同菌株发酵上清的pH、活菌数、糖苷酶抑制率及其冻干粉的半数抑制浓度(IC50)。
1.3.10 数据统计分析
运用Excel 2013和Origin Pro 2016进行数据汇总、分析和作图。
2 结果与分析
2.1 降糖菌株的初筛与复筛
利用逐级稀释与涂布相结合的方法,在M17平板上共分离纯化获得38株菌株,将上述菌株分别接种于发酵培养基中37 ℃静置培养24 h后发现,仅16株菌可代谢脱脂乳引起凝乳,进一步对这些菌株的发酵乳进行糖苷酶抑制活性的测定,部分筛选结果如图1所示。
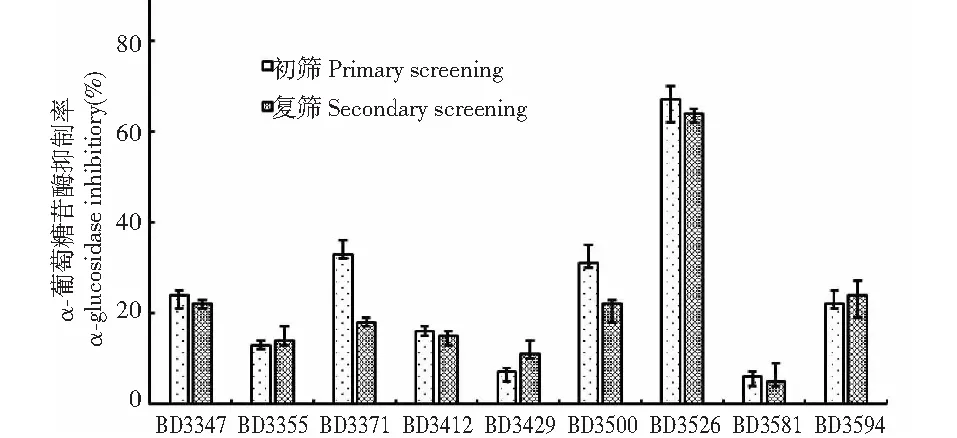
图1 部分降糖菌株的初筛和复筛结果Fig.1 Partial results of primary and secondary screening for anti-diabetic strains
初筛和复筛结果显示,大部分受试菌株的发酵乳上清对α-葡萄糖苷酶的抑制率较低(<40%),而BD3526的抑制效果稳定维持在60%(初筛67%、复筛64%)以上,显著高于其他菌株,因此,BD3526被选择作为潜在的降血菌株来进一步研究。
2.2 BD3526与其他乳酸菌的比较
为了比较BD3526与其他酸奶发酵剂所制备的发酵乳对α-葡萄糖苷酶的抑制活性,研究人员将BD3526及多种常规乳酸菌(如ST-BODY-3、LB340等)分别接种于发酵培养基中,37 ℃静置培养24 h,所得发酵乳对α-葡萄糖苷酶的抑制率如下图所示。
来自不同菌株的发酵乳对α-葡萄糖苷酶的抑制率差异较大,其中大部分常规乳酸菌的糖苷酶抑制活力较低(<20%),具体地,保加利亚乳杆菌LB340、双歧杆菌BL-04、嗜热链球菌ST-BODY-3、嗜酸乳杆菌NCFM、肠膜明串珠菌BD1710、柠檬明串珠菌BD1707以及瑞士乳杆菌BD3809的抑制率分别为13%、2%、11%、5%、6%、10%和14%,仅有少数几株菌具有一定的体外糖苷酶抑制活性,其中干酪乳杆菌ATCC334与鼠李糖乳杆菌LGG发酵乳的抑制活力较强,为22%和25%,而BD3525发酵乳的抑制效果最为佳,高达66%,显著优于其他受试乳酸菌。
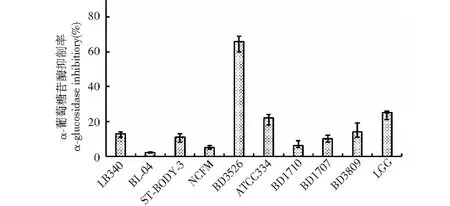
图2 不同乳酸菌对α-葡萄糖苷酶的抑制效果Fig.2 Inhibitory effects of different lactic acid bacteria on α-glucosidase
BD3526生理生化、16S rDNA等分类数据及命名的依据,此前已有公开,结果显示,BD3526为一株类芽孢杆菌新种,命名为Paenibacillusbovis(牛类芽孢杆菌),并且该菌株成为该种的模式菌株[6]。相较于其他产α-GI微生物(干酪乳杆菌与鼠李糖乳杆菌[7])而言,有关类芽孢杆菌,尤其是牛类芽孢杆菌发酵脱脂乳、产α-GI的研究还未曾有过披露,因此,此类研究值得进一步深入开展。
2.3 产α-葡萄糖苷酶抑制剂特性
2.3.1 发酵条件对BD3526产α-GI的影响
不同温度(30 ℃、37 ℃)与通氧(好氧、厌氧)组合条件下获得的BD3526发酵乳对α-葡萄糖苷酶的抑制率及IC50如图3所示。比较后发现,相同通氧条件下,30 ℃发酵乳的抑制活性高于37 ℃发酵乳,并且前者的IC50值低于后者,而在相同温度下,来自摇床培养的发酵乳的抑酶活性显著优于静置培养。由此可见,中温、好氧是BD3526代谢脱脂乳产α-GI的优选条件,该条件与类芽孢杆菌家族菌株(如多粘类芽孢杆菌等)的最适生长条件一致[8],因此,根据糖苷酶抑制效果与菌体生长的正相关性推测,该抑制剂有可能是BD3526菌体生长过程中的代谢产物之一。
2.3.2 传代稳定性
某些微生物(如链霉菌[9]、乳酸菌[10]等)在传代过程中存在着遗传不稳定性现象,而这种现象往往会对微生物的诸多表型产生负面影响,尤其是那些具有潜在商业价值的菌株在发生退化后特定功能性物质的产量显得极不稳定,进而给科学研究和商业化应用带来很大烦恼。因此,本研究以原代作为对照,对第5、10、15、20和25代BD3526菌株发酵乳的糖苷酶抑制效果进行测定,旨在考察BD3526在α-GI产量方面的遗传稳定性,结果如图4所示。
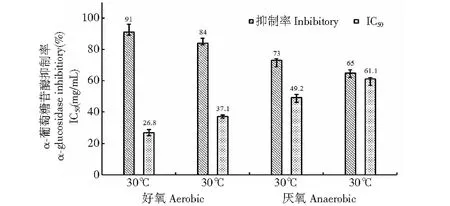
图3 发酵条件对BD3526产α-GI的影响Fig.3 Effect of fermentation conditions on α-GI by BD3526
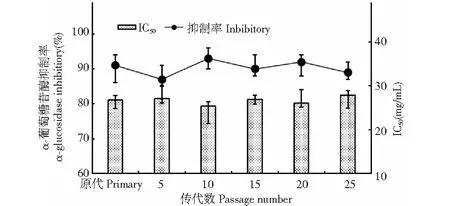
图4 BD3526产α-GI的遗传稳定性Fig.4 Genetic stability of BD3526 for α-GI production
不同传代次数所得的BD3526发酵乳的α-葡萄糖苷酶抑制效果基本维持不变,无论抑制率(87%~93%)还是IC50(25.4~27.1 mg/mL),均与原代株(91%,26.8 mg/mL)保持在同一水平范围。由此可见,BD3526连续传代25次后在产α-GI方面的遗传性状稳定有效。
2.4 BD3526在SKM中的发酵特性
在发酵初期(0~6 h),BD3526发酵乳呈典型的乳白色,随着培养时间的延长,发酵体系颜色逐渐加深,最终变成棕色。前期相关报道指出,BD3526可产生一种高凝乳活性的金属蛋白酶[11-14],上述变色现象的产生很可能是该蛋白酶水解乳蛋白后释放出的大量肽和氨基酸,与发酵体系中原有的乳糖等还原性糖,发生了美拉德反应[15](又称“非酶棕色化反应”)所造成的。因此,发酵体系的颜色与乳蛋白的水解程度呈正相关性,颜色越深,则水解程度越高,反之亦然。
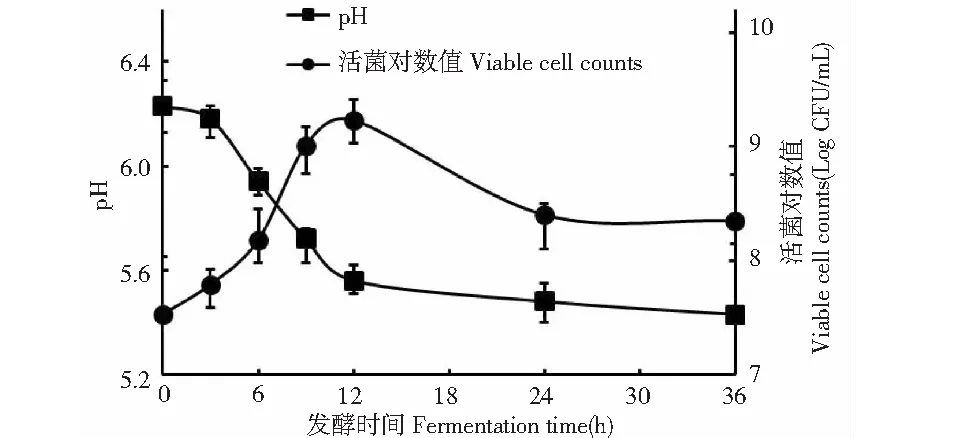
图5 BD3526在脱脂乳中生长时的pH和活菌数变化Fig.5 Variation of pH and viable counts of BD3526 grown in SKM
BD3526在脱脂乳中的活菌数与pH变化如图5所示,在发酵前期,BD3526在脱脂乳中的生长趋势与保加利亚乳杆菌等乳酸菌类似,呈典型的“S”型生长曲线,尤其在6~9 h时,菌体由于生境营养充足且活力旺盛的关系,导致增殖速率最快(活菌对数值8.18→9.01),直至12 h时达到活菌数峰值1.75×109CFU/mL,随着发酵时间的延长,活菌总数开始缓慢下滑至2.5×108CFU/mL(24 h),并一直保持至发酵终点(36 h),这是前期的高速代谢作用透支了发酵体系中的营养物质,并积累了某些不利于菌体生长的代谢产物的必然结果。
在pH变化方面,BD3526发酵体系的pH快速降低现象(pH6.23→5.56)主要出现在发酵前12 h,继续延长发酵时间至36 h并未发现有机酸的大量产生与进一步积累,其发酵终点pH为5.43。该现象的产生与常规乳酸菌完全不同,后者的发酵乳终点pH较低(5.0以下)主要得益于乳酸的大量积累,而BD3526发酵乳pH较高,除了少量乳酸的贡献外,菌株自身分泌的多种乳蛋白水解酶将酪蛋白水解成偏酸性的肽和氨基酸也可能是影响pH的重要因素之一。
图6 为发酵过程中BD3526发酵乳的糖苷酶抑制率和IC50变化。受到发酵前期活菌总量较低而引起代谢作用不足的影响,3 h发酵乳中抑制剂含量较低,其糖苷酶的抑制效果仅为8%(其IC50不可测),延长发酵时间后发现,各取样点发酵乳(6、9、12、24、36 h)的糖苷酶抑制活性显著提高,分别为83%、91%、93%、92%、91%,各样品组的测定值处于高水平且无明显差异。但进一步分析显示各样品组的IC50差别巨大,伴随发酵程度的加深,发酵乳IC50不断递减,具体为: 45 mg/mL(6 h)、40.4 mg/mL(9 h)、35 mg/mL(12 h)、26.8 mg/mL(24 h)和22.4 mg/mL(36 h),意味着体系中α-GI正逐步积累,这可能是发酵体系中BD3526菌体总量大、菌株活性高,转化效率强、积累速率快等多种作用的综合结果。
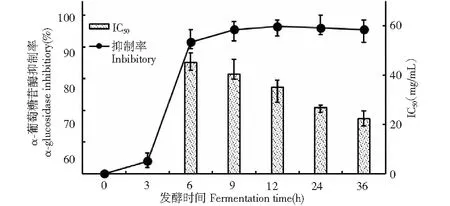
图6 BD3526在脱脂乳中生长时的糖苷酶抑制率和IC50变化Fig.6 Variation of α-glucosidase inhibitory and IC50 of BD3526 grown in SKM
3 结论
有关α-GI的研究最早可追溯至上世纪中期,据统计,已报道的降糖微生物中真菌类微生物占70%以上,如放线菌[16]、霉菌[17]等因研究起步早而分离线路成熟,活性物质明确,作用机制清晰。相比之下,细菌类微生物的相关研究尚处于的起步阶段(菌株筛选[7]、技术路线的摸索[18]等)。类芽孢杆菌属(Paenibacillus)细菌曾归于芽孢杆菌属(Bacillus)内,于1993年由Ash等利用PCR探针技术才将其独立为新属[19],并确立多粘类芽孢杆菌(Paenibacilluspolymyxa)为其模式菌株,此类菌株兼性厌氧,嗜中温、中性pH生长,具有抗菌、固氮、土壤磷增溶、促微生物生长[20]等多种生物活性,然而,有关类芽孢杆菌发酵脱脂乳产α-GI的研究几乎没有,该领域的空白现状为本研究提供了契机。
本文以体外模型为检测手段,对西藏生牦牛乳来源的菌株进行初筛和复筛后发现,一株类芽孢杆菌新种PaenibacillusbovisBD3526具有代谢脱脂乳、产α-GI的能力,该菌株发酵乳的糖苷酶抑制活性(>60%)显著高于其他牦牛乳分离菌株和常规乳酸菌,中温、好氧发酵有利于该菌株更好地合成与积累活性物质,30 ℃、180 rpm摇床振荡培养24 h的发酵乳对α-葡萄糖苷酶的抑制率可达91%,IC50为26.8 mg/mL。传代25次的BD3526的降糖效果与原代保持在同一水平,表明菌株产α-GI的遗传性状稳定有效。当BD3526在脱脂乳中发酵时,发酵乳的颜色因受到美拉德反应的影响而由浅及深,12 h发酵乳中活菌总数达到峰值1.75×109CFU/mL,发酵终点pH为5.43,产酸能力显著低于乳酸菌,6 h后的发酵乳的糖苷酶抑制活性均处于高水平(80%以上),但不断递减的IC50表明,α-GI伴随发酵程度的加深,依然在进一步积累,因此,后期有必要对BD3526在发酵条件进行全面优化,从而为后期的分离、纯化工作打下基础。
