橙盖鹅膏多糖(AC-1)体外免疫调节活性、细胞毒性和抗肿瘤活性的研究
2019-10-11侯怡铃宋志强
朱 淼,侯怡铃,唐 贤,宋志强,丁 祥
1西华师范大学生命科学学院;2西华师范大学环境科学与工程学院,南充 637009
真菌多糖为天然的高分子化合物,对细胞的分裂分化及生长衰老具有重要作用[1],因其所具有的生物活性及药理价值而成为当今研究的热点[2]。鹅膏菌属(Amanita)是大型真菌中一个种类繁多、分布广泛的种属,其多糖备受关注并已有广泛的研究。Ruthes等[3]发现,毒蝇鹅膏多糖具有抗炎镇痛的作用;Karaman等[4]研究发现,松果鹅膏多糖具有镇痛作用,并能较好地清除OH-;Tang等[5]发现,黄盖鹅膏多糖和豹斑毒鹅膏多糖能够抑制人胃癌细胞(MGC)的生长;祝雪娇等[6]发现,红黄鹅膏多糖具有抗肿瘤活性,能够抑制小鼠黑色素瘤细胞(B16)的生长。以上研究均是对鹅膏菌属中所含粗多糖的报道,但对其所含多糖的精细结构并未表征,因此相关活性及其分子机制研究存在一定的不确定性。
橙盖鹅膏(Amanitacaesarea)是鹅膏菌属(Amanita)的一种食用真菌,菌盖为橙色,也被称为“鸡蛋菌”。在我们前期的研究中,从采摘于四川的橙盖鹅膏子实体中提取了一种结构新颖的多糖(AC-1)(图1),重均分子量Mw为19 329 Da。其精细结构特征是以α-(1→4)-D-葡萄糖和α-(1→3)-D-葡萄糖为骨架,α-(1→3)-D-葡萄糖6-C上连接一个→1)-α-D-来苏糖的侧链,α-D-葡萄糖和α-D-来苏糖的比例为2∶1[7]。然而,关于该橙盖鹅膏多糖的免疫调节和抗肿瘤活性的研究目前未见报道。本实验以橙盖鹅膏多糖(AC-1)为研究对象,探究其对三种免疫细胞(T细胞、B细胞和RAW264.7)、小鼠成纤维细胞(L929)、小鼠胃癌细胞(MFC)和小鼠肉瘤细胞(S180)的影响。希望通过研究能够进一步明确橙盖鹅膏多糖的体外免疫调节、细胞毒性和抗肿瘤活性,为开发利用橙盖鹅膏多糖资源提供一定的参考依据。
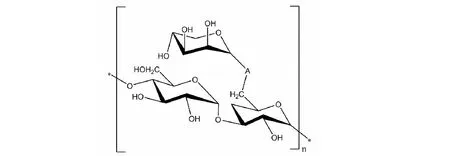
图1 橙盖鹅膏多糖(AC-1)的结构Fig.1 The structure of Amanita caesarea polysaccharide (AC-1)
1 材料与方法
1.1 实验材料
橙盖鹅膏菌(Amanitacaesarea)采自于四川省甘孜州,橙盖鹅膏多糖(AC-1)参考文献[7]的方法制备。T细胞、B细胞、小鼠腹腔巨噬细胞(RAW264.7)、小鼠成纤维细胞(L929)、小鼠胃癌细胞(MFC)和小鼠肉瘤细胞(S180)由中科院上海生命科学研究院生化与细胞所提供。
1.2 主要试剂和实验仪器
PRMI 1640培养基、双抗、胰蛋白酶(Gibco)、脂多糖(LPS)购于Sigma公司;Cell Counting Kit-8(CCK-8试剂)购于美国ZETA LIFE公司;中性红试剂购于生工生物工程(上海)股份有限公司;甘露聚糖肽(Mannatide)购于成都利尔药业有限公司;ELISA检测试剂盒购于R&D公司;无水乙醇购于河南天冠集团,乙酸购于江苏索普公司;3111型CO2细胞培养箱(Thermo scientific);Multiskan Go型酶标仪(Thermo scientific)。
1.3 实验方法
1.3.1 橙盖鹅膏多糖(AC-1)对三种免疫细胞(T细胞、B细胞和巨噬细胞RAW264.7)增殖的影响
将细胞用培养液稀释至1×105/mL,然后以每孔100 μL加入96孔板。实验设置空白对照组,AC-1药物组(设置1.25、2.5、5、10 μg/mL 共4个终浓度梯度),LPS阳性对照组(终浓度为5 μg/mL),每个浓度6个重复。参照文献[8]的方法检测AC-1对三种免疫细胞的增殖效应并记录实验结果。
增殖率(%)=[OD值(实验组)-OD值(空白
对照组)]/OD值(空白对照组)×100%
注:实验组为AC-1药物组和LPS阳性对照组。
1.3.2 橙盖鹅膏多糖(AC-1)对B细胞分泌抗体的影响
本实验用ELISA试剂盒检测AC-1刺激B细胞分泌的抗体Ig A、Ig M、Ig G和Ig E[9]。实验设置空白对照组,AC-1药物组(2.5、5、10 μg/mL)和LPS阳性对照组(5 μg/mL),按照试剂盒说明书操作。用酶标仪在450 nm波长处测定各孔吸光度值(OD值),记录实验结果。
1.3.3 橙盖鹅膏多糖(AC-1)对巨噬细胞RAW264.7细胞吞噬能力的影响
取巨噬细胞RAW264.7用培养液稀释至5×105/mL[10],然后以每孔100 μL的剂量加入96孔板中,37 ℃、5%的CO2培养箱中培养24 h后,依次加入100 μL细胞培养液(空白对照)、终浓度为1.25、2.5、5、10 μg/mL的橙盖鹅膏多糖(AC-1)溶液(AC-1药物组)、终浓度为5 μg/mL的LPS溶液(阳性对照组),每组6个重复,继续培养24 h后,吸出上清,每孔中加入100 μL的0.075%的中性红试剂,在培养箱中孵育15 min。15 min后,用PBS洗三次,然后每孔分别加入100 μL细胞裂解液(由无水乙醇和乙酸按1∶1的体积比配制而成),培养箱中裂解2 h,利用酶标仪在540 nm波长下测OD值,并记录实验结果。
1.3.4 橙盖鹅膏多糖(AC-1)对小鼠成纤维细胞(L929)的细胞毒性实验
实验参照1.3.1中AC-1对三种免疫细胞增殖影响的方法检测AC-1对小鼠成纤维细胞(L929)的细胞毒性实验,AC-1药物组设置5、10、15、20 μg/mL共4个终浓度梯度,其余步骤同1.3.1。
1.3.5 橙盖鹅膏多糖(AC-1)对小鼠胃癌细胞(MFC)和小鼠肉瘤细胞(S180)的体外抑制
将配好的细胞悬液以每孔100 μL的剂量加入96孔板中培养24 h后,依次加入100 μL细胞培养液(空白对照)、终浓度为5、10、15、20 μg/mL的AC-1溶液(AC-1药物组),终浓度为5 μg/mL的甘露聚糖肽(Man)溶液(阳性对照组)后,继续培养24 h,利用酶标仪在450 nm波长下测OD值,并记录实验结果。
抑制率(%)=[OD值(空白对照组)-OD值
(实验组)]/OD值(空白对照组)×100%
注:实验组为AC-1药物组和Man阳性对照组。
1.4 统计学分析
实验数据用IBM SPSS Statistics 19软件进行统计学处理,差异分析采取单因素方差分析,与空白对照组相比,P<0.05为差异性显著,用“*”表示;P<0.01为差异性极显著,用“**”表示。
2 实验结果
2.1 橙盖鹅膏多糖(AC-1)体外免疫调节活性
2.1.1 橙盖鹅膏多糖(AC-1)对T淋巴细胞增殖的影响
T细胞是在胸腺分化成熟的一类免疫细胞,它通过辅助激活B细胞以及产生细胞因子等方式参与机体免疫。AC-1对T细胞增殖的作用如图2所示,AC-1的终浓度为1.25~10 μg/mL时,均能够促进T细胞的增殖(P<0.01),且低中等浓度的AC-1对T细胞增殖效应较好。细胞与药物共培养24 h后T细胞的生长形态如图3所示,正常生长的T细胞悬浮生长、成团较小。在浓度为1.25~10 μg/mL时,T细胞生长状态良好,数量增多,成团变大。以上结果表明,AC-1可极显著刺激T细胞的增殖及成团,在机体的细胞免疫方面具有重要的作用。
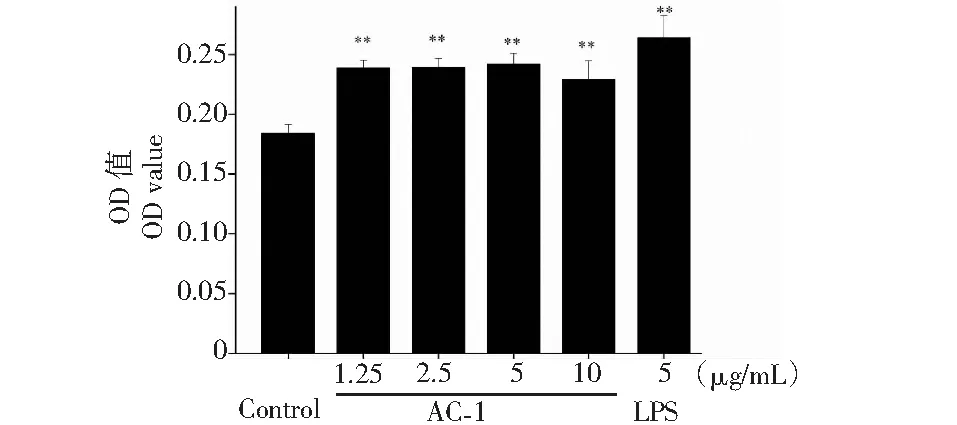
图2 橙盖鹅膏多糖(AC-1)对T淋巴细胞增殖的影响Fig.2 Effect on the proliferation of T cells by Amanita caesarea polysaccharide (AC-1)注:与空白对照组相比,P<0.05为差异性显著,用“*”表示;P<0.01为差异性极显著,用“**”表示。Note:Compared with control group,P<0.05 was significant difference,expressed by “*”;P<0.01 was extremely significant,expressed by “**”.
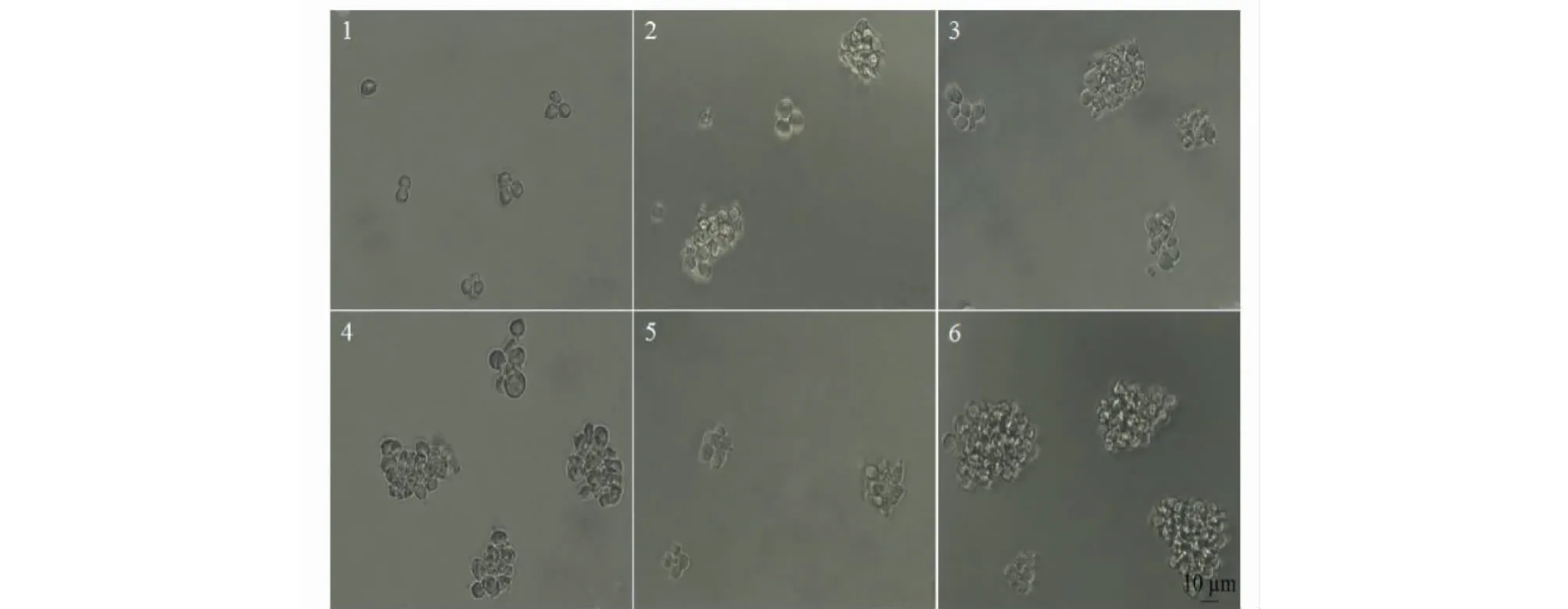
图3 橙盖鹅膏多糖(AC-1)对T细胞形态的影响Fig.3 Effect on T cells morphology by Amanita caesarea polysaccharide (AC-1)注:1为空白对照组,2~5为AC-1药物组,其终浓度分别为1.25、2.5、5、10 μg/mL,6为LPS阳性对照组(5 μg/mL),细胞放大倍数(10 ×20)。Note:1 was control group.2-5 were AC-1 group,the final concentration were 1.25,2.5,5,10 μg/mL,respectively.6 was LPS positive control group (5 μg/mL),cell magnification (10 ×20)
2.1.2 橙盖鹅膏多糖(AC-1)对B淋巴细胞增殖的影响
B细胞是在骨髓中发育和分化的一种淋巴细胞,能够参与机体的体液免疫,对于维持机体的稳态具有重要作用。AC-1对B细胞增殖的影响如图4所示,AC-1的终浓度为1.25~10 μg/mL时均能够促进B细胞的增殖,且浓度为5 μg/mL时促进B细胞增殖的效应最好。同等浓度下(5 μg/mL),B细胞在AC-1作用下的增殖率(36.98%)高于LPS作用下的增殖率(17.30%)。细胞与药物共培养24 h后B细胞的生长形态如图5所示,在AC-1浓度为1.25~5 μg/mL时,随着浓度的增加,B细胞的数量增多,成团变大。以上结果表明,AC-1可显著刺激B细胞的增殖及成团,在机体的体液免疫方面具有重要的作用。
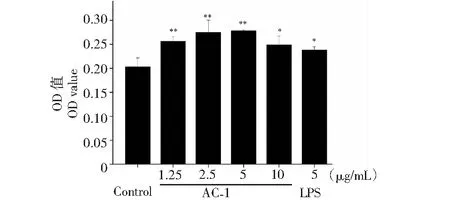
图4 橙盖鹅膏多糖(AC-1)对B淋巴细胞增殖的影响Fig.4 Effect on the proliferation of B cells by Amanita caesarea polysaccharide (AC-1)注:与空白对照组相比,P<0.05为差异性显著,用“*”表示;P<0.01为差异性极显著,用“**”表示。Note:Compared with control group,P<0.05 was significant difference,expressed by “*”;P<0.01 was extremely significant,expressed by “**”.

图5 橙盖鹅膏多糖(AC-1)对B细胞形态的影响Fig.5 Effect on B cells morphology by Amanita caesarea polysaccharide (AC-1)注:1为空白对照组,2~5为AC-1药物组,其终浓度分别为1.25、2.5、5、10 μg/mL,6为LPS阳性对照组(5 μg/mL),细胞放大倍数(10 ×20)。Note:1 was control group.2-5 were AC-1 group,the final concentration were 1.25,2.5,5,10 μg/mL,respectively.6 was LPS positive control group (5 μg/mL),cell magnification (10×20).
2.1.3 橙盖鹅膏多糖(AC-1)对B细胞分泌抗体的影响
B淋巴细胞在抗原的刺激下分化形成浆细胞,浆细胞分泌的抗体能够将入侵的抗原进行清除。借助ELISA检测试剂盒,我们对B细胞分泌抗体的情况进行了统计,结果如图6至图9所示,在浓度为2.5~10 μg/mL范围内,AC-1能够促进B淋巴细胞分泌Ig A、Ig E、Ig G和Ig M抗体,但促进Ig A和Ig G抗体分泌的最适浓度为10 μg/mL,而促进Ig E、Ig M抗体分泌的最适浓度为2.5 μg/mL。
2.1.4 橙盖鹅膏多糖(AC-1)对小鼠巨噬细胞RAW264.7增殖的影响
巨噬细胞是比较特殊的一类免疫细胞,它既能参与机体的固有免疫,也能参与机体的特异性免疫,在免疫系统中具有重要的作用。AC-1对RAW264.7的效应如图10所示,AC-1的终浓度为1.25~10 μg/mL时,均能够促进RAW264.7的增殖,在浓度为5 μg/mL时对RAW264.7的增殖效应最好。细胞与药物共培养24 h后RAW264.7的生长形态如图11所示,正常状态下的巨噬细胞贴壁生长并呈椭圆形,在浓度为1.25~10 μg/mL时,RAW264.7伸出伪足的细胞数量明显增多,该结果提示AC-1能够活化RAW264.7细胞,在机体的固有免疫和特异性免疫方面具有重要的作用。
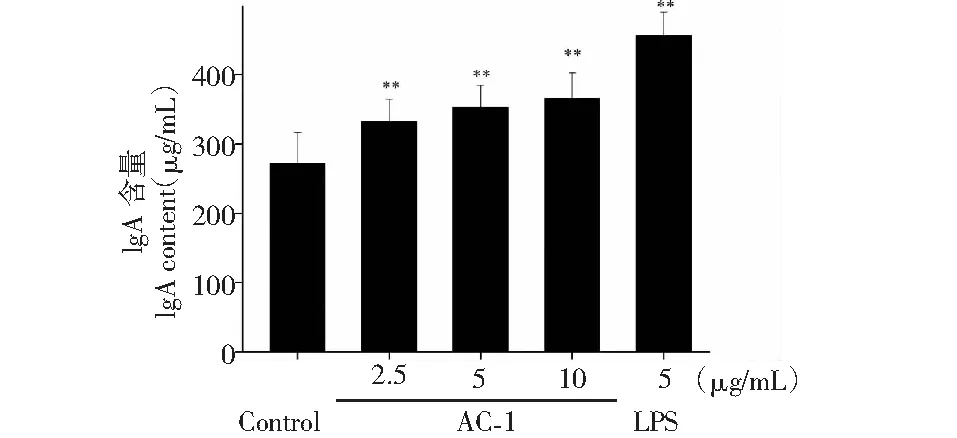
图6 橙盖鹅膏多糖(AC-1)对B细胞分泌Ig A抗体的影响Fig.6 Effect of Amanita caesarea polysaccharide (AC-1) on secretion of Ig A antibody from B cells注:与空白对照组相比,P<0.05为差异性显著,用“*”表示;P<0.01为差异性极显著,用“**”表示。Note:Compared with control group,P<0.05 was significant difference,expressed by “*”;P<0.01 was extremely significant,expressed by “**”.
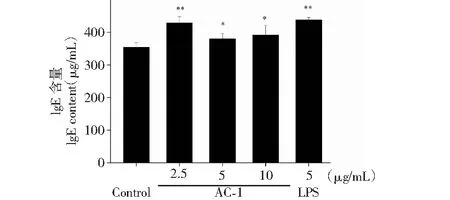
图7 橙盖鹅膏多糖(AC-1)对B细胞分泌Ig E抗体的影响Fig.7 Effect of Amanita caesarea polysaccharide (AC-1) on secretion of Ig E antibody from B cells注:与空白对照组相比,P<0.05为差异性显著,用“*”表示;P<0.01为差异性极显著,用“**”表示。Note:Compared with control group,P<0.05 was significant difference,expressed by “*”;P<0.01 was extremely significant,expressed by “**”.
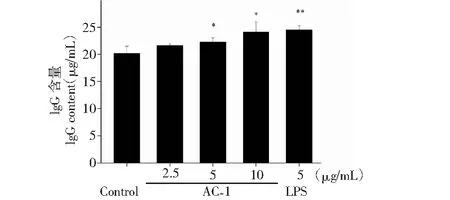
图8 橙盖鹅膏多糖(AC-1)对B细胞分泌Ig G抗体的影响Fig.8 Effect of Amanita caesarea polysaccharide (AC-1) on secretion of Ig G antibody from B cells注:与空白对照组相比,P<0.05为差异性显著,用“*”表示;P<0.01为差异性极显著,用“**”表示。Note:Compared with control group,P<0.05 was significant difference,expressed by “*”;P<0.01 was extremely significant,expressed by “**”.
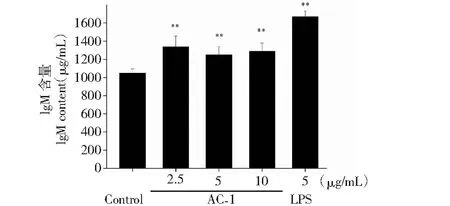
图9 橙盖鹅膏多糖(AC-1)对B细胞分泌Ig M抗体的影响Fig.9 Effect of Amanita caesarea polysaccharide (AC-1) on secretion of Ig M antibody from B cells注:与空白对照组相比,P<0.05为差异性显著,用“*”表示;P<0.01为差异性极显著,用“**”表示。Note:Compared with control group,P<0.05 was significant difference,expressed by “*”;P<0.01 was extremely significant,expressed by “**”.
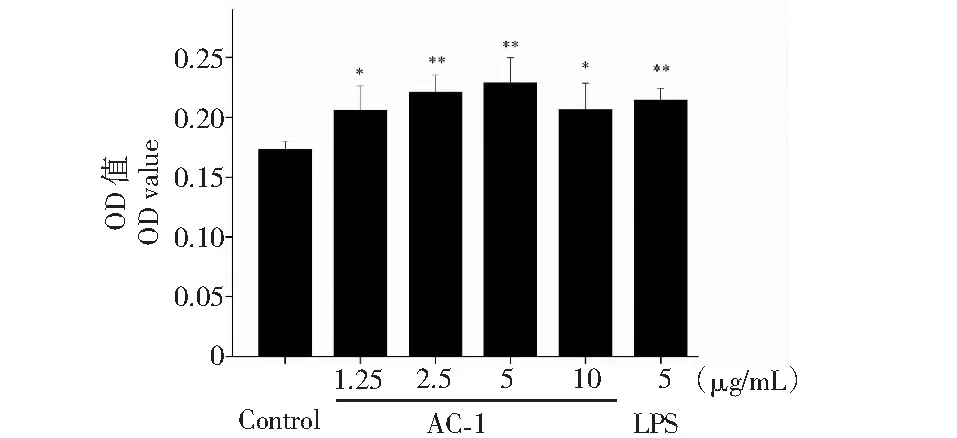
图10 橙盖鹅膏多糖(AC-1)对RAW264.7细胞增殖的影响Fig.10 Effect on the proliferation of RAW264.7 cells by Amanita caesarea polysaccharide (AC-1)注:与空白对照组相比,P<0.05为差异性显著,用“*”表示;P<0.01为差异性极显著,用“**”表示。Note:Compared with control group,P<0.05 was significant difference,expressed by “*”;P<0.01 was extremely significant,expressed by “**”.
2.1.5 橙盖鹅膏多糖(AC-1)对小鼠腹腔巨噬细胞RAW264.7吞噬能力的影响
AC-1对RAW264.7吞噬中性红能力的影响如图12所示,当AC-1的终浓度为1.25~10 μg/mL时均能够促进巨噬细胞吞噬中性红(P<0.01),最适浓度为2.5 μg/mL,此时吞噬率可达89.50%。同等浓度下(5 μg/mL),AC-1刺激下RAW264.7的吞噬率(69.69%)高于LPS刺激下的吞噬率(19.34%)。以上结果进一步表明AC-1不仅能显著刺激RAW264.7增殖,还能显著增强RAW264.7的吞噬功能,在激活机体免疫、维持机体内环境稳态方面具有重要的作用。
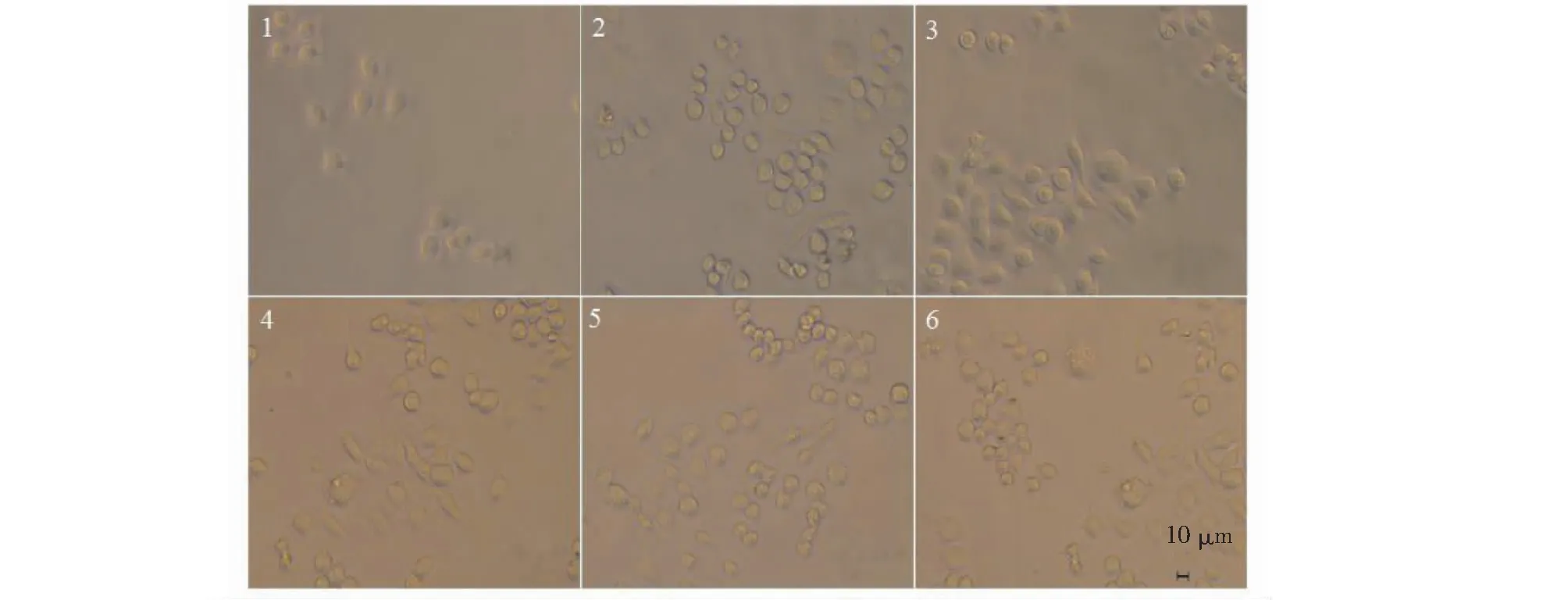
图11 橙盖鹅膏多糖(AC-1)对RAW264.7细胞形态的影响Fig.11 Effect on RAW264.7 cells morphology by Amanita caesarea polysaccharide (AC-1)注:1为空白对照组,2~5为AC-1药物组,其终浓度分别为1.25、2.5、5、10 μg/mL,6为LPS阳性对照组(5 μg/mL),细胞放大倍数(10×20)。Note:1 was control group.2-5 were AC-1 group,the final concentration were 1.25,2.5,5,10 μg/mL,respectively.6 was LPS positive control group (5 μg/mL),cell magnification (10×20).

图12 橙盖鹅膏多糖(AC-1)对巨噬细胞RAW264.7吞噬中性红能力的影响Fig.12 Effect of Amanita caesarea polysaccharide (AC-1) on the ability of macrophages to phagocytose neutral red注:与空白对照组相比,P<0.05为差异性显著,用“*”表示;P<0.01为差异性极显著,用“**”表示。Note:Compared with control group,P<0.05 was significant difference,expressed by “*”;P<0.01 was extremely significant,expressed by “**”.
2.2 橙盖鹅膏多糖(AC-1)对小鼠成纤维细胞(L929)的细胞毒性实验
L929细胞为小鼠成纤维细胞,贴壁生长,是细胞毒理性实验的常用细胞。本实验以L929细胞为模型探究AC-1对正常细胞的毒性作用,实验结果如图13所示,在AC-1的浓度为5~20 μg/mL时对L929细胞无显著的增殖及抑制作用,说明AC-1对正常细胞无毒性。
2.3 橙盖鹅膏多糖(AC-1)体外抗肿瘤活性
2.3.1 橙盖鹅膏多糖(AC-1)对小鼠胃癌细胞(MFC)生长的影响
胃癌是对人类健康有危害的恶性肿瘤之一,致死率在全部恶性肿瘤中排第二位。AC-1对MFC细胞的影响如图14所示,AC-1在终浓度为10~20 μg/mL时能够抑制MFC细胞的生长(P<0.01)。并且当AC-1浓度为20 μg/mL时抑制率高达30.09%。细胞与药物共培养24 h后MFC的形态如图15所示,当AC-1浓度为10~20 μg/mL时,随着浓度的增加,细胞的数量逐渐变小,细胞之间的间隙变大,提示AC-1在浓度为10~20 μg/mL时能够对MFC细胞骨架产生一定的影响,且随着浓度的增加,效果越明显。
2.3.2 橙盖鹅膏多糖(AC-1)对小鼠肉瘤细胞(S180)生长的影响
S180为小鼠肉瘤细胞(腹水瘤细胞系),通常作为抗肿瘤活性实验的研究对象。AC-1对S180细胞的影响如图16所示,当AC-1的终浓度为5~20 μg/mL时均可显著抑制S180细胞的生长(P<0.05)。细胞与药物共培养24 h后S180细胞生长形态如图17所示,AC-1在终浓度为10~20 μg/mL时,随着浓度的增加,细胞之间的间隙变大,提示AC-1在浓度为10~20 μg/mL时能够直接对S180细胞产生抑制效果,并能够对S180细胞骨架产生一定的影响,但其抑制效果相对于MFC细胞较弱,提示AC-1对于不同的肿瘤细胞具有不同的抑制效果,其相关机制有待进一步研究。
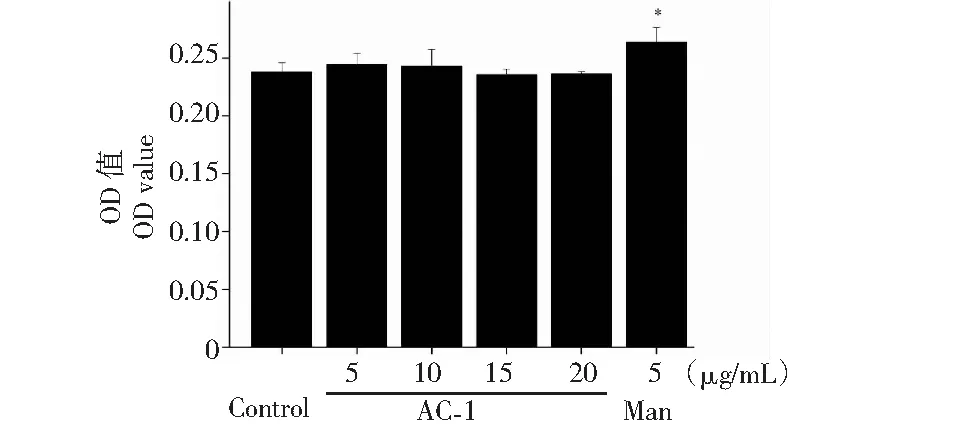
图13 橙盖鹅膏多糖(AC-1)对小鼠成纤维细胞(L929)的影响Fig.13 Effect of Amanita caesarea polysaccharide (AC-1) on the mouse fibroblast (L929)注:与空白对照组相比,P<0.05为差异性显著,用“*”表示;P<0.01为差异性极显著,用“**”表示。Note:Compared with control group,P<0.05 was significant difference,expressed by “*”;P<0.01 was extremely significant,expressed by “**”.
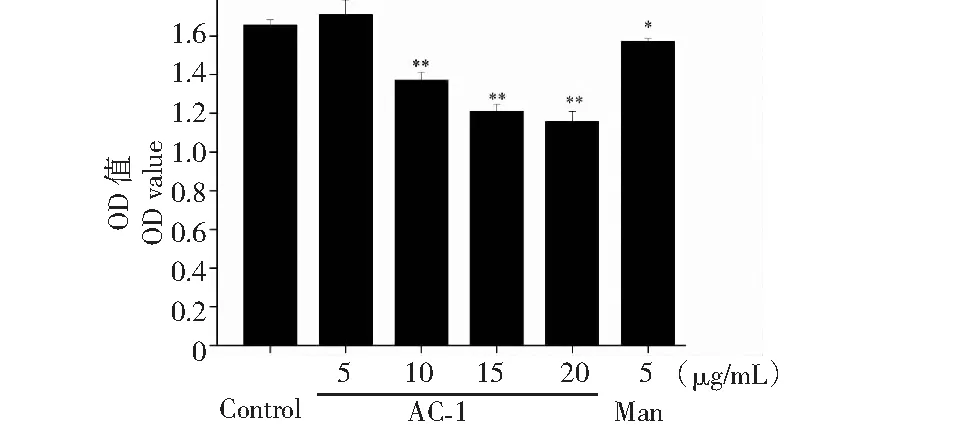
图14 橙盖鹅膏多糖(AC-1)对小鼠胃癌细胞(MFC)的影响Fig.14 Effect of Amanita caesarea polysaccharide (AC-1) on the gastric cancer cells (MFC)注:与空白对照组相比,P<0.05为差异性显著,用“*”表示;P<0.01为差异性极显著,用“**”表示。Note:Compared with control group,P<0.05 was significant difference,expressed by “*”;P<0.01 was extremely significant,expressed by “**”.
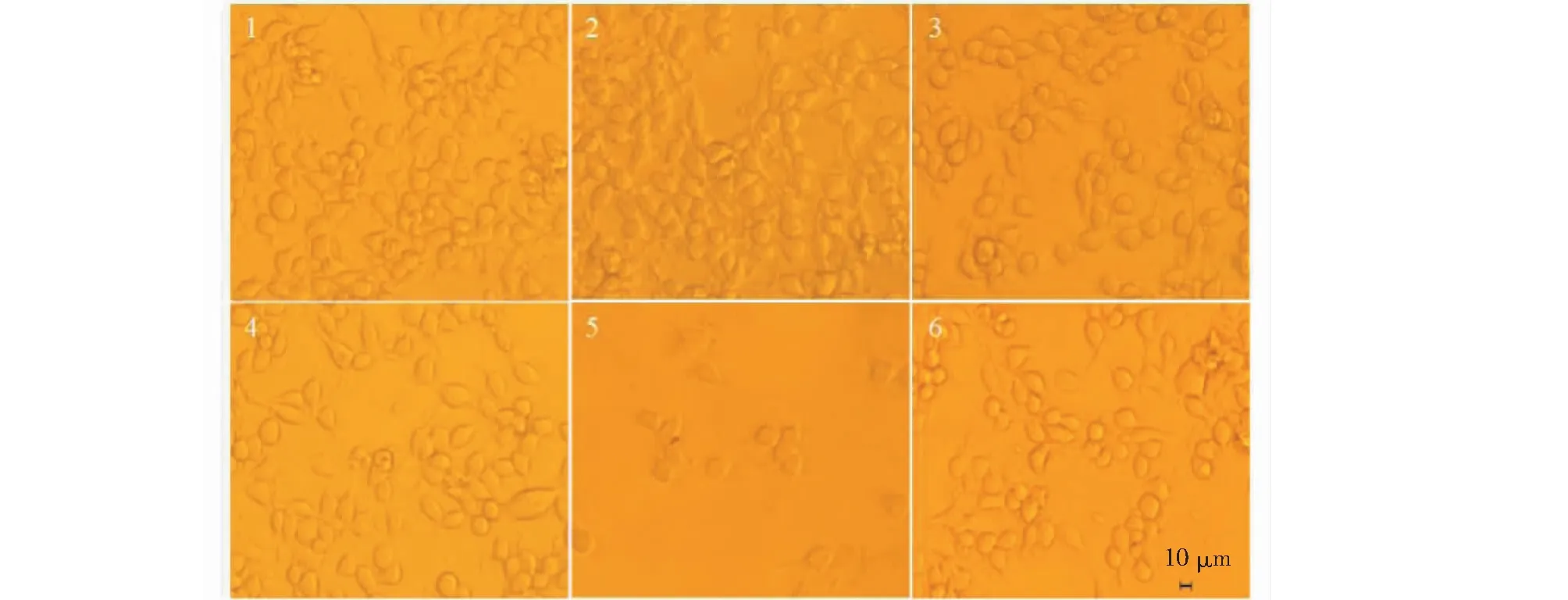
图15 橙盖鹅膏多糖(AC-1)对小鼠胃癌细胞(MFC)形态的影响Fig.15 Effect on gastric cancer cells (MFC) morphology by Amanita caesarea polysaccharide (AC-1)注:1为空白对照组,2~5为AC-1药物组,其终浓度分别为5、10、15、20 μg/mL,6为Man阳性对照组(5 μg/mL),细胞放大倍数(10×20)。 Note:1 was control group.2-5 were AC-1 group,the final concentration were 5,10,15,20 μg/mL,respectively.6 was Man positive control group (5 μg/mL),cell magnification (10×20).

图16 橙盖鹅膏多糖(AC-1)对小鼠肉瘤细胞(S180)的影响Fig.16 Effect of Amanita caesarea polysaccharide (AC-1) on the mouse sarcoma cells (S180)注:与空白对照组相比,P<0.05为差异性显著,用“*”表示;P<0.01为差异性极显著,用“**”表示。Note:Compared with control group,P<0.05 was significant difference,expressed by “*”;P<0.01 was extremely significant,expressed by “**”.
3 结论
本实验以从四川采摘的橙盖鹅膏子实体中提取的结构新颖的多糖AC-1为研究对象,探究了其体外免疫调节活性、细胞毒性和抗肿瘤活性。实验结果表明,AC-1能够在体外促进三种免疫细胞(B、T和RAW264.7)的增殖、巨噬细胞的吞噬及B细胞分泌抗体。抗体分泌实验表明,AC-1在较低浓度下促进Ig E分泌的效果更明显,而在较高浓度下促进Ig G的分泌效果最明显,提示AC-1在较低浓度下主要通过促进Ig E介导的超敏反应来发挥体液免疫功能,而在较高浓度下则是通过增强Ig G介导的吞噬调理等作用发挥体液免疫功能。AC-1也能在体外抑制小鼠胃癌细胞(MFC)和小鼠肉瘤细胞(S180)增殖,且对正常细胞无抑制作用,但对S180细胞的抑制效果较MFC细胞弱,提示AC-1无细胞毒性且具有良好的体外免疫调节活性和抗肿瘤活性,但对不同的肿瘤细胞具有不同的抑制效果。

图17 橙盖鹅膏多糖(AC-1)对小鼠肉瘤细胞(S180)形态的影响Fig.17 Effect on morphology of the Mouse sarcoma cells (S180) by Amanita caesarea polysaccharide (AC-1)注:1为空白对照组,2~5为AC-1药物组,其终浓度分别为5、10、15、20 μg/mL,6为Man阳性对照组(5 μg/mL),细胞放大倍数(10×10)。 Note:1 was control group,2-5 were AC-1 group,the final concentration were 5,10,15,20 μg/mL,respectively,6 was Man positive control group (5 μg/mL),cell magnification (10×10).
张茜[11]研究发现,香菇多糖和银耳多糖在低于10 μg/mL不能促进巨噬细胞RAW264.7的增殖,也不能促进T、B细胞增殖。而本实验的橙盖鹅膏多糖(AC-1)在1.25~10 μg/mL都能刺激B、T细胞和RAW264.7的增殖,提示AC-1在此浓度下免疫增殖效果要优于香菇多糖和银耳多糖。巨噬细胞是重要的抗原递呈细胞,而吞噬功能是巨噬细胞发挥递呈抗原功能的基础,本实验结果还表明AC-1能够促进巨噬细胞的吞噬,增强其抗原递呈功能。体外抗肿瘤活性实验比较,AC-1在浓度为20 μg/mL时,对小鼠胃癌细胞(MFC)的抑制率为30.09%,高于黄盖鹅膏多糖浓度为40 μg/mL时对人胃癌细胞(MGC)的抑制率16.47%[5],造成这两种多糖活性的差异的原因可能与两者的结构、分子量以及纯度等具有较大的关系。
进一步分析发现,在浓度为2.5~10 μg/mL范围内,AC-1能够促进B淋巴细胞分泌Ig A、Ig E、Ig G和Ig M抗体,但促进Ig A和Ig G抗体分泌的最适浓度为10 μg/mL,而促进Ig E、Ig M抗体分泌的最适浓度为2.5 μg/mL,该结果提示不同浓度的橙盖鹅膏多糖(AC-1)能导致B淋巴细胞分泌免疫球蛋白(Ig)发生类别转换。Ig类别转换是指在抗原或共刺激分子的作用下导致B细胞发生由产生Ig M抗体向产生Ig A、Ig G和Ig E转变的行为[12]。Ig类型的转换会受局部微环境和细胞因子的影响和调节,例如低浓度的卵清蛋白(OVA)主要诱导产生Ig E和Ig G1,高浓度卵清蛋白(OVA)主要诱导产生Ig G2a[13];低浓度的竹节参醇提物(HBsAg)主要诱导产生Ig G1,而高浓度的竹节参醇提物(HBsAg)主要诱导产生Ig G2b[14];同样,IL-4在低浓度时主要诱导产生Ig G1,而在高浓度时则主要诱导产生Ig E[15]。本实验结果显示,AC-1在浓度为2.5 μg/mL时能诱导B细胞分泌的Ig向Ig E、Ig M类别转换,而在浓度为10 μg/mL时能诱导B细胞分泌的Ig向Ig A、Ig G类别转换,相关分子机制有待进一步研究。
一般认为,以β-(1→3)(1→6)或以β-(1→4)(1→6)糖苷键连接的多糖活性较强,因为此种构型有利于形成三股绳状螺旋立体构型,显示较高的免疫活性和抗肿瘤活性[16]。例如以β-(1→3)-D葡聚糖为主链的香菇多糖、猪苓多糖和奇果菌多糖均具有提高机体免疫和抗肿瘤的功能[16];也有研究表明,以α-D葡聚糖为主的多糖也具有抗肿瘤活性,如对多种肿瘤细胞的生长均具有抑制作用的松茸多糖就以α-(1→6)-D葡萄糖为主链[17],本研究结果表明以α-(1→4)和α-(1→3)-D葡萄糖为主链的AC-1也具有较好的免疫调节活性和抗肿瘤活性,提示多糖的活性也受到侧链单糖种类和高级结构的影响。
真菌多糖具有多种生物活性,但具体发挥哪种活性与细胞内信号传递密切相关。例如具有β-(1→3)-D葡聚糖主链的香菇多糖,能够通过MyD88依赖的NF-кB途径解除免疫抑制[18];具有β-(1→3)和β-(1→6)-D葡聚糖的茯苓多糖,通过NF-кB/MAPK信号通路激活巨噬细胞释放NO[19];具有β-(1→3)和β-(1→6)葡聚糖的灰花树多糖通过Dectin-1/Sky/NF-кB信号通路活化巨噬细胞,使其分泌TNF-α和IL-6,达到抑瘤效果[20]。综上可以看出,NF-кB途径在β-葡聚糖发挥免疫作用中扮演重要的角色,然而NF-кB在以α-D-葡萄糖为主链的AC-1发挥生物活性时是否具有同样的作用,则有待进一步进行探究。
本实验结果表明:AC-1具有在体外增强免疫应答和抑制肿瘤细胞生长的功能,且对正常细胞无毒副作用,这为橙盖鹅膏多糖(AC-1)作为抗肿瘤药物的开发利用提供了科学依据,但其与细胞表面的何种受体结合以及信号如何进行传递则有待进一步探究。
