携载增强型绿色荧光蛋白基因慢病毒标记小鼠脐带间充质干细胞示踪方法
2019-10-10朱文侠黄广智马小娜
朱 慧,朱文侠,黄广智,马小娜
(1.延安大学医学院,陕西 延安 716000;2.延安大学附属医院皮肤科,陕西 延安 716000)
脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)生物活性好,次均取材量较大且无伦理限制。mUCMSCs具有自我更新和向骨、软骨、脂肪、心肌、肌纤维等成熟细胞分化的潜能。除此之外,还具有MSC的以下生物学特性[1],主要包括:①免疫调节:有低免疫原性,移植后免疫排斥反应较小。②旁分泌功能[2]:MSCs可产生细胞因子、趋化因子、外泌体等,参与机体免疫调控。③归巢特性:与趋化因子作用,靶向迁移向损伤组织。因此,UCMSCs现常用作治疗疾病、组织工程、再生医学等研究的种子细胞。在体内及一些体外实验中,细胞示踪是必要的实验手段。
增强型绿色荧光蛋白(enhanced green fluorecent protein,eGFP)示踪法是用慢病毒作为载体将eGFP基因转染到细胞,表达GFP以显示绿色荧光,该方法荧光特异性高,易于检测并且对细胞生物学特性影响较小,是目前较理想的细胞示踪方法,也可直接利用GFP基因小鼠直接培养原代细胞[3],用于示踪实验,原理一致。本研究拟用慢病毒介导的eGFP标记小鼠脐带间充质干细胞(mouse umbilical cord mesenchymal stem cells,mUCMSCs),确定合适的最佳感染复数(MOI),为其示踪等实验奠定基础。
1 材料与方法
1.1 材料
C57BL/6雌性小鼠,8周龄,怀孕14~15天,体重30~35 g,由昆明医科大学实验动物中心提供【SCXK(滇)2013-0001】,饲养于昆明总医院动物实验中心【SYXK(滇)2014-0010】。DMEM/f12培养基、胎牛血清(Fetal bovine serum,FBS;Invitrogen,USA)和trypsin-EDTA(Invitrogen,USA),流式细胞术抗体(ebioscience,USA);eGFP慢病毒(吉满生物公司)。相差显微镜、荧光显微镜(NIKON);活体成像仪(MIIS,USA)。
1.2 mUCMSCs的分离培养
处死C57BL/6小鼠(孕16~17 d),取子宫串珠置于无菌50 mL离心管内,迅速带至超净工作台,无菌生理盐水清洗脐带3次。剪碎于1.5 mL EP管中,肉眼观成糊状,加入含20%FBS的DMEM/F12培养液(250~500 μL,根据组织匀浆的量自行判断),移液枪轻轻吹吸至充分悬浮后,均匀铺至25 cm2培养瓶瓶底,静置于37℃、CO2培养箱,16~18 h后轻拿至倒置显微镜下观察细胞生长特性及形态特征并适当补液。每2~3日用10%FBS的DMEM/F12培养液换液,注意观察细胞生长情况,组织块周围细胞较为聚集时可进行第一次传代,传代时换75 cm2或更大底面积的培养瓶,约3~5 d达80%融合时进行传代。收集第3代mUCMSCs,用于下一步实验,若较多则冻存。
1.3 mUCMSCs增殖曲线绘制
消化收集的第3代mUCMSCs,计数后用10%FBS培养液调整细胞浓度为2×104个/mL,取100 μL/孔接种于96孔培养板,每孔设置3个复孔。第3天和第7天全部细胞换液。接种后24 h开始,每天同一时间点取一组复孔换液后加入200 μL CellTiter 96®Aqueous One Solution Reagent,加液后3 h用酶标仪测吸光度值,连续测试8 d之内细胞增殖情况。取各时间点吸光度的平均值,以时间为横坐标、吸光度值为纵坐标,绘制细胞生长曲线。
1.4 mUCMSCs分化潜能检测
消化收集第三代细胞完成体外诱导实验。成脂分化:接种细胞(4×104/孔)于12孔板中培养6 h后,更换培养液为成脂诱导分化培养液,3~4 d换液一次,连续培养14 d后,4%多聚甲醛固定后加入油红O染色;成骨分化:按照上述成脂分化培养细胞,成骨诱导分化培养21 d后,固定并加入茜素红染色;成软骨分化:收集细胞并调整细胞密度为1.6×107/mL,每孔加5 μL到12孔板的中心,形成一个细胞滴,2 h后再缓慢加入成软骨诱导分化培养液,2~3 d换液一次,不断培养细胞会形成一个细胞团漂浮起来,连续培养14 d后,4%多聚甲醛固定后石蜡包埋作病理切片,脱蜡后加入阿新蓝染色。
1.5 mUCMSCs的标记
慢病毒载体介导GFP基因转染mUCMSCs将第3代mUCSC计数,计算每孔细胞数及不同MOI值(MOI=50、100、150、200)对应的病毒滴度的体积,分别平均滴入六孔板的四个孔,并留仅加培养液的空白对照孔,滴入对应体积的病毒,补足培养液,使每孔总液量体积为2 mL,轻轻上下、左右摇板,混匀即使病毒悬液与细胞充分接触,4~8 h换液。48 h左右进行荧光显微镜下观察和体外细胞信号强度测定。
2 结果
2.1 mUCMSCs的分离及培养
小鼠脐带取材后静置培养24~48 h,即可在倒置显微镜下观察到少许梭形贴壁细胞由组织块边缘或以散在的方式长出(见图1A),2~3 d可见少数细胞集落形成。经过换液弃除未贴壁的组织,第7~10 d可见细胞快速生长至80%融合状态时传代培养。镜下可见这些细胞密集排列呈现漩涡状生长,显示间充质干细胞的典型特征(见图1B),初步判断这些贴壁生长的成纤维细胞样细胞就是mUCMSCs。
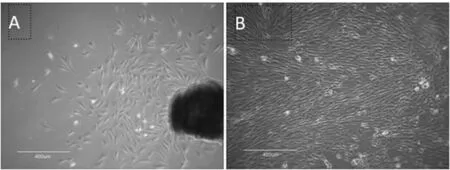
图1 mUCMSCs的形态特征bar=400μm
2.2 mUCMSCs增殖曲线
原代细胞增殖较慢,经过传代的细胞增殖生长较一致。第三代细胞生长曲线(见图2)显示:第1~3天细胞增殖缓慢,第4~6天为对数增殖期,以后进入相对稳定状态。细胞潜伏期、快速增殖期和平稳期体现了经典的细胞周期各个阶段,呈S型,符合间充质干细胞的生长特征。
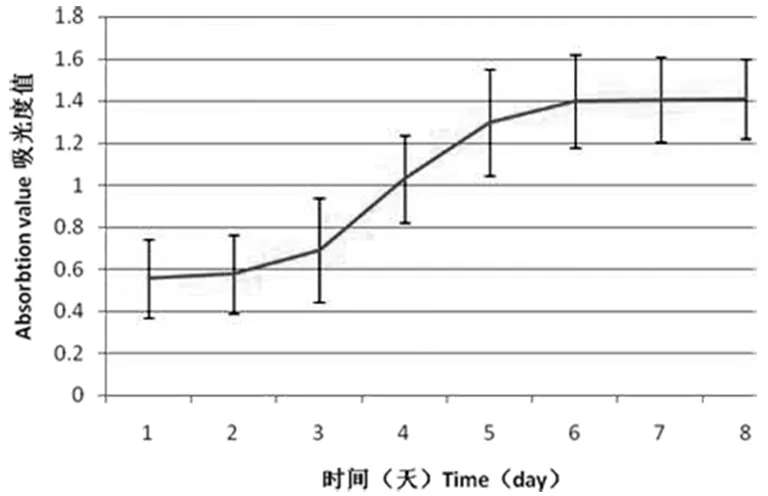
图2 P3mUCMSCs的生长曲线
2.3 mUCMSC的成软骨、成脂、成骨三向分化
体外诱导分化实验显示:第三代mUCMSCs经成软骨分化,诱导培养14 d后,固定并行病理切片检测,可观察到大量氨基葡聚糖被阿新兰染成蓝色(见图3A),即成软骨分化阳性。同样,成脂分化诱导培养14 d后,可观察到大量脂滴的出现,油红O染色后,可见脂滴被染成红色(见图3B),即成脂分化阳性;成骨分化诱导培养21 d后,可观察到白色结节,茜素红染色后,可见钙质结节被染成红色(见图3C),即成骨分化阳性。
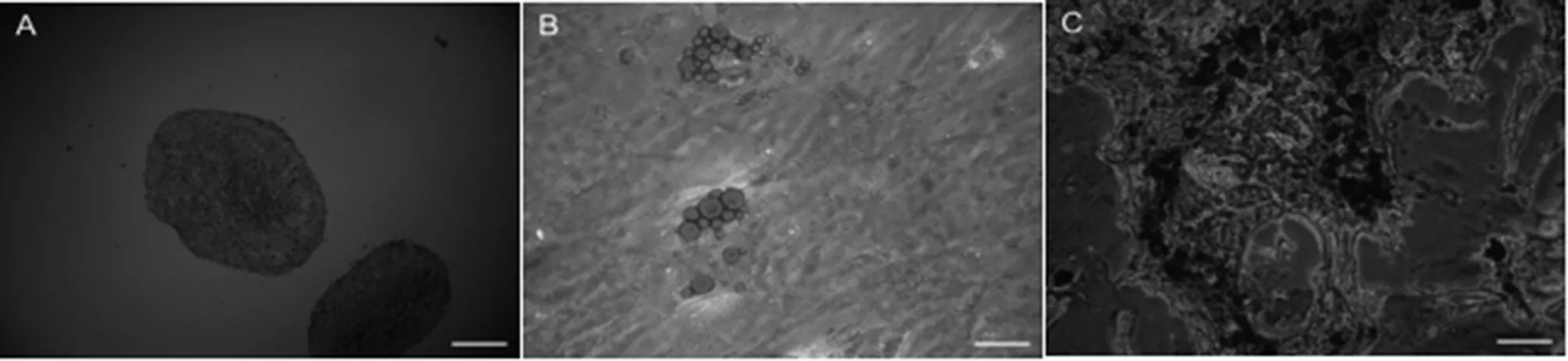
图A,图B,bar=100μ;图C,bar=40μm
图3mUCMSCs的体外诱导分化
2.4 慢病毒载体介导GFP基因转染mUCMSCs的MOI筛选
将含GFP基因的慢病毒与mUCMSCs共培养48 h后,观察不同MOI值eGFP慢病毒对mUCMSC的转染情况。荧光场下可见表达绿色荧光蛋白的细胞,明场下可见所有细胞,叠加后可见表达GFP,也就是被GFP标记的细胞在所有细胞的占比,MOI=150比例最高,达95%以上(见图4)。小动物活体成像仪下,曝光5分钟拍照检测细胞信号强度,MOI值=150的细胞组高于MOI值=50、100、200(见图5,数值见表1)。

图4 不同MOI值eGFP慢病毒对mUCMSC的转染荧光表达对比(A、B:bar=400μm)

图5 不同MOI值转染的mUCMSC体外信号强度

MOI50100150200ROI1.367×1081.491×1081.971×1081.373×108
3 讨论
脐带和骨髓来源的间充质干细胞为目前研究较为关注的多能干细胞。骨髓间充质干细胞的生物学特性易受供者年龄及身体状况甚至取材部位影响[4],且取材有伦理学限制,而UCMSC由胎儿脐带分离培养得到,将脐带变废为宝,增殖等生物学活性较为稳定,且不受伦理学限制[5]。目前MSC治疗疾病多处于动物实验阶段,且疾病的标准动物模型多为小鼠,体内实验为研究的基本步骤,因此mUCMSC的有效标记示踪显得尤为重要。
绿色荧光蛋白(Green fluorence protein,GFP)是从水母中获得的一种发绿色荧光的蛋白,常用质粒载体转染、病毒载体转染和绿色荧光蛋白转基因动物3种主要的标记细胞方式。本研究成功分离培养出mUCMSC,并根据贴壁生长、形态特征及生长曲线规律判断,用诱导液成功将其向骨骼、脂肪和软骨三个方向分化,可鉴定其为间充质干细胞特性。利用慢病毒作为载体,将荧光蛋白基因转染到mUCMSC,使其表达荧光蛋白,这种标记方法可以利用显影设备追踪到移植入小鼠体内被标记的细胞,如果被标记细胞增殖分裂,则荧光蛋白将会在子代表达;被标记细胞死亡,则荧光消失,这就使得移植入小鼠体内的MSC的去向、存活、代谢和增殖等情况能很好地被观察到[6]。eGFP慢病毒携带的是表达增强型绿色荧光蛋白的基因,因其稳定且毒性小,应用范围较广。MOI(multiplicity of infection,复染指数)是一个比值,当MOI=1时,病毒滴度与细胞个数的比例是1:1,即一个滴度的病毒对应一个细胞。病毒滴度指的是1 mL病毒液内的活性病毒数。本实验中,MOI=150时,细胞的转染率达95%以上,可不用嘌呤霉素筛选,直接输入小鼠体内,进行细胞示踪,为体内示踪实验奠定基础。
