蛋白质氧化对高白鲑肌浆蛋白理化特性的影响
2019-10-08邓小蓉雷用东卢士玲
邓小蓉,雷用东,2,卢士玲,刘 娟,张 建,*
(1.石河子大学食品学院,新疆 石河子 832003;2.新疆农垦科学院,农业部食品质量监督检验测试中心,新疆 石河子 832000)
高白鲑(Coregonus peled),属鲑科,白鲑属,为冷水性鱼类[1],其蛋白质含量高,富含二十碳五烯酸和二十二碳六烯酸等不饱和脂肪酸,易加工。在中国,目前主要以冷冻肉销售,而在贮藏和分销过程中,往往容易发生由蛋白氧化引起的质量劣变[2]。鱼肉蛋白对氧化敏感,研究发现鱼类的肌浆蛋白、肌纤维蛋白和基质蛋白,可能会在肌肉或肉加工过程中被脂类、金属离子和其他氧化剂氧化破坏[3-4],而大大降低了其食用品质和商品价值。
蛋白氧化通过不同机理而形成蛋白交联派生物,包括二硫化物、二聚酪氨酸和羰基的形成,以及肽键断裂,使蛋白质的物理化学性质发生改变[5]。有研究表明氧化使肌纤维蛋白发生变性,造成蛋白质聚合物的形成和蛋白质降解,这可能对蛋白质消化率有影响[6-8]。有报道称,氧化系统中,蛋白质中的二硫键和非二硫键可以产生交联[9],形成蛋白质聚合物,而导致蛋白质内疏水性基团增加,蛋白表面疏水性也随之增加。蛋白质氧化可以导致蛋白质构象、蛋白溶解性,以及蛋白质水解酶的敏感性的改变[10]。Ca和K-ATPase活性受肌浆蛋白上端活性中心的2 个活性巯基的影响;因此,两者都可以用作氧化指数,指示肌浆蛋白结构改变导致的变性[11]。
L i Y a n g q i等[12]研究了鲤鱼肌原纤维蛋白(myofibrillar proteins,MP)经氧化后,MP的结构和功能变化,显示MP易受自由基攻击,氧化应激对蛋白结构和MP的一般功能有不利影响。冷冻也会诱导鱼肉蛋白氧化,而配以冷冻保护剂可减少鲤鱼肉肌纤维蛋白氧化,从而减少有损鱼肉质构变化的蛋白结构改变[13]。目前对于鱼类蛋白质的研究主要集中在冷藏或冷冻过程中蛋白质变化和生理变化方面[14-15]。肌浆蛋白占肌肉组织总蛋白的30%,与鱼肉的颜色、风味、持水性等有关,可间接影响鱼肉质构品质[16]。鉴于此,本实验以高白鲑肌浆蛋白(sarcoplasmic proteins,SP)为研究对象,采用羟自由基氧化系统(hydroxyl radical-generating system,HRGS),对蛋白进行不同程度的体外模拟氧化,研究蛋白氧化对肌肉蛋白物化特性的影响,蛋白氧化及其物化特性指标均对阐释氧化还原反应对高白鲑肌肉蛋白质量的影响具有重要意义。
1 材料与方法
1.1 材料与试剂
高白鲑购于新疆赛里木湖,捕捞后立即进行内脏清理和去鳞处理,封于冰内运至石河子大学食品学院实验室。将鱼背部肌肉切割成大小均匀的肉块(约15 g),置于冰箱(-20 ℃)中备用。
牛血清蛋白标准物 美国Sigma-Aldrich公司;其他化学试剂均为优级纯。实验用水均为超纯水。
1.2 仪器与设备
Cary 50紫外-可见分光光度计、Cary eclipse荧光分光光度计 美国Varian公司。
1.3 方法
1.3.1 SP提取
鱼背部肌肉中SP的提取参考Hashimoto[17]和Chine[18]等的方法,提取液分别为磷酸盐缓冲液A和磷酸盐缓冲液B,所提取的蛋白用于测定蛋白氧化后的物化特性变化。
向鱼背部肌肉加入10 倍体积磷酸盐缓冲液A,均质1 min,8 000 r/min、4 ℃离心15 min,取上清液,沉淀物再进行1 次提取,分别合并2 次提取后的上清液。向上清液中加入10 倍体积的5%三氯乙酸(trichloroacetic acid,TCA)溶液,8 000 r/min、4 ℃离心15 min,沉淀物即为所需SP。
1.3.2 蛋白氧化
HRGS参照Park等[11]的方法进行制备,采用H2O2氧化体系,即控制体系中的FeCl3和抗坏血酸(ascorbic acid,Asc)的浓度,改变H2O2浓度(1~20 mmol/L),发生氧化还原反应而生成自由基。将提取的蛋白样品分别溶解在HRGS的磷酸盐缓冲溶液(50 mmol/L、pH 6.0)中,然后将样品在4 ℃条件下分别放置1、3 h和5 h,使肌肉蛋白发生不同程度的氧化,待蛋白质样品与氧化液反应结束后加入乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)以终止氧化反应。
1.3.3 羰基含量的测定
参照Oliver等[19]的方法进行测定。取5 mL蛋白样品于离心管中,每管加入5 mL 10 mmol/L的2,4-二硝基苯肼,室温下反应1 h(每10 min旋涡振荡1 次)后,添加5 mL 20% TCA溶液,8 000 r/min离心5 min,弃清液;取5 mL体积比为1∶1的无水乙醇和乙酸乙酯混合溶液清洗沉淀3 次以除去多余的试剂,再向沉淀中加入3 mL 6 mol/L盐酸胍溶液后置于水浴锅中(37 ℃,15 min),将沉淀溶解,8 000 r/min离心5 min除去不溶物质,离心后的上清液于370 nm波长处测定吸光度。采用摩尔消光系数22 000 L/(mol·cm)计算羰基含量。蛋白含量采用Biuret法测定,用血清白蛋白做标准曲线。
1.3.4 总巯基含量的测定
参照Simplicio等[20]的方法进行测定。取1 mL蛋白样品溶液,加入8 mL的Tris-甘氨酸(pH 8,每升该溶液中含有10.4 g Tris、6.9 g甘氨酸、1.2 g EDTA、8 mol/L尿素),然后均质,8 000 r/min离心15 min,除去不溶蛋白,再向溶液中加入0.5 mL 10 mmol/L Ellman试剂,反应30 min后,于412 nm波长处测定吸光度,采用摩尔消光系数13 600 L/(mol·cm)计算总巯基含量,采用Biuret法测定蛋白质的含量。除对照组不加蛋白溶液外,其他处理方法均如上所述。
1.3.5 游离氨基相对含量的测定
根据Brands等[21]的方法,采用邻苯二甲醛(orthophthalaldehyde,OPA)显色法进行测定。准确称取40 mg的OPA溶解于1 mL甲醇中,先后加入2.5 mL 20%的十二烷基磺酸钠、25 mL 0.1 mol/L的硼砂和100 μL β-巯基乙醇,并用蒸馏水定容至50 mL。将200 μL蛋白样品液分别注入到含有4 mL空白液和4 mL OPA试剂的试管中,混合均匀后在35 ℃条件下反应2 min,于340 nm波长处测吸光度A0和A。游离氨基相对含量按式(1)计算:
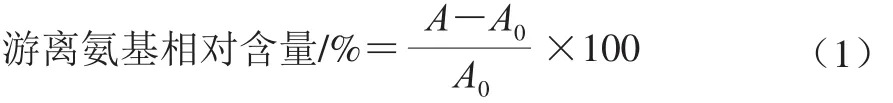
1.3.6 表面疏水性的测定
参照Chelh等[22]的方法进行测定。取1 mL蛋白样品溶液加入到200 μL 1 mg/mL的溴酚蓝(bromophenol blue,B P B)中,混匀,室温下搅拌1 0 m i n,8 000 r/min离心15 min,取上清液于595 nm波长处测定吸光度A。将200 μL 1 mg/mL的BPB加入到1 mL 20 mmol/mL的磷酸盐缓冲液(pH 6.0)作为BPB空白样,磷酸盐缓冲液(pH 6.0)为空白样,测定吸光度A0。按式(2)计算:
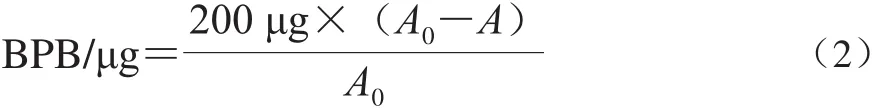
1.3.7 二聚酪氨酸含量的测定
参考Davies等[10]的方法进行测定。利用荧光分光光度计测定二聚酪氨酸含量,测定条件为发射波长420 nm,激发波长325 nm,狭缝宽度10 nm。
1.3.8 Ca2+-ATPase活性的测定
根据Katoh等[23]的方法测定。取0.2 mL蛋白样品溶液于2 mL Ca2+-ATPase反应液(内含7.6 mmol/L ATP、15 mmol/L CaCl2·2H2O、150 mmol/L KCl、180 mmol/L Tris-HCl,pH 7.4,温度25 ℃)中反应10 min后,加入1.0 mL 10% TCA溶液终止反应,8 000 r/min离心5 min去除沉淀,取1.0 mL上清液并加入3.0 mL 0.66%的钼酸铵溶液,充分混合后,加入0.5 mL新配制的10% FeSO4溶液,反应2 min,于700 nm波长处测定吸光度,根据磷酸盐标准曲线计算磷酸盐的含量。
1.3.9 SDS-PAGE测定
配制质量浓度为1 mg/mL的肌肉蛋白溶液置于塑料离心管中,加入等体积的5×样品缓冲液(含50%甘油、10% SDS、β-巯基乙醇、1% BPB和1 mol/L pH 6.8的Tris-HCl),混匀后,于100 ℃水浴2 min,冷却至室温备用。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)参照Laemmli[24]的方法。电泳选用10%的分离胶和5%的浓缩胶,上样量为5 μL,电泳开始时将电压调到80 V,当样品进入分离胶后将电压调节到120 V。电泳结束后,将电泳胶片剥出,用考马斯亮蓝(2.5 g考马斯亮蓝R-250,500 mL甲醇,100 mL冰乙酸定容至1 000 mL)染色30 min,然后用脱色液(250 mL甲醇、75 mL冰乙酸,定容至1 000 mL)进行多次脱色,直至胶片透明,蛋白质样品分子质量的确定根据标准蛋白Marker的相对迁移率计算获得。
1.4 数据处理
采用Origin和SPSS软件进行数据处理和差异显著性分析,所有实验重复3 次。
2 结果与分析
2.1 羰基含量的变化

图1 高白鲑SP氧化后羰基含量的变化Fig. 1 Changes in carbonyl content in SP after oxidation
蛋白质氧化过程复杂并产生更多的氧化产物,羰基的形成是氧化后蛋白质中的一个最显著的变化[25-27]。如图1所示,SP羰基随氧化剂H2O2浓度和氧化时间的增加而增加(P<0.05),在经过20 mmol/L H2O2氧化后,羰基含量与未氧化的羰基含量相比增加了41.28%。在较低浓度氧化剂作用下,氧化时间对SP羰基含量的变化影响显著(P<0.05),在较高浓度氧化剂条件下(20 mmol/L)羰基含量变化趋于平衡。肌肉组织中的氨基酸残基侧链和多肽链均为自由基攻击的对象,氨基酸侧链上的—NH—或者是—NH2被羟自由基氧化,转化成羰基基团[28]。实验中羰基含量的增加可能是由于H2O2中的羟自由基的不断增加,而羟自由基与氨基酸侧链或肽链不断发生氧化反应造成羰基含量的增加。
2.2 总巯基含量的变化
如图2所示,随着H2O2浓度增大和氧化时间的延长,可观察到SP总巯基含量显著减少(P<0.05),氧化剂H2O2(20 mmol/L)氧化5 h后SP总巯基含量减少了65.9%。结果表明总巯基含量对氧化剂浓度和作用时间均敏感。巯基是蛋白质中一个重要的功能基团,具有很高的抗氧化活性,在H2O2存在的条件下极易氧化,形成各种氧化产物,例如—SOH、—SOOH、—SS—,而导致总巯基的减少[13,29-30]。另外有报道称,氧化系统中,蛋白质中的二硫键和非二硫键可以产生交联,是形成蛋白质聚合的主要途径[9,31]。巯基变化结果表明,蛋白氧化使SP巯基基团氧化形成各种氧化产物,并形成蛋白聚合物。

图2 高白鲑SP氧化后总巯基含量的变化Fig. 2 Changes in total sulfhydryl content in SP after oxidation
2.3 游离氨基相对含量变化
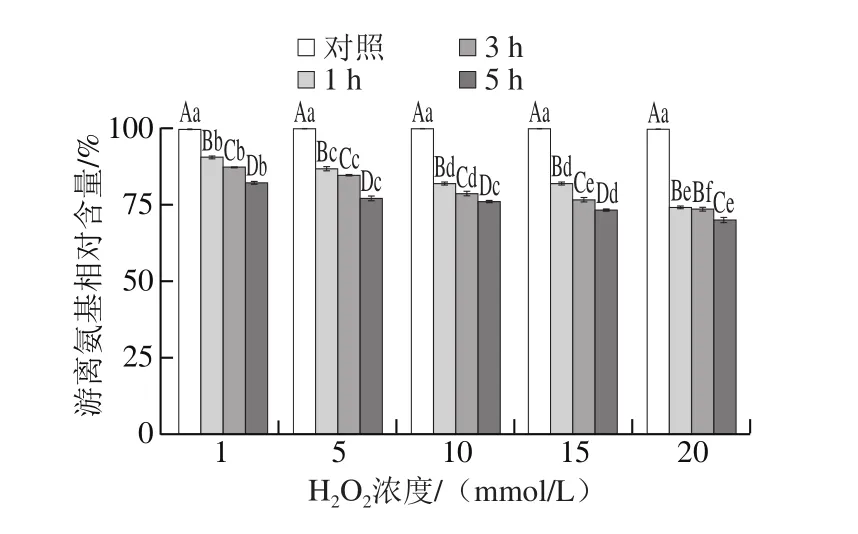
图3 高白鲑SP氧化后游离氨基相对含量的变化Fig. 3 Changes in free amino group content of SP after oxidation
如图3所示,随着H2O2浓度增加和氧化时间延长,游离氨基相对含量减少(P<0.05)。在H2O2浓度达到20 mmol/L和氧化时间达到5 h时,SP游离氨基相对含量显著减少,更长的氧化时间或更高的H2O2浓度,蛋白的游离氨基相对含量趋于减少。结果表明,游离氨基相对含量的降低,可能与蛋白氨基酸侧链中含有—NH—或—NH2的氨基酸参与了羰基的形成有关,这与羰基结果变化趋势相呼应(图1),结果与Morzel等[32]对猪骨胳肌MP氧化后游离氨基的研究结果相似。理论上,活性氧主要的攻击对象是蛋白质中的氨基酸侧链,所有的氨基酸几乎都可以被自由基攻击,但是不同的氨基酸对自由基的敏感程度不同,蛋白中具体哪种氨基酸侧链参与反应,还需进一步研究。
2.4 表面疏水性的变化

图4 高白鲑SP氧化后表面疏水性的变化Fig. 4 Changes in surface hydrophobicity of SP after oxidation
如图4所示,经氧化剂H2O2处理后,SP表面疏水性均增加,与氧化剂浓度和氧化时间呈正相关。与对照组相比,氧化剂H2O2的加入可显著增加SP表面疏水性(P<0.05),随着氧化时间的延长SP表面疏水性增加(P<0.05),与羰基增加趋势相似,结果与Liu Qian等[13]的研究结果相似。蛋白疏水性增加,可能与疏水氨基酸残基暴露密切相关[27],总巯基变化产生的二硫键和非二硫键产生交联,而导致蛋白质内的疏水性基团增加[31]。另外,疏水性增加可能还与蛋白质聚合物的形成会导致蛋白质内的疏水性基团增加有关[27]。
2.5 二聚酪氨酸含量的变化
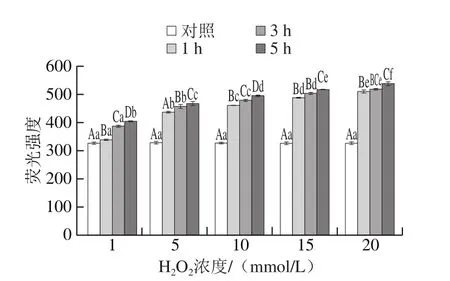
图5 高白鲑SP氧化后二聚酪氨酸含量的影响Fig. 5 Changes in dityrosine content of SP after oxidation
二聚酪氨酸的形成是蛋白在自由基氧化体系中发生氧化的一个重要标记。如图5所示,随着H2O2浓度增加和氧化时间延长,二聚酪氨酸含量明显增加(P<0.05)。在较低浓度氧化剂作用下,氧化时间对SP二聚酪氨酸含量的变化影响显著(P<0.05),在较高浓度氧化剂条件下(20 mmol/L)二聚酪氨酸含量变化趋于平衡。在H2O2浓度达到20 mmol/L和氧化时间达到5 h时,SP二聚酪氨酸含量与未氧化时相比增加了39.5%。结果说明蛋白氧化使蛋白氨基酸侧链发生改变,酪氨酸-酪氨酸交联,形成酪氨酸二聚体。蛋白氧化过程中,二硫键对蛋白质分子的交联起到主要作用,二聚酪氨酸对蛋白质的交联作用并不显著[5]。因此,二聚酪氨酸结果可显示蛋白氨基酸侧链形成交联,是否交联形成蛋白质聚合物需进一步验证。
2.6 Ca2+-ATPase活性的变化
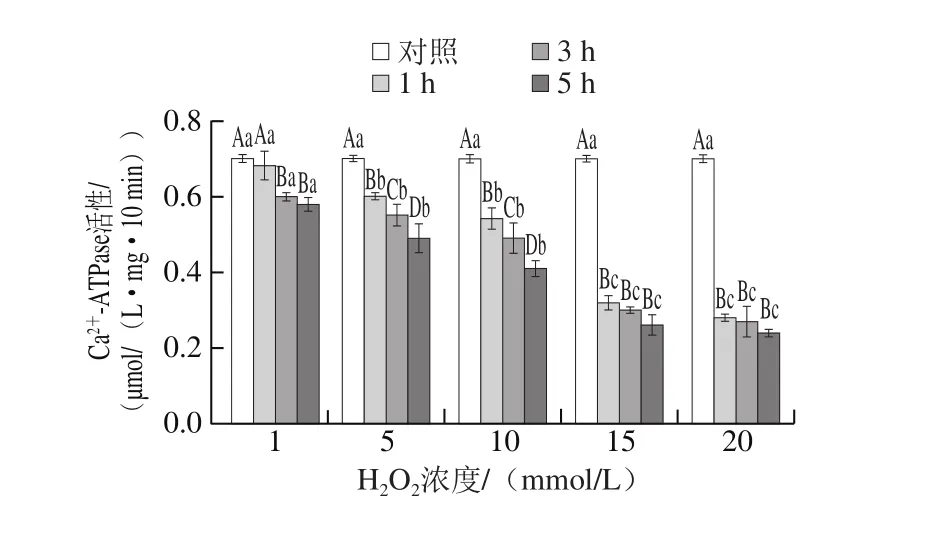
图6 高白鲑SP氧化后对Ca2-ATPase活性的影响Fig. 6 Changes in Ca2+-ATPase activity of SP after oxidation
Ca2+-ATPase活性受SP上端活性中心的活性巯基的影响[33],可用作氧化指数,指示SP结构改变导致的变性[34]。同时,在蛋白氧化过程中,会造成酶活性发生改变,Ca2+-ATPase活性是反映蛋白变性程度的重要指标之一。SP氧化研究显示H2O2的添加可降低蛋白Ca2+-ATPase活性。如图6所示,Ca2+-ATPase活性随氧化剂浓度增加和氧化时间的延长而下降,活性降低明显(P<0.05),在较高浓度水平(15 mmol/L和20 mmol/L)时达到平衡。Wang Baowu等[35]的报道显示新鲜牛肉肌原纤维分离的SP Ca2+-ATPase活性与巯基含量密切相关,但在冻结肌纤维蛋白样品中,它与疏水氨基酸残基暴露密切相关。研究结果表明,SP Ca2+-ATPase活性的降低,与巯基氧化形成二硫键有关[36],造成酶活性中心发生改变,而使Ca2+-ATPase活性下降。
2.7 SDS-PAGE图谱分析
如图7A所示,高白鲑SP氧化后的蛋白质条带发生了明显的变化。SP氧化后,14~25 kDa和70~160 kDa的分子条带变淡,这可能是蛋白氧化使低分子物质发生聚合,而高分子物质发生断裂,出现新的30~70 kDa之间的中间条带。延长氧化时间,SP的新条带逐渐减弱(图7B)。蛋白氧化通过不同机理而形成蛋白交联派生物,包括二硫化物、二聚酪氨酸和羰基的形成,以及肽键断裂,使蛋白质的物理化学性质发生改变[5]。由此可见,由于氧化剂的介入,SP发生聚合,同时肽键断裂,发生蛋白降解,从而改变了蛋白的物化特性。

图7 高白鲑SP经氧化后的SDS-PAGE图谱Fig. 7 SDS-PAGE patterns of C. peled SP after oxidation
3 结 论
在HRGS系统内,可明显地观察到高白鲑SP氧化反应(P<0.05)。结果表明,氧化剂H2O2(1~20 mmol/L),使高白鲑SP的羰基含量、二聚酪氨酸含量、表面疏水性均明显增加(P<0.05),低浓度范围内(1、5 mmol/L和10 mmol/L H2O2),对氧化剂浓度敏感。总巯基含量、游离氨基相对含量和Ca2+-ATPase活性降低(P<0.05),在整个过程中呈浓度依赖型,中高浓度范围内(10、15 mmol/L和20 mmol/L H2O2),对氧化剂浓度敏感。随着氧化时间的延长(1、3 h和5 h),SP的物化指标变化趋势与氧化剂浓度相似,在相同氧化剂浓度下,氧化时间越长(5 h),对氧化时间越敏感。SDS-PAGE测定从分子水平上证实了,蛋白氧化使蛋白聚合和肽键断裂分解。因此,高白鲑贮藏和加工条件尤为重要,防止过程中因外界因素导致肌肉蛋白氧化,从而减轻蛋白氧化对高白鲑肌肉蛋白物化特性的改变。
