不同形貌氧化亚铜的制备及表征
2019-09-25李连庆苏海燕李有红
梁 攀,李连庆,陈 星,邹 芹,苏海燕,李有红
(陕西学前师范学院 化学与化工系,陕西 西安 710100)
随着新世纪的到来,人们对生活的要求不断提高,不仅仅满足于“量”的需求,更追求“质”的变化。而目前我们的生活水平在经济的不断推动下,“量”蒸蒸日上,但是,同样在经济的影响下,“质”却每况日下。每天排放生活污水,工业废水对生活的“质”造成严重的影响。有毒的、有害的、难降解的有机物威胁着人类的生存与发展,牵制着社会的进一步发展,阻挡了人们追求生活上的“质”的提高。网络媒体也经常报道关于有机污染对人类和动物健康的危害。生活中的污水和工业排放中的污水,大都含有有机污染物,而且这些有机污染物按照日常方法很难处理[1]。于是,近些年来,许多专家学者开始着手研究如何能有效的处理这些有机污染源。目前主要采用光催化技术。这种技术能够有效利用太阳降能来降解处理污染物,并且反应条件相对温和,具有高效、稳定、绿色环保等优点,最重要的是可以使催化剂再生和循环利用。另一方面,可以使污染物得到充分的降解,最大成效的使污染物完全降解为CO2、H2O等简单有机物,尤其是对水中的有机污染物有非常好的降解作用,并且不会产生二次污染,其所需设备简单,容易操作[2]。
1 氧化亚铜的介绍
1.1 氧化亚铜的基本性质和应用
截至今日,TiO2在光催化降解应用方面是使用最广泛、最成熟的半导体,TiO2禁带宽度为3.2 eV。但是,TiO2作为光催化剂只能依靠紫外光才能激发出它的活性,也就是太阳光中很短的一段光波,而不能完全高效的利用全波段的太阳能。因此,我们需要寻找一种能够高效利用太阳能的可见光光响应的催化剂[3]。本文按照这样一个思路,对能够在可见光区域响应的氧化亚铜(Cu2O)光催化材料进行了研究。氧化亚铜(Cu2O)是一种直接带隙为2.17 eV的典型p型窄带隙半导体[4],Cu2O在400~600 nm的可见光驱动下就可以进行光催化反应,能够最大限度的利用太阳能[2],正是因为其具有的独特性质才引起了研究者的极大兴趣[1]。它为低价态氧化物,立方体晶体,酸性条件下,发生歧化反应,Cu+→ Cu2+,说明Cu+不稳定,高温、室温、干燥条件下稳定性强,但是在潮湿的环境里,就容易由一价红色Cu2O为二价黑色CuO。Cu2O与水和有机醇互不相溶,但可以溶于酸,生成白色氯化亚铜(CuCl),易溶于NH3·H2O,生成[Cu(NH3)4]2+铜氨离子,为无色配合物,在空气中容易被氧化为二水合铜氨离子[Cu(NH3)4(H2O)2]2+,呈蓝色。Cu2O的颜色是随着颗粒粒径的减小,由红色渐渐变成橙黄色[2]。此外,Cu2O的应用也非常广泛。早期,大约90%的氧化亚铜都应用于船底防污涂料;在农业上用作杀菌剂;生活中使用的有色玻璃也是依靠氧化亚铜进行上色的;有些常用保健品上的发热药剂也是采用氧化亚铜来制备的;在电子行业更是应用广泛,用作半导体材料、电子气敏原件、电池电极等[5]。近年来,在光催化技术方面得到广泛应用。在太阳照射下,催化其活性,降解污染水源,对治理水污染提供了方便。
1.2 氧化亚铜的研究现状
基于Cu2O重要的应用价值及特殊性质,而且Cu2O可以直接利用太阳光作为光源来激发催化剂活性,这使Cu2O在处理环境污染方面成为了新起之秀。为之后的光催化技术研究奠定了基础。近年来,一些学者使用各种不同的方法来合成不同结构形貌的氧化亚铜,如:球形、正方体、雪花状、空心球状、线状、棒状等[1]。在上世纪80年代,人们对于光催化技术已经有了一定程度的了解,在此基础上他们不断寻找新的突破点,要求更好、更快、更高效的方法。近20年的时间,研究过上百种半导体光催化剂,研究何种半导体应用广、性能好、经济且高效。第一种半导体光催化剂TiO2是在1972年首次被发现。TiO2稳定性好、氧化性强、催化性高。是长时间以来最为理想的一种光催化剂。但是TiO2作为光催化剂只能借助紫外光才能激发活性,而紫外光能耗高,不利于大范围的使用,违背了经济的原则[6]。在1998年,有一位学者首次发现了和TiO2性质及其相似的另一种氧化物半导体Cu2O可作为光催化剂。Cu2O刚好弥补了TiO2在实际应用中的缺憾,Cu2O可以利用天然太阳光进行活性催化。在2002年,刘小玲等人[7]利用太阳光,采用自制氧化亚铜进行了光催化降解污染水,实验证明Cu2O作为光催化剂不仅降解效率高而且还可以重复使用。人们在不断的实验证明后,确定了Cu2O的价值。于是开始研究在工艺合成方向我们如何改进,能更有效,更经济、更环保。在合成工艺和原料使用中改进了许多。在2008年时,Masoud 等人[8]将有机醇热法应用于合成氧化亚铜(Cu2O)中,制得了粒径均匀的立方体和球形微晶。魏明真和霍振建[5]在2009年,采用乙醇和水的混合溶液作为溶剂,用无水硫酸铜(CuSO4)与氢氧化钠(NaOH)作为原料,在140℃下,使用溶剂热法处理10 h,合成了棒状氧化亚铜晶体,结晶程度较好,颗粒大小均匀。梁建等[9]将Cu(CH3COO)2溶解于三乙醇胺和乙醇的混合溶液中,在不同的高温密闭容器中反应70 min,得到球形氧化亚铜微米。实验说明了,想要得到球状氧化亚铜晶体,则还原性强的有机醇在反应中所需要的温度低。林健[10]等人以无水Cu(CH3COO)2为原料,C2H5OH作为溶剂,利用溶剂热法合成了100~300 μm的氧化亚铜单晶,实验证明溶剂热法制备得到的氧化亚铜晶体,分散度高、颗粒大、结晶度好,合成方法简单、经济、环保,是制备氧化亚铜的良好途径。孙开莲等[11]采用柠檬酸钠与硫酸铜以1∶1的关系溶于120 mL水中,在密闭反应釜中,高温200℃,12 h,合成了凹二十四面体的六角锥形的氧化亚铜晶体,他们控制保温时间,对特殊形貌进行探究,发现保温时间短时, 形成的今天是八面体,随着温度的上升,晶体形状像被腐蚀一样,最终形成了凹二十四面体的六角锥形。然而Na3C6H5O7在反应中不仅作为还原剂适用,而且可以作为形貌导向剂,控制晶体的形貌。李锋[1]等人采用Cu(CH3COO)2为铜源,Na3C6H5O7为形貌导向剂,乙二醇(EG)和水作为溶剂,采用双溶剂法制备出立方体形状的氧化亚铜(Cu2O)晶体。他们通过合理的控制Cu(CH3COO)2与Na3C6H5O7的物质的量比得到了粒径小且均一的立方体形貌的Cu2O微晶。并且实验表明了Cu2O光催化剂对甲基橙溶液在经过100 min光催化反应后,降解率达到98%。表明了合成的立方体Cu2O微晶具有相当高的催化活性和稳定性。高裕涛等[3]以CuSO4为铜源,C6H12O6为还原剂,调节NaOH的浓度,采用溶液法制备得到二十四面体、正方体和球形微米氧化亚铜,实验证明了:二十四面体对燃料水污染的降解效率高。说明催化剂的催化活性与产物的形状和粒径大小有着密切关系。同样的杨宇婷[4]等人通过向本尼迪特试剂中添加柠檬酸钠,证明了柠檬酸钠在合成球形氧化亚铜的过程中担当了至关重要的角色,它有效的控制了氧化亚铜微晶的成长历程,随着形貌导向剂柠檬酸钠(Na3C6H5O7)的加入,Cu2O晶体颗粒变成大小均一、形状规则的球形。直至目前为止,放眼国内外,氧化亚铜目前的研究现状处在一个过渡期,虽然合成氧化亚铜的方法是司空见惯,但一直存在很大的局限性,比如它的适用范围窄、实验反应条件难以控制、对于晶体的粒径和形貌都不易控制、 重现性差等,很难再工艺技术上得到飞跃性突破[12]。这也是为什么氧化亚铜很难在光电学应用方面得到重视的原因。
1.3 氧化亚铜的制备方法
目前,氧化亚铜(Cu2O)的制备方法众多,可分为固相法、液相法。其中液相法在使用时最为温和,液相法主要包括水热合成法、溶剂热法、微波热解法、溶胶-凝胶法和沉淀法等。本文主要采用双溶剂热合成法。双溶剂热法[9-10,13-14]是目前制备光催化剂半导体常用的方法,也是使用最为广泛的一种合成金属氧化物光催化剂的工艺技术。双溶剂热合成法是在水热合成法和溶剂合成法的基础上进行改进而得来的,它是指在封闭的反应容器中,以有机物和水作为溶剂或两种有机物作为溶剂,在一定的温度和溶液的强大压力下,各种反应物一锅煮,进行反应的一种合成方法。它和水热合成反应的不同之处,在于使用的溶剂不同,水热合成法用水作为溶剂,而双溶剂热法是以有机溶剂和水同时作为溶剂[5]。双溶剂热合成法中,通过把一种或几种反应原料溶解在非水溶剂,在液相条件下,反应物溶解在溶液中并且变的比较活泼,反应发生后,产物缓慢生成。该过程相对简单而且容易控制。在制备半导体光催化剂的实验过程中方便了对晶体粒径和形貌的控制。而且在密闭体系中可以有效的防止有毒物质或刺激性物质的挥发,做到了环保。如今我们需要做的就在以往的合成工艺中取其精华去其糟粕,优化实验方案,达到省时、简单、节约、经济、环保的要求。建立一种简单、高效、形貌可控的合成方法。提高光催化效率,降低光腐蚀。
1.4 本论文的主要研究内容及意义
本文采用双溶剂热法,以无水Cu(CH3COO)2为铜源,Na3C6H5O7为形貌导向剂,在水-乙醇/水-乙二醇为溶剂的体系中,乙醇/乙二醇作为还原剂,加入NaOH调节溶液pH,在密闭的高温反应釜内通过溶剂热法来制备不同形貌的氧化亚铜微晶。本次实验主要内容有:
(1)采用双溶剂热法,通过改变Cu(CH3COO)2和Na3C6H5O7的物质的量比、反应物的加料方式、葡萄糖浓度的变化和NaOH浓度等条件,制备出不同形貌的Cu2O微晶,再结合XRD、SEM等分析手段对Cu2O晶体进行纯度、相组成、形貌和颗粒等方面的表征。
(2)考查通过控制反应原料添加方式、原料的物质的量比、pH值的改变、还原剂葡萄糖浓度的变化等条件,对改变Cu2O微晶的形貌和粒径有何影响,从而找出可以有效控制制备不同形貌和粒径的Cu2O粉末的最佳反应条件,使得Cu2O作为光催化剂能更好、更有效的催化降解染料污水。
2 实验
2.1 药品及仪器
实验的主要药品及仪器,如表1所示。

表1 实验药品及仪器
2.2 氧化亚铜粉末的制备
2.2.1 Cu2O合成流程图

图1 Cu2O合成流程图
2.2.2 Cu2O合成步骤
①使用电子天平称取2.0 g 无水Cu(CH3COO)2,一定量柠檬酸钠(Na3C6H5O7)②用量筒量取25 mL去离子水和30 mL乙二醇(CH2OH)2加入反应釜中,恒温磁力不断搅拌,30 min使其充分溶解,混合均匀,直至出现溶液呈蓝色。③使用电子天平称取一定量NaOH和C6H12O6,配制浓度各不相同的溶液,逐滴加入。以备使用。在HJ-4A型恒温磁力搅拌机下不断搅拌30 min,使其混合均匀。④移至100 mL不锈钢外壳聚四氟乙烯内衬反应釜,密封后放入一定温度下的电热鼓风干燥箱内反应一定时间。⑤冷却后,使用离心管进行离心(TG1650-WS型离心机8000 r/min,每次旋转5 min)。⑥用无水乙醇和去离子水洗涤数次。⑦一定温度下真空干燥,得到产物Cu2O。
3 产品X-射线衍射与电子扫描结果的分析
如图2所示,使用不同原料物质的量比合成的氧化亚铜粉末的x-射线衍射图谱花样图 0.3(a),1.0(b)与如图3所示SEM图像0.3(A),1.0(B)。

图2 原料物质的量比不同 0.3(a),1.0(b)

图3 原料物质的量比0.3(A),1.0(B)
如图2是以Cu(CH3COO)2和Na3C6H5O7为原料,改变Cu(CH3COO)2与Na3C6H5O7的物质的量比0.3(a),1.0(b),在150℃反应釜中加热10 h后,冷却,离心、洗涤,制得的Cu2O粉末的XRD图谱。检测时扫描角度为2θ=20°~80°。图谱显示(110)、(111)、(200)、(220)面衍射峰与PDF#97-003-1057所示Cu2O晶体衍射峰的强度和峰的产生位置一致。本组实验表明,无论Cu(CH3COO)2与Na3C6H5O7物质的量比为0.3图2(a)还是1.0图2(b),都不会影响Cu2O的晶相。由图谱中的衍射峰可以看出,Cu(CH3COO)2与Cu(CH3COO)2物质的量比从0.3增加到1.0 时,Cu2O粉末的结晶度并没有变化。使用SU3500型SEM在10.0 kv下,扫描到的如图3(A)、3(B) 所示,氧化亚铜粉末的形貌图,图3(A)和图3(B)在Na3C6H5O7和Cu(CH3COO)2的物质的量比不同下,产物粒径大小均一,分散性好,平均粒径在5.00 μm左右,产物表面生长不规则,Cu2O粉末形貌属于岩层状。随着Na3C6H5O7和Cu(CH3COO)2的物质的量比增大,产物表面凸出大小不均匀的平台。上述实验证明了Na3C6H5O7和Na3C6H5O7的物质的量比对控制氧化亚铜粒径和形貌有一定的作用。
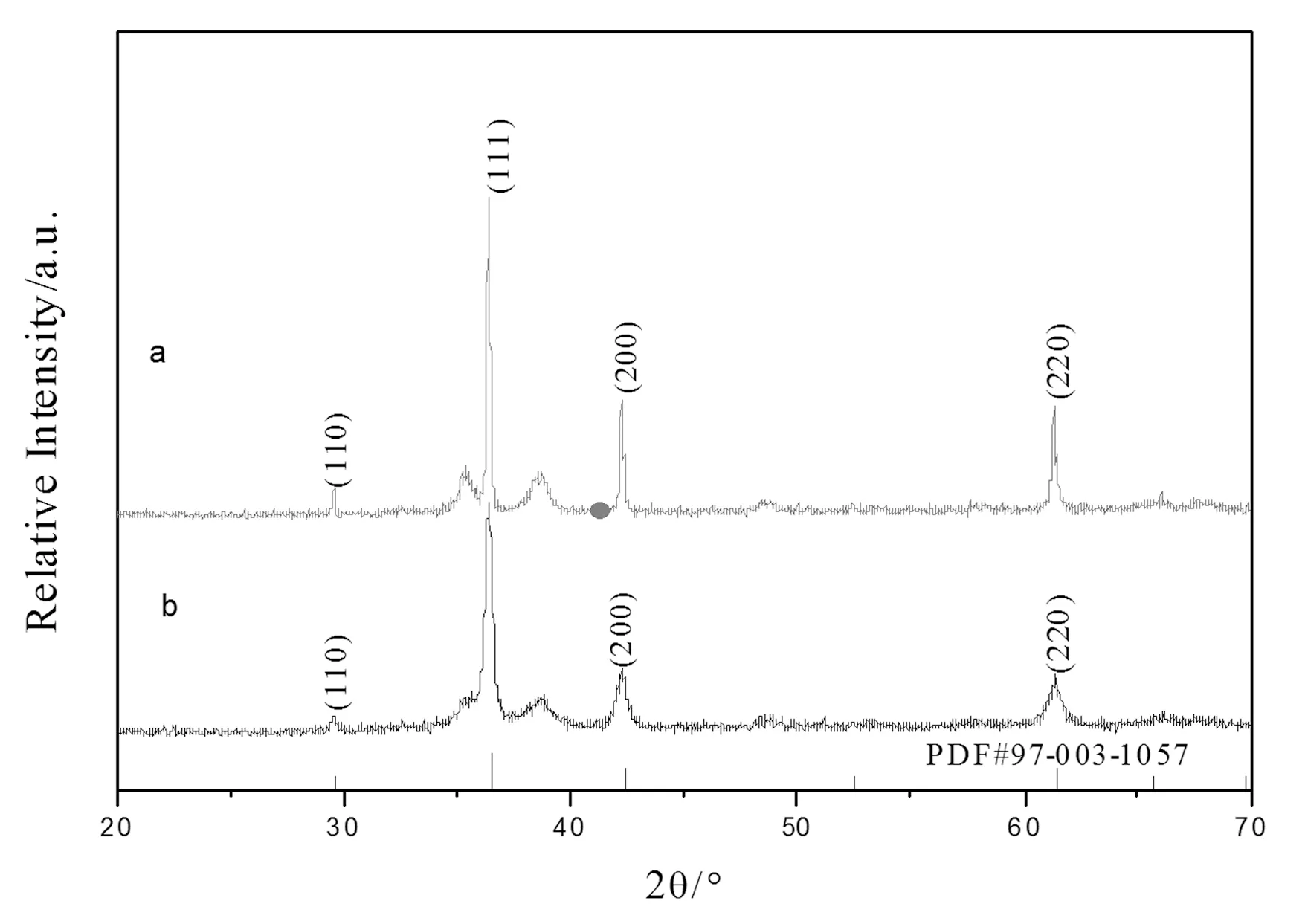
图4 原料添加方式不同

图5 (A),(B)原料添加方式不同
如4图所示,图4(a)与图4(b)衍射峰,是通过两种不同的添加方式而合成的Cu2O晶体,图4(a)添加方式:以氧化铜作为前驱体。① 2.0 g的醋酸铜与1.0 g柠檬酸钠溶于20 mL水+35 mL乙醇中,溶液呈深蓝色,将Cu2+还原为Cu+;②逐滴加入10 mL 1.0 mol/L氢氧化钠溶液。在磁力搅拌30 min后,溶液呈浅蓝色,得到CuO和Cu2O混合物。因此,图4(a)中才会出现(111)面衍射峰旁边的杂峰CuO。从图5(A)中可知,以图4(a)添加原料的方式,制得的氧化亚铜粉末的SEM图呈现的是多孔的不规则桃心型。图4(b)添加方式:以氢氧化铜作为前驱体。①称取2.0 g的醋酸铜倒入反应釜中。②向反应釜中加入10 mL 1.0 mol/L氢氧化钠溶液,搅拌反应得到Cu(OH)2蓝色絮状物。③再加入20 mL水+35 mL乙醇(C2H5OH),进行还原反应 ,得到Cu2O。④最后再称取1.0 g柠檬酸钠作为形貌导向剂。得到产物单一的Cu2O,如图5(B)所示颗粒均匀的毛球状。两种不同的物料添加方式都是在温度为140 ℃下,密闭反应釜中加热10 h后,冷却,离心、洗涤,得到的。从图谱中可以看出,图4(a)中Cu2O的(111)面衍射峰相比图4(b)中(111)面衍射峰窄,尖锐。说明按照图4(a)的添加方式制得的Cu2O颗粒大,平均粒径大约10.0 μm。而图4(b)的添加方式得到的产品副产物少,大都为纯相。

0.4 mol/L(a),0.65 mol/L(b),0.85 mol/L(c),1.0 mol/L(d)
图6 葡萄糖浓度不同

图7 在葡萄糖浓度不同的条件下制备的Cu2O粉末的SEM
如图6所示,按照图6(a)的加料方式,配制不同浓度葡萄糖溶液0.4 mol/L、0.65 mol/L、0.85 mol/L、1.0 mol/L。分别向其中加入10 mL,磁力搅拌30 min,混合均匀,在150℃反应釜中加热12 h后,冷却,离心、洗涤,制得的球形Cu2O粉末的XRD图谱。由图可见,Cu2O粉末衍射峰对比结果显示,随着葡萄糖浓度的增加,Cu2O粉末衍射峰越来越明显,浓度越大,衍射峰值越小。当葡萄糖浓度为0.4 mol/L时,如图7(D)所示,产生的Cu2O颗粒为骷髅状,此时对应XRD衍射峰出现了(110)、(111)、(200)、(220)面衍射峰,同时出现了氧化铜和铜单质的杂峰,只是形成了少量的球形;当浓度为0.65 mol/L时,如图7(C)所示,产物Cu2O颗粒为类球形,颗粒均匀,有少量团聚现象,粒径在3.0 μm~4.00 μm左右;如6(c)XRD图中没有出现Cu和CuO的衍射峰;当浓度为0.85 mol/L时,如图7(B)所示,产物中含有Cu2O颗粒和Cu粒,它们分别呈球形和不规则立方体。同样相对应的XRD衍射图中存在CuO和Cu单质的衍射峰,但明显CuO和Cu单质衍射峰值减弱;浓度达到1.0 mol/L时,如图7(A)所示,得到了球形Cu2O颗粒。图7(A)、(B)、(C)、(D)粒径都为3.0 μm,随着葡萄糖浓度的增大,产品Cu2O颗粒的形貌逐渐变为球形。

图8 氢氧化钠浓度不同

图9 氢氧化钠浓度不同
如图8所示,以Cu(CH3COO)2和柠檬酸钠为原料,30 mL乙二醇+30 mL水为溶剂,乙二醇同时也作为还原剂,通过加入不同浓度2.0 mol/L、4.0 mol/L、4.0 mol/L的氢氧化钠溶液,磁力搅拌30 min,在180 ℃密闭反应釜中加热10 h后,冷却,离心、洗涤,制备不同形貌的Cu2O粉末的XRD图谱。图谱出现了(110)、(111)、(200)、(220)面衍射峰与PDF#97-003-1057所示Cu2O晶体衍射峰的强度和峰的产生位置一致。说明了,这三种样品物相纯度高。随着氢氧化钠浓度的增加pH=5,如图9(A),Cu2O粉末形状为球形。分散性良好,颗粒均匀、完整;当NaOH浓度为4.0 mol/L时,pH值=9,如图9(B),Cu2O粉末形状转变为削棱的正方体,晶面光滑,结晶度高;当浓度为6.0 mol/L时,pH值=11,如图9(C),Cu2O粉末形貌为棒状。氢氧化钠浓度越大,Cu2O的形貌变化越明显。证明了随着氢氧化钠的加入,Cu2O有效的控制了Cu2O不同晶相的生长速率和Cu2O颗粒的形貌,氢氧化钠可以作为形貌导向剂。
4 结论
本文主要研究以Cu(CH3COO)2和Na3C6H5O7为原料,水-乙醇/水-乙二醇为溶剂,通过调节原料之间的物质的量比、加料方式、还原剂葡萄糖浓度、pH值等条件,控制溶液中Cu+的生长方式,从而制备出不同形貌的氧化亚铜晶体。
(1)控制Cu(CH3COO)2和Na3C6H5O7的物质的量比,在物质的量比为0.3、1.0时,对Cu2O晶体形貌的改变有明显影响,随着柠檬酸钠和醋酸铜的物质的量比增大,立方体晶体产物表面凸出大小不均匀的平台。柠檬酸钠作为一种可溶性配位体,引入体系中,与铜Cu2+进行配位,避免Cu(OH)2沉淀和CuO的生成。
(2)控制反应物的加料方式,若以CuO作为前驱体制备得到的Cu2O粉末SEM图为镂空状,以Cu(OH)2为前驱体时,得到的时毛球状的Cu2O颗粒。
(3)随着葡萄浓度的增加,Cu2O粉末衍射峰越来越明显,浓度越大,衍射峰值越小。当葡萄糖浓度为0.4 mol/L时,产生少量球状的Cu2O颗粒;浓度为0.65 mol/L时,产物Cu2O颗粒为类球形,颗粒均匀,有少量团聚;浓度为0.8 mol/L时,纯度不高,分散着球形和不规则立方体;浓度达到1.0 mol/L时,得到了球形Cu2O颗粒。
(4)NaOH浓度不同,随着氢氧化钠的加入,Cu2O粉末形状由球形转变为削棱的正方体,变为了棒状。纯度高、分散均匀。证明了NaOH能有效的控制了Cu2O不同晶相的生长速率和Cu2O颗粒的形貌。
