氧化还原反应中学习能力核心素养探究
2019-09-24陈荣坤
陈荣坤
(江苏省沛县第二中学 221600)
《普通高中化学课程标准(2017年版)》指出“化学是在原子、分子水平上研究物质的组成、结构、性质、转化及其应用的一门基础学科…氧化还原反应从宏观物质到微观原子核外电子的转移或偏移”.同时,学生还需要“识记核心概念,有能力对新反应进行依据氧化还原反应原理进行分析判别;在处理复杂问题时,能够主动的依据氧化还原反应的概念和规律进行系统探究和创造性的应用”.
一、氧化还原反应学习主题学科能力构成模型
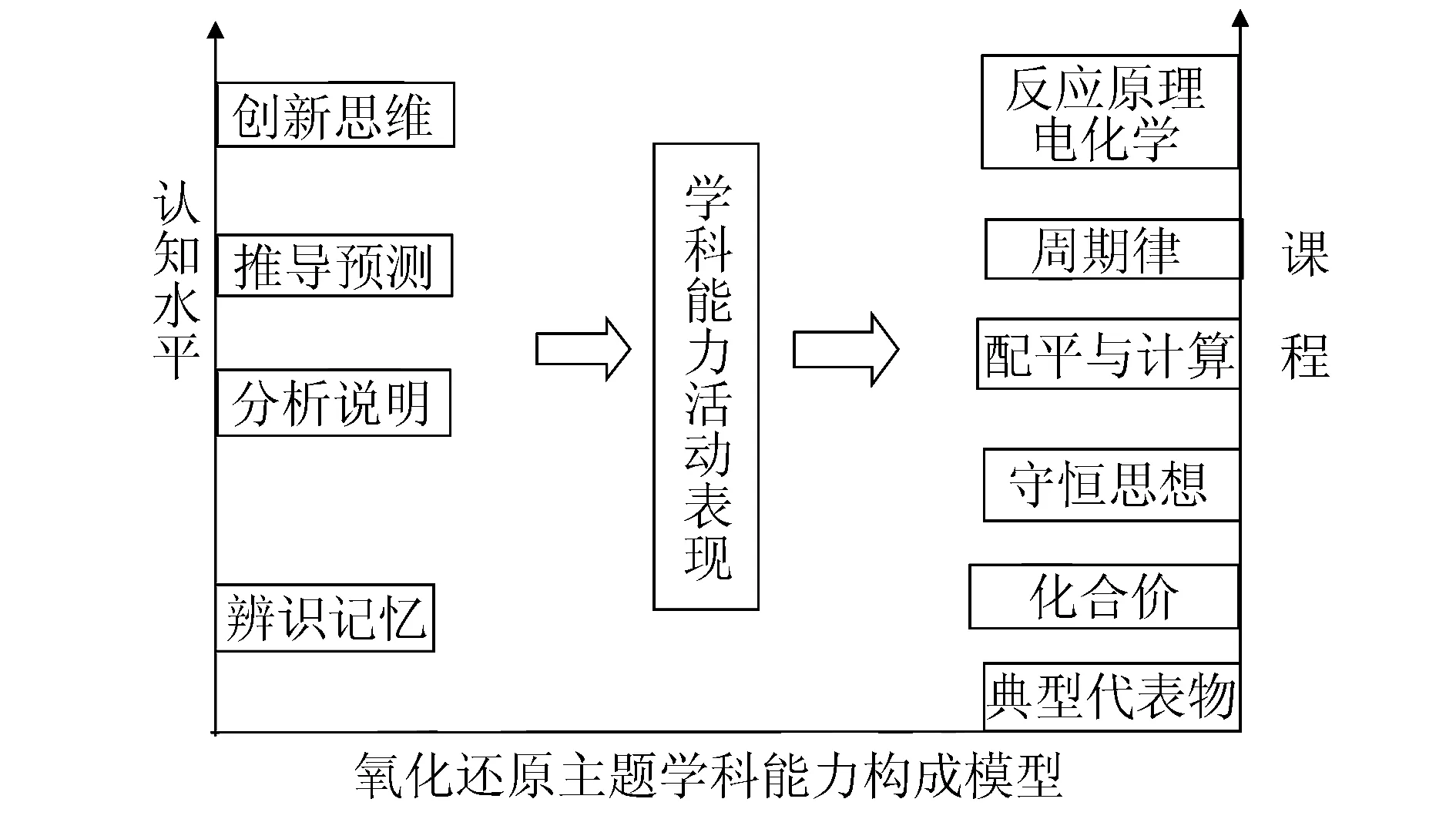
从反应物质的重新组合看,化学反应可分为四个基本反应类型,即化合反应、分解反应、置换反应和复分解反应.而从原子的外围电子的偏移看,化学反应不仅涉及原子的重组,化学键的重新组合,还要涉及分子内部电子分布情形的改变.从这个角度,可以把化学反应分为氧化还原反应和非氧化还原反应,而氧化还原反应是化学反应中最重要的一类.一般来说,涉及氧化还原的问题,多数属于较难以掌握的内容,在题目设置中也表现灵活多样.氧化还原反应学习主题学科能力构成模型如图所示.
二、氧化还原反应知识特点
2018年江苏省高考考试说明明确指出,要理解氧化还原反应的本质,了解氧化还原反应在生产、生活中的应用.氧化还原反应之所以重要,它能从本质上认识化学反应的规律和接触氧化还原反应的本质,即通过得失电子使原子按结合成固定组成的化合物.
学习氧化还原反应要求学生有明确的概念辨识能力,清晰的思考能力.氧化还原反应不仅包含几对对立统一的核心概念,还包含对核心概念的应用和理解,是学生发展核心素养的载体和能力基点.在氧化还原的教学中,存在着几对对称性的概念,第一组为氧化剂、氧化性、被还原、发生还原反应、得到还原产物,另一组概念为还原剂、还原性、被氧化、发生氧化反应、得到氧化产物.
教学中这两组概念容易混淆,比如氧化剂是具有氧化性还是还原性.氧化剂具有氧化性还是还原性,而是要解析氧化剂、氧化性的内涵.氧化剂的源头与氧气有关,氧气在反应中得到电子,容易作氧化剂,所以作氧化剂的物质都会得到电子,而这种作氧化剂的性质就叫做氧化性.从概念出发探究概念的源头明显优于单纯的记忆.
三、氧化还原反应教学分析
氧化还原反应的发展历程从燃素说到拉瓦锡的氧化学说,到现代意义的电子转移和偏移,使人们对氧化还原反应的认识越来越接近科学的本质.教学中,应注重4个方面的问题.
1.核外电子8电子稳定结构
回忆初中的燃烧、铁生锈等有氧气参加的反应进行引入.这些反应不仅有共同的反应物氧气,还有共同的特点,氧气的化合价都发生了同样的改变.而化合价发生改变的本质是原子核外最外层电子数目发生了改变,这种改变的趋势趋于稳定,这个稳定结构就是8电子稳定结构.通过分析也容易让学生接受电子转移或偏移的观点.
2.电子转移的表示方法
双线桥和单线桥两种表示电子转移是了解氧化还原反应本质的途径,通过分析电子转移的方向、数目,学生可以更加直观的理解变价元素的化合价变化,电子的转移或偏移.而掌握电子转移有两点需要注意,其一,氧化还原反应中包含变价元素和不变元素,如果缺乏对变价元素敏锐的认识,就可能从反应式第一个原子标记,导致容易误判.根本原因是对原子化合价认识不清析,特别是原子核外8电子稳定结构理解不透彻.其二,总化合价升降或总得失电子总数目无法分析.不能灵活分析变价元素的原子数目.解决此类问题,多让学生梳理化合价基本概念,树立守恒思想,提高转移电子的判断能力.
3.氧化性、还原性的比较
比较氧化性、还原性属于氧化还原反应基本概念的判断,通过讨论、自学、辨析,让学生体会概念之间的紧密联系 .另外,课本、课外习题,反复强调氧化性、还原性的重要性.随着刻意练习增加,学生慢慢接受概念之间的逻辑关系.
4.电子守恒
利用电子守恒进行计算,题目往往有难度,学生不容易解决.讲解时,首先要了解电子守恒的基本含义:在任何氧化还原反应中不仅要满足基本的质量守恒、原子守恒,还要满足氧化剂得到的电子数与还原剂失去的电子数之间有恒等关系.当反应处于连续反应或者氧化还原反应方程式难以书写时,利用电子守恒的思想很容易使问题得到简化.而同时思维却得到深化和提升.例如2018年高考题中,江苏省高考试题第10题C项.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023.20题第4问NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为____mol.2018年海南省第9题 B.1 mol 甲烷完全燃烧转移的电子数为8NA.
四、氧化还原反应学生学习品质分析
在学生在学习过程中,注意三个方面:
第一,注意概念内部之间的联系:失去电子,电子带负电荷,失去负电荷,化合价升高,作为还原剂.同时还原剂具有还原性,被氧化,发生氧化反应,得到氧化产物.
第二,把上面的知识点进行浓缩,失生还(谐音,师生还,教师学生都人品高尚,喜欢无私奉献,给出电子),降得氧.谐音意义化教学方式是初学者迅速掌握的有效方法.
第三,也是各种版本课本共同的处理方案,在氧化还原反应后续的教学中,不断强化,不断的用课本中重要的方程式巩固氧化还原反应的概念.比如人教版必修化学1第二章介绍完氧化还原反应后,在元素化合物课后习题部分较高频次的出现有关氧化还原的有关问题.其他习题没有直接说出氧化还原问题,但必须用氧化还原的相关的知识才能解决.比如,氧化还原反应方程式、反应原理、实验设计等等.这些知识和习题必需引起学生的重视.
对氧化还原反应知识进行有效性整合,形成有序的知识体系,建构氧化还原反应知识的认知模型.照课堂推进的流程,情景创设.运用最近发展区理论,使学生在已经达到的能力水平和可能达到的能力之间的差异进行突破.教师主动提供已有的知识经验或真实场景能够使无序的思维转变到对某一特定的问题进行思考,从而触发学生的思维升级.
