不同乳酸菌发酵剂对发酵红肠品质的影响
2019-09-23李秀明周伟鲍佳彤刘静静杨华马俪珍
李秀明 周伟 鲍佳彤 刘静静 杨华 马俪珍

摘 要:為研究乳酸菌发酵对红肠品质的影响,将发酵技术应用于本无发酵工艺的红肠制品中,筛选出能够提高红肠品质的乳酸菌发酵剂。分别将常应用于发酵肉制品的7 种商业乳酸菌发酵剂(木糖葡萄球菌+戊糖片球菌(THM-17)、木糖葡萄球菌+清酒乳杆菌+类植物乳杆菌(PRO-MIX5)、木糖葡萄球菌+肉葡萄球菌+清酒乳杆菌(WBL-45)、木糖葡萄球菌+戊糖片球菌+植物乳杆菌(VHI-41)、木糖葡萄球菌+戊糖片球菌+植物乳杆菌(SHI-59)、肉葡萄球菌+木糖葡萄球菌(WBX-43)和戊糖片球菌+木糖葡萄球菌+肉葡萄球菌+乳酸片球菌(VBM-60))及8 种单菌(弯曲乳杆菌、戊糖乳杆菌、清酒乳杆菌-1、戊糖片球菌、木糖葡萄球菌、肉葡萄球菌、清酒乳杆菌-2、植物乳杆菌)以107 CFU/g的接种量接种至腌制后的肉馅中,拌馅灌肠后于35 ℃、80%湿度条件下发酵12 h,取样测定发酵后样品的乳酸菌数和细菌总数,再经干燥、蒸煮、烟熏、烘烤制得成品,测定其感官、pH值、色差、质构、亚硝酸盐、硝酸盐、生物胺及N-亚硝胺含量等指标。结果表明:15 种发酵剂中以木糖葡萄球菌和植物乳杆菌2 种乳酸菌发酵剂应用效果较好,所制得产品pH值分别为5.26和5.04,色泽美观,弹性适中,亚硝酸盐残留量(10.84、10.13 mg/kg)低,可显著抑制N-亚硝胺的形成(N-二甲基亚硝胺含量分别为1.29、
2.51 μg/kg),生物胺总量较低。由此说明,木糖葡萄球菌和植物乳杆菌能够显著提高红肠产品的安全品质。
关键词:乳酸菌发酵剂;红肠;N-亚硝胺
Effects of Different Starter Cultures of Lactic Acid Bacteria on the Quality of Fermented Red Sausage
LI Xiuming1, ZHOU Wei1, BAO Jiatong1, LIU Jingjing1, YANG Hua2, MA Lizhen1,*
(1.College of Food Science and Biotechnology, Tianjin Agricultural University, Tianjin 300384, China;
2.College of Animal Science and Medicine, Tianjin Agricultural University, Tianjin 300384, China)
Abstract: The effect of lactic acid bacteria fermentation on the quality of red sausage was investigated in order to apply it to red sausage, originally produced without fermentation, and different starter cultures were screened for improved sausage quality. Seven common commercial mixed starter cultures, Staphylococcus xylosus + Pediococcus pentosaceus (THM-17), Staphylococcus xylosus + Lactobacillus sake + Lactobacillus plantarum (PRO-MIX5), Staphylococcus xylosus + Staphylococcus carnosus + Lactobacillus sake (WBL-45), Staphylococcus xylosus + Pediococcus pentosaceus +
Lactobacillus plantarum (VHI-41), Staphylococcus xylosus + Pediococcus pentosaceus + Lactobacillus plantarum (SHI-59),
Staphylococcus carnosus + Staphylococcus xylosus (WBX-43), Pediococcus pentosaceus + Staphylococcus xylosus + Staphylococcus carnosus+ Pediococcus acidilactici (VBM-60), and 8 single cultures (Lactobacillus curvatus, Lactobacillus pentosus, Lactobacillus sake-1, Pediococcus pentosaceus, Staphylococcus xylosus, Staphylococcus carnosus, Lactobacillus sake-2, and Lactobacillus plantarum) were inoculated to minced meat at 107 CFU/g and fermented at 35 ℃ and 80% humidity for 12 h. The number of lactic acid bacteria and the total number of bacteria were measured at the end of fermentation. Then the product was dried, steamed, smoked, and baked to determine its sensory quality, pH value, color difference, texture, nitrite, nitrate, biogenic amine, and N-nitrosamine content. The results showed that pure Staphylococcus xylosus and pure Lactobacillus plantarum were better than the other cultures. The prepared products had pH values of 5.26 and 5.04, respectively. The color was good, the elasticity was moderate, and the residual nitrite content (10.84 and 10.13 mg/kg)
was low. The formation of N-nitrosamines was significantly inhibited in the products fermented by the two pure cultures (N-nitrosodimethylamine content was 1.29 and 2.51 μg/kg, respectively), and the total amount of biogenic amine was low. Therefore, Staphylococcus xylosus and Lactobacillus plantarum can significantly improve the safety and quality of red sausage.
Keywords: Lactobacillus starter culture; red sausage; N-nitrosamine
DOI:10.7506/rlyj1001-8123-20190520-110
中圖分类号:TS201.6 文献标志码:A 文章编号:1001-8123(2019)07-0007-07
引文格式:
李秀明, 周伟, 鲍佳彤, 等. 不同乳酸菌发酵剂对发酵红肠品质的影响[J]. 肉类研究, 2019, 33(7): 7-13. DOI:10.7506/rlyj1001-8123-20190520-110. http://www.rlyj.net.cn
LI Xiuming, ZHOU Wei, BAO Jiatong, et al. Effects of different starter cultures of lactic acid bacteria on the quality of fermented red sausage[J]. Meat Research, 2019, 33(7): 7-13. DOI:10.7506/rlyj1001-8123-20190520-110. http://www.rlyj.net.cn
红肠是我国传统肉制品,在制作过程中常会添加亚硝酸盐,且红肠呈微酸性,亚硝酸根离子[1]在这种微酸环境[2]下容易产生N2O3等氮氧化物,肉制品中富含蛋白质,会产生氨基酸、生物胺等胺类物质,二者结合会生成强致癌物N-亚硝胺[3],加热熟制过程更促进了N-亚硝胺的形成[4],从而使得红肠存在一定食用安全隐患。因此,降低红肠中N-亚硝胺形成的前体物亚硝酸盐、胺类物质的含量以及降解N-亚硝胺是目前大多数学者的研究方向[5]。研究表明,乳酸菌(如植物乳杆菌、短乳杆菌等)可降解亚硝酸盐[6-8],且部分乳酸菌(如清酒乳杆菌)能够显著降解生物胺,且含有生物胺的降解基因[9],植物乳杆菌可显著降低泰国发酵香肠中尸胺、腐胺、酪胺和组胺的含量[10];也有研究表明,一些天然植物提取物,如生姜[11]、多香果粉[12]、绿原酸[13]和紫菜薹花色苷[14]等物质能够抑制N-亚硝胺的形成;也有研究发现,一些乳酸菌,如弯曲乳杆菌能够显著降低风干肠中的N-亚硝胺含量[15]。肖亚庆[16]发现,戊糖乳杆菌中位于细胞壁最外层的表层蛋白具有降解N-二甲基亚硝胺(N-nitrosodimethylamine,NDMA)和N-二乙基亚硝胺(N-nitrosodiethylamine,NDEA)的作用,说明不同种类的乳酸菌能够影响食品中N-亚硝胺的形成,且不同种类乳酸菌的作用效果差异较大。
本研究选择7 种常作为肉制品发酵剂的商业复合菌和8 种单菌用于红肠产品的加工中,研究不同乳酸菌发酵剂对红肠产品品质的影响。红肠属于本无发酵工艺的产品,长时间的发酵会破坏其原有风味,也会产生大量的N-亚硝胺前体物胺类物质。基于已有的研究,本研究将15 种乳酸菌发酵剂接种至腌制好的肉馅中,在35 ℃、80%湿度条件下适度发酵12 h后熟制,研究这一发酵过程对红肠成品的感官、pH值、色差、质构、亚硝酸盐、硝酸盐、生物胺及N-亚硝胺含量等指标的影响,以筛选得到能够提高产品安全品质的优势乳酸菌菌株。
1 材料与方法
1.1 材料与试剂
新鲜猪后腿肉、猪肥膘购于天津市康宁肉制品有限公司;淀粉、大蒜、鸡蛋购于天津市红旗农贸市场。所使用的15 种乳酸菌发酵剂如表1所示。
MRS固体培养基 北京索莱宝科技有限公司;乙腈、二氯甲烷(均为色谱纯)、氯化钠、无水硫酸钠、硼酸(均为分析纯)等 天津市风船化学试剂科技有限公司;高氯酸、丙酮、丹磺酰氯(均为分析纯)
国药集团化学试剂有限公司;8 种生物胺(色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、精胺及亚精胺)标品和9 种N-亚硝胺(NDMA、NDEA、N-甲基乙基亚硝胺(N-nitrosomethylethylamine,NMEA)、
N-二丁基亚硝胺(N-nitrosodibutylamide,NDBA)、
N-二丙基亚硝胺(N-nitrosodipropylamine,NDPA)、N-亚硝基哌啶(N-nitrosopiperidine,NPIP)、N-亚硝基吡咯烷(N-nitrosopyrrolidine,NPYR)、N-亚硝基吗啉(N-nitrosomorpholine,NMOR)及N-亚硝基二苯胺
(N-nitrosodiphenylamine,NDPheA))标品 美国Sigma公司。
1.2 仪器与设备
7890A气相色谱仪(配备氮磷检测器)、1200高效液相色谱仪(配备紫外吸收检测器) 美国安捷伦公司;P/ACE MDQ毛细管电泳仪(配备紫外检测器) 美国贝克曼库尔特公司;PB-10酸度计 德国賽多利斯科学仪器有限公司;VXMNAL漩涡振荡器 美国奥豪斯公司;
CM-5色差仪 日本柯尼卡-美能达公司;TA-XT plus质构仪 英国Stable Micro Systems公司;RE-2000A旋转蒸发仪 上海亚荣生化仪器厂;DW-5120低温泵
上海振捷实验设备有限公司;ZXSD-B1090恒温培养箱
上海博讯仪器设备有限公司;BJRJ-82绞肉机、
BVBJ-30F真空搅拌机、BYXX-50烟熏炉 浙江嘉兴艾博实业有限公司。
1.3 方法
1.3.1 实验方案及红肠加工工艺
各组红肠所用原材料及制作工艺均为:
1)腌制:猪后腿肉600 g、料酒15 g、食盐21 g、葡萄糖3 g、白糖3 g、复合磷酸盐3 g、抗坏血酸钠0.412 5 g、亚硝酸钠0.112 5 g(以猪后腿肉和肥膘总质量为基准,添加量为0.15 g/kg)、水30 mL,将上述材料搅拌均匀,置于4 ℃冰箱中腌制20 h;
2)拌馅灌肠:向腌好的肉中加入肥膘丁150 g、淀粉60 g、蒜泥15 g、白胡椒粉1.8 g、鸡蛋60 g、冰水120 g,用真空搅拌机充分拌匀后灌肠(实验组分别将表1的15 种乳酸菌发酵剂以107 CFU/g的接种量接种至拌好的肉馅中,空白对照(CK)组不接菌);
3)发酵:将灌好的实验组红肠置于35 ℃、80%湿度条件下发酵12 h,取样测定乳酸菌数和细菌总数(CK组不发酵);
4)熟制:将发酵后的实验组和CK组红肠于烟熏炉中熟制,熟制参数为:干燥:70 ℃、60 min;烟熏:85 ℃、60 min;蒸煮:85 ℃、60 min;烘烤:75 ℃、60 min。取样测定成品的感官、pH值、弹性、红度值(a*)、亚硝酸盐、8 种生物胺和9 种N-亚硝胺含量。
1.3.2 指标测定
1.3.2.1 感官评定
由于组别较多,因此选择10 位感官评定人员,通过对16 组红肠成品进行品评,选出6 个口感相对较好、接受度较高的组别,再对这6 个组别以表2的标准进行具体评分。
1.3.2.2 乳酸菌数测定
参照GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》[17]对发酵不同时间后、熟制前的样品进行测定。
1.3.2.3 细菌总数测定
参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[18]对发酵不同时间后、熟制前的样品进行测定。
1.3.2.4 pH值测定
参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》[19]进行测定。
1.3.2.5 色差测定
将红肠中的白色肥膘剔除,剩余部分剁碎,于色差仪中测定。
1.3.2.6 弹性测定
将红肠切成1 cm见方的小正方体,使用质构仪的P35探头测定弹性,具体测定参数为:测前速率1 mm/s,测中速率1 mm/s,测后速率1 mm/s,位移距离5 mm,位移时间5 s,触发力5 g。
1.3.2.7 硝酸盐和亚硝酸盐含量测定
参照李秀明等[20]的毛细管电泳法同时测定硝酸盐和亚硝酸盐含量。
1.3.2.8 生物胺含量测定
参照GB 5009.208—2016《食品安全国家标准 食品中生物胺的测定》[21]测定样品中的8 种生物胺含量。
1.3.2.9 N-亚硝胺含量测定
参照GB 5009.26—2016《食品安全国家标准 食品中N-亚硝胺类化合物的测定》[22]对样品中的亚硝胺进行提取、萃取净化、浓缩后过0.45 μm滤膜,用气相色谱仪分析定量9 种N-亚硝胺。
1.4 数据处理
用Microsoft Excel 2010软件计算平均值和标准偏差,用Statistix 8.1软件进行显著性分析,Sigma Plot 10.0软件作图。
2 结果与分析
2.1 16 组红肠的感官评价
从16 组红肠中筛选得到口感相对较好的组别为5、6、7、9、11和CK组,其他各组红肠口感偏酸,异味感较重,对于本无发酵工艺的红肠来说,发酵对产品风味影响较为严重,降低了品评者对产品的接受度。
对于筛选得到的6 组红肠进行感官评价,由表3可知,6 组红肠的感官接受度由大到小依次为7组>CK组>5组>9组>11组>6组。其中,第7组红肠的感官接受度高于CK组,这说明虽然发酵会产生大量乳酸,给红肠带来异味感,使得红肠口感不佳,但经过乳酸菌适度发酵也会产生一些特殊的风味物质,提升产品的接受度。例如,唐明礼等[23]研究表明,戊糖片球菌和肠膜明串珠菌的混合发酵剂能够增加挥发性风味物质;周慧敏等[24]研究表明,木糖葡萄球菌和肉葡萄球菌的混合发酵剂能够促进腊肠色泽和风味的形成;韩江雪等[25]研究得到,使用乳酸片球菌能够提升发酵辣椒的风味品质。第7组乳酸菌发酵剂的组成为戊糖片球菌、木糖葡萄球菌、肉葡萄球菌及乳酸片球菌,可能是由于这4 种乳酸菌混合发酵后产生了一些能够提升风味的物质,使得该组红肠的感官接受度高于CK组。
2.2 15 组红肠发酵12 h的乳酸菌数和细菌总数
乳酸菌是一类产大量乳酸的无芽孢、革兰氏阳性的细菌统称[26]。细菌总数所检测的主要为食品被细菌污染的情况,包含可以在琼脂中生长繁殖、嗜中温的需氧和兼性厌氧细菌,因此所测得的细菌总数中也包含一定量的乳酸菌。
由图1~2可知,15 组发酵红肠中,第2、3、6、9组红肠的乳酸菌数显著低于其他各发酵组(P<0.05),分别为6.80、6.60、7.34、6.92 (lg(CFU/g)),说明这4 组乳酸菌发酵剂的菌活力较差或在这一混合肉体系中不适宜生长。第9组红肠中乳酸菌含量虽低,但细菌总数却显著高于其他各个发酵组(P<0.05),达
9.26 (lg(CFU/g)),分析其原因可能是该组发酵剂乳酸菌活力较低,未形成栅栏效应,使得发酵过程中其他杂菌大量生长繁殖。第7组发酵红肠的乳酸菌数显著高于其他各组,达9.89 (lg(CFU/g)),细菌总数为7.93 (lg(CFU/g)),说明该组乳酸菌发酵剂菌活力强,显著抑制了一些腐败杂菌的生长,这也是该组发酵红肠感官品质较好的主要原因,乳酸菌的大量生长提高了产品的风味和色泽,充分发挥了乳酸菌的优势。
大写字母不同,表示不同处理组间差异显著(P<0.05)。图2~7同。
2.3 16 组红肠的pH值
由图3可知,由于各组红肠接种的乳酸菌发酵剂不同,终端产品表现出不同的pH值。第2、3、6、9组的pH值显著高于其他各个发酵组(P<0.05),其中第2、3组的pH值与CK组差异不显著(P>0.05),这是由于第2、3组的乳酸菌数量较低(6.80、6.60 (lg(CFU/g)),说明2 组乳酸菌发酵剂的菌活力弱,不适宜在肉体系中生长,产酸量少。其余各组红肠的pH值均在5.00~5.66之间,表明这几组乳酸菌发酵剂均适宜在肉混合体系中生长。
2.4 16 组红肠的a*
由图4可知,经过乳酸菌发酵后,15 组发酵红肠的a*显著高于CK组(P<0.05)。有研究表明,微生物发酵,如植物乳杆菌、乳酸片球菌等能够将高铁肌红蛋白转化为亚硝基肌红蛋白,从而起到提高肉制品a*的作用[27]。虽然第3、6、9组红肠的a*显著高于CK组
(P<0.05),但却显著低于其他各发酵组,结合2.2、2.3节各指标的变化结果可以说明,这3 组乳酸菌活力较低,转化高铁肌红蛋白的能力不足。
2.5 16 组红肠的弹性
由图5可知,15 个实验组与CK组产品的弹性均无显著差异(P>0.05),说明所添加的15 种乳酸菌发酵剂发酵12 h对红肠产品的弹性并没有产生显著影响。
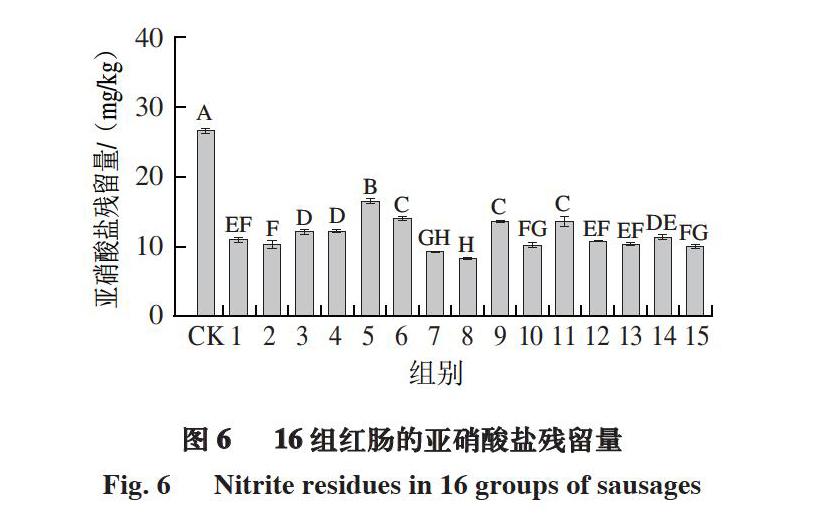
2.6 16 组红肠的亚硝酸盐残留量
由图6可知,红肠经15 种乳酸菌发酵剂发酵后,亚硝酸盐残留量显著降低(P<0.05),其中第7组和第8组的亚硝酸盐残留量分别为9.33、8.37 mg/kg,显著低于其他各发酵组,且这2 组的乳酸菌数也显著高于其他各组,而第7组的乳酸菌数显著高于第8组,但2 组的亚硝酸盐残留量差异不显著(P>0.05),这可能与2 种乳酸菌发酵剂的产酸能力和亚硝酸盐还原酶活性有关[28-29]。相反,第5组红肠的亚硝酸盐残留量则显著高于其他各发酵组,但该组乳酸菌数为8.31 (lg(CFU/g)),数量相对较多,产乳酸量相比其他组也相对较多,pH值为5.66,该组乳酸菌发酵剂降解亚硝酸盐效果不佳的原因可能是产亚硝酸盐还原酶能力较差。实验结果表明,对降解亚硝酸盐起主要作用的是亚硝酸盐还原酶,其次是酸降解。
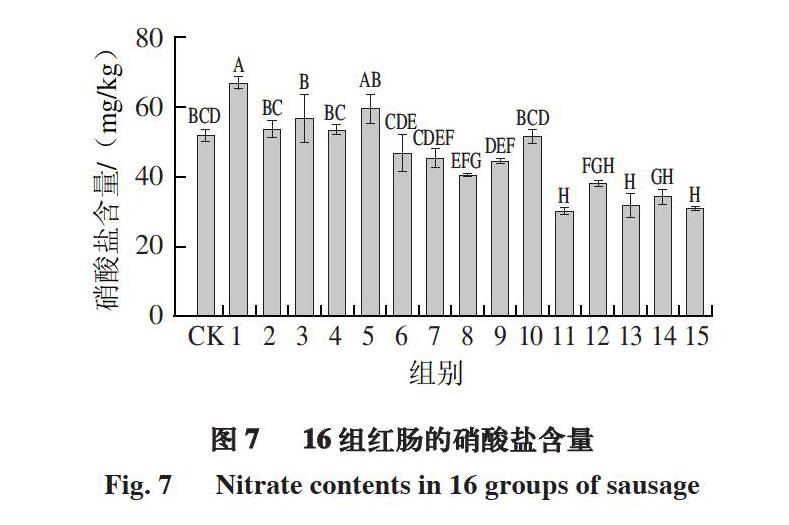
2.7 16 组红肠的硝酸盐残留量
硝酸盐虽然并不能直接对人体产生危害,但是在一些硝酸盐还原菌的作用下,会转化为亚硝酸盐而带来毒性,这些菌可能存在于口腔[30]、胃液或来源于产品贮藏过程中外界的污染。
由图7可知,第1组红肠的硝酸盐含量显著高于CK组,第8、11、12、13、14、15组乳酸菌发酵剂均能够不同程度地降低发酵红肠中的硝酸盐含量,而其余各组红肠的硝酸盐含量则与CK组差异不显著(P>0.05)。
2.8 16 组红肠的生物胺含量
在发酵肉制品制作过程中,适宜的溫度会使乳酸菌等微生物大量生长,更容易产生氨基酸脱羧酶,使生物胺含量增加。由表4可知,16 组红肠中均未检出色胺,且经15 种乳酸菌发酵剂发酵后,除第9组红肠组胺含量为131.08 mg/kg,显著高于CK组(30.58 mg/kg)以及第10组苯乙胺含量为107.01 mg/kg,显著高于CK组(74.42 mg/kg)外,其他各发酵组均未检出组胺和苯乙胺。第2、8、11、12组红肠经乳酸菌发酵后,均产生了CK组中未检出的亚精胺,含量为27.46~31.13 mg/kg,而亚精胺作为脂肪族生物胺,对生物活性有着重要作用,且目前对其并没有限量标准。
经乳酸菌发酵后,红肠中的腐胺、尸胺和酪胺含量均有所增长,但经部分乳酸菌发酵剂发酵后,如第1、8组腐胺含量分别为138.84、134.32 mg/kg,显著低于CK组(168.76 mg/kg)(P<0.05);第14、15组尸胺含量分别为53.76、57.81 mg/kg,与CK组(42.18 mg/kg)差异不显著(P>0.05);第1、13、14、15组精胺含量分别为89.82、97.52、109.18、96.39 mg/kg,显著低于CK组(128.12 mg/kg)(P<0.05)。部分生物胺含量降低的原因可能是由于接种发酵剂之后,在发酵过程中成为产品中的主要优势菌,抑制了其他脱羧酶活性较强的腐败微生物的生长,而发酵菌种本身脱羧酶活性低是筛选菌种的标准之一[31-32];此外,接种的乳酸菌能产生生物胺氧化酶,如一元胺氧化酶和二元胺氧化酶,能够将一些胺类物质氧化脱氨,产生醛、氢和氨[33];再者,乳酸菌发酵使pH值迅速降低也能起到抑制生物胺形成的作用,以上三方面的原因导致部分红肠中某些生物胺含量低于CK组。
2.9 16 组红肠的N-亚硝胺含量
由表5可知,接种乳酸菌发酵剂经12 h适度发酵后,第4、9、12、15组发酵红肠中9 种N-亚硝胺的总量显著低于CK组(34.85 μg/kg)(P<0.05),其中第12组和第15组的总含量(19.68、17.96 μg/kg)又显著低于第4组和第9组,抑制9 种N-亚硝胺总生成量的效果最佳。对于国标中有限定标准的NDMA(3 μg/kg),第6(1.43 μg/kg)、7(1.99 μg/kg)、12(1.29 μg/kg)、15(2.51 μg/kg)组相比于CK组(4.46 μg/kg)显著抑制了NDMA的形成;且15 个发酵组对NDEA均起到了抑制效果。对于NPYR,除第1、5、6、14组外,其他各发酵组均能够显著降低其生成量。但本研究所使用的15 种发酵剂对NMEA、NDBA、NMOR抑制效果不佳,仅第14组和第1组分别显著抑制了NDBA和NMOR的形成,且部分组别,如第1、2、3、11、14组产生了CK组未检出的NDPheA。
3 讨 论
综合以上各项指标分析结果,本研究所应用的15 种乳酸菌发酵剂中SX(木糖葡萄球菌)和LP(植物乳杆菌)2 种发酵剂能够显著降低9 种N-亚硝胺的总量至19.68、17.96 μg/kg,抑制NDMA形成效果显著;且2 种发酵剂促进了红肠的发色,对红肠的弹性影响不显著,能够显著降低亚硝酸盐残留量。其中接种LP显著促进了酪胺的形成,但可降低8 种生物胺的总含量至431.08 mg/kg,
显著低于CK组;与之不同的是,接种SX显著促进生物胺,如尸胺、酪胺、亚精胺的形成,其中尸胺和亚精胺是细胞的重要组成成分,酪胺则具有抗氧化的作用,生物胺对人体生长代谢等均有重要作用,亦是蛋白质、核苷酸等物质合成的前体[34],摄入含有适量生物胺的食物有益于身体健康,且目前并未对发酵肉制品中的生物胺制定限量标准。因此,使用LP和SX 2 种发酵剂可以提高红肠的安全品质,且不影响发酵红肠的色泽和质地。感官评价结果表明,这2 组发酵红肠接受度不高,这是由于消费者已经习惯于无发酵酸味的红肠,经12 h发酵后,这2 组红肠的pH值分别降至5.26和5.04,会使口感略偏酸,且有一定的发酵味,因此若使用发酵技术提升产品安全品质,还需一定的消费引导,或者依据此研究基础探究乳酸菌抑制N-亚硝胺的机理,制作一种直投式微生物亚硝化抑制剂,实现不影响产品口感的同时亦能提高产品的安全性。
4 结 论
使用LP和SX 2 种发酵剂接种至拌好的肉馅中,灌肠后经35 ℃适度发酵12 h,经熟制得到的成品红肠pH值分别为5.26和5.04,发色良好,产品弹性与CK组无显著差异,亚硝酸盐残留量(分别为10.84、10.13 mg/kg)显著低于CK组,硝酸盐含量分别为38.27、52.09 mg/kg,LP显著降低产品中8 种生物胺总量至431.08 mg/kg。
2 种发酵剂对N-亚硝胺抑制效果良好,NDMA含量分别为1.29、2.51 μg/kg,显著低于CK组,显著抑制9 种N-亚硝胺的形成,9 种N-亚硝胺总量分别为19.68、17.96 μg/kg,相对于其他发酵组较好地提高了红肠的产品品质。本研究将发酵技术和红肠的传统加工工艺有机结合,将发酵技术引入红肠中,不仅提高了其安全品质,也为后期进一步利用发酵技术提高产品安全品质提供了理论指导。
参考文献:
[1] SANNINO A, BOLZONI L. GC/CI-MS/MS method for the identification and quantification of volatile N-nitrosamines in meatproducts[J]. Food Chemistry, 2013, 141(4): 3925-3930. DOI:10.1016/j.foodchem.2013.06.070.
[2] SEN N P, SEAMAN S W, BADDOO P A, et al. Formation of N-nitroso-N-methylurea in various samples of smoked/dried fish, fish sauce, seafood, and ethnic fermented/pickled vegetables following incubation with nitrite under acidic conditions[J]. Journal of Agricultural and Food Chemistry, 2001, 49(4): 2096-2103. DOI:10.1021/jf0011384.
[3] 劉永东, 闾春林, 王云海, 等. 强致癌性N-亚硝胺形成机理及过氧亚硝酸根毒性机理的研究[C]//第3届国际理论化学、分子模拟和生命科学研讨会暨第3届北京宏剑公司用户大会论文集. 北京: 北京工业大学, 2010: 520.
[4] LI Ling, WANG Peng, XU Xinglian, et al. Influence of various cooking methods on the concentrations of volatile N-nitrosamines and biogenic amines in dry-cured sausages[J]. Journal of Food Science, 2012, 77(5): 560-565. DOI:10.1111/j.1750-3841.2012.02667.x.
[5] 李木子. 微生物发酵技术降低风干肠中亚硝胺的研究[D]. 哈尔滨: 东北农业大学, 2015: 6-8.
[6] 赵慧娟, 许梓文. 乳酸菌降解亚硝酸盐条件的优化[J].
安徽农业科学, 2018, 46(17): 176-178. DOI:10.3969/j.issn.0517-6611.2018.17.053.
[7] 贺莉莉. 乳酸菌的筛选、复配及其对腌制草鱼中亚硝酸盐的降解研究[D]. 无锡: 江南大学, 2018: 1-18.
[8] XIA Yongjun, LIU Xiaofeng, WANG Guangqiang, et al. Characterization and selection of Lactobacillus brevis starter fornitrite degradation of chinesepickle[J]. Food Control, 2017, 78: 126-131. DOI:10.1016/j.foodcont.2017.02.046.
[9] 许女, 李田田, 贾瑞娟, 等. 降解亚硝酸盐和生物胺乳杆菌筛选及其改善鱼肉香肠品质效果[J]. 农业工程学报, 2018, 34(15): 304-312. DOI:10.11975/j.issn.1002-6819.2018.15.038.
[10] TOSUKHOWONG A, VISESSANGUAN W, PUMPUANG L, et al. Biogenic amine formation in Nham, a Thai fermented sausage, and the reduction by commercial starter culture, Lactobacillus plantarum BCC 9546[J]. Food Chemistry, 2011, 129(3): 846-853. DOI:10.1016/j.foodchem.2011.05.033.
[11] 杜华英, 吴琴, 胡敏, 等. 生姜抑制亚硝化反应有效成分的提取工艺研究[J]. 食品工业, 2019, 40(1): 60-63.
[12] 朱倩颖, 王宗义, 高哲, 等. 多香果粉对肉丸中N-亚硝胺的抑制作用[J]. 食品工业科技, 2017, 38(20): 62-67. DOI:10.13386/j.issn1002-0306.2017.20.012.
[13] 李玲, 季慧, 段家玉. 绿原酸抑制猪肉肌原纤维蛋白氧化及NDEA生成的作用研究[J]. 食品工业科技, 2018, 39(8): 29-33. DOI:10.13386/j.issn1002-0306.2018.08.006.
[14] 邓莉, 何静仁. 紫菜薹花色苷对内源性N-亚硝胺合成的抑制作用[J]. 食品科技, 2018, 43(5): 298-301. DOI:10.13684/j.cnki.spkj.2018.05.054.
[15] 李木子, 孔保华, 黄莉, 等. 弯曲乳杆菌对风干肠发酵过程亚硝胺降解及其理化性质的影响[J]. 中国食品学报, 2016, 16(3): 95-102. DOI:10.16429/j.1009-7848.2016.03.013.
[16] 肖亚庆. 戊糖乳杆菌降N-亚硝胺及其在香肠发酵中的应用研究[D]. 合肥: 合肥工业大学, 2018: 23-28.
[17] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品微生物学检验 乳酸菌检验:
GB 4789.35—2016[S]. 北京: 中国标准出版社, 2016.
[18] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品微生物学检验 菌落总数测定: GB 4789.2—2016[S]. 北京: 中国标准出版社, 2016.
[19] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品pH值的测定: GB 5009.237—2016[S]. 北京: 中国标准出版社: 2016.
[20] 李秀明, 马俪珍. HPCE法同时检测果蔬及肉制品中硝酸盐和亚硝酸盐含量[J]. 食品科学, 2018, 39(12): 301-307. DOI:10.7506/spkx1002-6630-201812046.
[21] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中生物胺的测定:
GB 5009.208—2016[S]. 北京: 中国标准出版社: 2016.
[22] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中N-亚硝胺类化合物的测定: GB 5009.26—2016[S]. 北京: 中国标准出版社, 2016.
[23] 唐明礼, 王勃, 刘贺, 等. 發酵剂发酵、自然发酵与未发酵黑米煎饼的风味物质分析[J]. 食品与发酵工业, 2015, 41(6): 190-195. DOI:10.13995/j.cnki.11-1802/ts.201506036.
[24] 周慧敏, 张顺亮, 赵冰, 等. 木糖葡萄球菌和肉葡萄球菌混合发酵剂对腊肉品质的影响[J]. 食品科学, 2018, 39(22): 32-38. DOI:10.7506/spkx1002-6630-201822006.
[25] 韩江雪, 丁筑红, 李仲军, 等. 不同乳酸菌强化接种发酵辣椒挥发性风味成分分析[J]. 食品科学, 2012, 33(10): 179-183.
[26] 李帥. 乳酸菌的益生功能及其在畜牧生产中的应用[J]. 农村经济与科技, 2017, 28(4): 36. DOI:10.3969/j.issn.1007-7103.2017.04.027.
[27] 刘英丽, 毛慧佳, 李福芳, 等. 微生物发酵法在肉制品护色中的
应用[J]. 中国食品学报, 2017, 17(9): 182-188. DOI:10.16429/j.1009-7848.2017.09.023.
[28] YU Shaowei, ZHANG Ying. Effects of lactic acid bacteria on nitrite degradation during pickle fermentation[J]. Advanced Materials Research, 2013, 781/784: 1656-1660. DOI:10.4028/www. scienti?c.net/AMR.781-784.1656.
[29] MAIA L B, MOURA J J G. Nitrite reduction by xanthine oxidase family enzymes: a new class of nitrite reductases[J]. Journal of Biological Inorganic Chemistry, 2011, 16(3): 443-460. DOI:10.1007/s00775-010-0741-z.
[30] 夏登胜, 刘颖, 张春梅, 等. 酸化的硝酸盐、亚硝酸盐对口腔主要致病菌生长影响的体外研究[C]//中华口腔医学会口腔颌面外科专业委员会涎腺疾病学组第3次全国涎腺疾病学术会议论文汇编. 北京: 中华口腔医学会口腔颌面外科专业委员会, 2006: 114-115.
[31] CLAUDIA RUIZ-CAPILLAS D R, JIEMENZ-COLMENERO F.
Biogenic amines in meat and meat products[J]. Critical Reviews in Food Science and Nutrition, 2004, 44(7/8): 489-499. DOI:10.1080/10408690490489341.
[32] 朱志远, 徐幸莲, 李虹敏, 等. 不同发酵剂对发酵香肠生物胺含量的影响[J]. 食品与发酵工业, 2009, 35(8): 133-137.
[33] 卢士玲, 李开雄. 影响干制发酵香肠中生物胺积累的因素[J]. 西北农业学报, 2005(3): 153-158. DOI:10.7606/j.issn.1004-1389.2005.3.039.
[34] BROADLEY K J. The vascular effects of trace amines and amphetamines[J]. Pharmacology and Therapeutics, 2010, 125(3):
363-375. DOI:10.1016/j.pharmthera.2009.11.005.
