柔性有机硅疏水涂层的制备及其抑菌活性
2019-09-18沈启慧单驿轩连朋亮刘岩于东冬周建光
沈启慧,单驿轩,连朋亮,刘岩,于东冬,周建光
(1.吉林化工学院化学与制药工程学院,吉林吉林,132022;2.浙江大学医院,浙江杭州,310027;3.浙江大学控制科学与工程学院工业控制技术国家重点实验室,浙江杭州,310058)
在日常生活与工作中,人们时刻都在接触很多致病微生物如大肠杆菌、双歧杆菌、金黄色葡萄球菌[1-4]。研发具有抑菌和抗菌活性的材料,可以降低疾病危害,营造健康的生活环境[5]。随着抗生素、消毒剂和杀菌剂的滥用,耐药性变异的微生物种群随之增多,细菌的耐药性逐渐发展为一个全球性问题[6],新型抗菌材料的研发和应用成为防止微生物危机发生的重要内容[7]。无机抗菌材料具有抑菌持久性好和不易产生抗药性等优点[8-9],尤其是纳米银及其复合材料具有低毒性、抗菌活性强、抗菌谱广等优点,在医疗和保健领域有广阔的应用前景[10-12],从而使得其相关纳米材料的开发和应用成为目前纳米发展战略的主要内容之一。有机硅材料具备无机与有机材料性能,具有耐高温、电气绝缘、无毒无味、化学惰性等特点,被广泛地应用于航空航天、化工、电子电气、纺织、食品、医疗等领域,尤其在医疗器械上如医用导管、人工器官及组织替代品、可移植的高密度微电极阵列[13-14]等得到应用。对有机硅表面进行功能性修饰成为该领域的研究热点。本文作者介绍一种对有机硅表面修饰具有抗菌活性的纳米银疏水涂层(水接触角WCA=90.33°)的制备方法。采用光化学反应在柔性硅胶基质上组装微球阵列,并利用其微球表面巯基的还原性原位生长纳米银颗粒,使硅胶表面具有良好的抑菌活性,改变通过短期提高硅胶表面的亲水性进而增强抑菌活性的方法[15]。该硅胶表面自组装微球及微球表面原位生长纳米银颗粒的过程,均在水体系、室温环境下完成,尤其在原位生长纳米银的反应未使用额外的稳定剂及还原剂,不产生废弃物,属于绿色制备技术。通过抗菌活性研究发现,该疏水涂层对革兰氏阳性/阴性细菌的具有良好的抗菌活性,但不会伤害人类细胞,具有较低的细胞毒性。
1 实验
1.1 试剂与仪器
试剂:γ-巯基丙基正硅酸甲酯(MPTMS,97%);氨水(分析纯);乙醇(分析纯);浓硫酸(98%);过氧化氢(30%);甲苯(≥99.5%);烯丙基三乙氧基硅烷(>96.0%);硝酸银(99.8%);胰酪大豆胨琼脂培养基;胰酪大豆胨液体培养基;磷酸二氢钾(分析纯);磷酸氢二钠(分析纯);Hoechst33342/PI双色染色剂;枯草芽孢杆菌菌种均为普通市售试剂;聚二甲基硅氧烷(PDMS,自制);大肠杆菌菌种(吉林大学馈赠)。
仪器:隔水式恒温培养箱(常州诺基仪器有限公司制造);立式压力蒸汽灭菌箱(上海博讯实业有限公司制造);超净工作台(济南杰康净化设备厂制造);CFT-1材料表面性能综合测试仪(兰州中科凯华科技开发有限公司制造); 荧光正置显微镜(Leica DM4000B)。
1.2 负载纳米银PDMS(Ag-PDMS)的制备
首先,将PDMS 置于体积比为3:1 的浓H2SO4和H2O2混合溶液中浸泡5 min,取出后用大量H2O 冲洗;然后,迅速浸泡到1 mmol/L 烯丙基三乙氧基硅烷的甲苯溶液中,10 min后取出用乙醇冲洗,表面略微吹干备用。
将表面活化后的PDMS放入表面富含巯基的SiO2微球(按文献方法[16]制备)悬浮液中,紫光灯照射30 min后取出用水冲洗,随后放置在AgNO3(1 mol/L)溶液中浸泡24 h。水洗后保存在水中。
1.3 摩擦实验
在室温下对二氧化硅微球和PDMS键合的材料进行摩擦学性能考察,载荷为20 N,转速为500 r/min,实验时间为3 min,所用钢球直径为4 mm,洛氏硬度为61~66,摩擦因数为0.29~0.36。
1.4 抑菌实验
在无菌操作台内,将灭菌(121 ℃,15 min)后的胰酪大豆胨液体培养基分别接种大肠杆菌或枯草芽孢杆菌,在37 ℃时恒温培育12 h。用灭菌(121 ℃,15 min)后生理盐水调整菌液浓度为1.3×108个/mL,作为原菌液待用。
在无菌操作台内,将灭菌(121 ℃,15 min)后的胰酪大豆胨固体培养基加入原菌液,凝固后表面放置Ag-PDMS 和未经处理的PDMS 薄膜作为对照,于37 ℃恒温培育12 h。
按照染色剂说明书要求,在锥形瓶内配制磷酸缓冲溶液(PBS),于121 ℃灭菌15 min。将已处理好的Ag-PDMS 薄膜从培养基中取出,放入染色液中避光冰水浴30 min,将PBS 冲洗干净用于荧光显微镜检测。
2 结果与讨论
2.1 硅表面微球的自组装
PDMS 作为一种有机硅,具有柔软、光学透明、无毒、不易燃、良好的化学惰性和生物相容性等特点,广泛地应用于隐形眼镜、人造肌肉、医用导管、生物传感器、微流控系统[17-19]等。由于其表面具有憎水性,因而很容易黏附生物膜,滋生细菌,影响PDMS在医疗材料领域的应用。虽然等离子体、臭氧辐射处理能够有效提高PDMS表面亲水性,在一定程度上抑制生物膜的黏附,但随着时间延长,表面润湿性逐渐变差,这是由于处理后的极性基团(—OH,—COOH)随扩散作用而引发的分子链迁移,即极性基团向PDMS内部迁移[20]。
将粒径较大的微球(直径约为1 μm)通过自组装的方法键合在PDMS表面,能够有效地避免分子链迁移导致的表面变性,永久性地提高抗黏附生物膜的性能。图1所示为微球自组装在PDMS表面的点击化学反应示意图,图2所示为PDMS表面自组装微球的红外光谱和显微成像图片。图1中PDMS 表面修饰端烯,图2中的红外光谱在1 655 cm-1和1 676 cm-1处的峰为端烯的特征吸收峰,这说明PDMS表面已经存在大量的端烯基团[21];在光照条件下,微球表面的巯基将与端烯发生亲电加成反应,红外谱图中原端烯吸收峰消失,在619 cm-1和1 132 cm-1处出现新的吸收峰(硫醚键),证实通过点击化学反应能够将微球键合在PDMS表面[22]。图2中的显微及AFM图像表明,通过自组装的方法能够实现微球在PDMS表面上规则有序地排列。

图1 在PDMS表面微球自组装的点击化学反应Fig.1 Silica microspheres anchored to surface of PDMS by“Click reaction”between thiol group and vinyl-silica

图2 PDMS表面自组装微球的红外光谱和显微成像图片Fig.2 FTIR spectrum and microscope image of silica microspheres assembled on surface of PDMS
通过对照摩擦实验,将组装微球与空白的PDMS进行对照。结果发现:空白PDMS基片在第3次测试时,基片发生破损;而组装后微球的基片在第6次测试时,只有摩擦因数小幅度降低,持续到第10次时,依然未发生基片断裂现象,证实微球在PDMS表面自组装的稳定性,并且能够有效地缓冲摩擦对基片的影响。
2.2 纳米银在微球表面的原位生长
自组装到PDMS表面的微球表面依旧存在大量巯基,利用双巯基键合生成二硫键的同时为银离子还原提供电子,并且PDMS具备远距离(约5 nm)传输电子的特性,吸附在微球表面的银离子自动被还原为纳米银颗粒,随着微球提供的电子衰竭,纳米银的生长逐渐停止(~15 nm),通过调节溶液中银离子的浓度也可以控制纳米银的粒径[23]。图3所示为原位生长在微球表面的纳米银颗粒的TEM 成像图片,球形的纳米银颗粒单层生长在微球表面并具有清晰的晶格线,晶格线间距为0.236 nm,证实纳米银颗粒在微球表面的生成,同时XPS 图谱中Ag 3d3/2和Ag 3d5/2在374.1 和368.1 eV位置出现明显谱峰,这也证实银离子转变为银原子[24]。
2.3 菌落计数法

图3 微球表面AgNPs的TEM图片和XPS谱图Fig.3 TEM image and XPS spectrum of silver nanoparticles generated on surface of silica microspheres
纳米银是一种常用的广谱抗菌剂,且不会导致抗药性菌种出现,因此,含纳米银的抗菌用品应用非常广泛。本次实验通过平板菌落计数的方法对材料的抑菌性能进行评价。如图4所示为负载纳米银抑制大肠杆菌和枯草杆菌生长的平板菌落计数结果。从图4可见:与革兰氏阴性菌(大肠杆菌)共同培养的Ag-PDMS上及周围没有菌落出现(图4(a)中A处),而未经处理过PDMS 的表面长满菌落(图4(a)中B处),说明修饰纳米银后的PDMS基片对大肠杆菌有良好的抑菌效果。同样,与革兰氏阳性菌(枯草芽孢杆菌)共同培养的Ag-PDMS 上及周围也没有菌落生长(图4(b)中C处),而未处理过的PDMS 上长满菌落(图4(a)中D处),所以,生长纳米银颗粒的PDMS 对革兰氏阳性菌枯草芽孢杆菌也有良好的抑菌效果。通过菌落计数法对照实验,证明经修饰纳米银后的PDMS呈现良好的抑菌活性。
2.4 细菌染色法

图4 负载纳米银抑制菌种生长的平板菌落计数结果Fig.4 Colony counting results of inhibiting the growth of bacterial by AgNPs

图5 用不同样品孵育后细菌的荧光显微镜图像Fig.5 Fluorescent microscopy images of bacteria after incubation with different samples
将未经过处理的PDMS 和Ag-PDMS 分别与大肠杆菌或枯草芽孢杆菌共同培养,将培养后的薄膜使用荧光染色剂染色,根据染色部位和荧光颜色的差异,可以区分细菌的生存状况,其中蓝色荧光主要是活细菌,红色荧光则对应死亡细菌,荧光强度越高说明相应的细菌数量越多。图5所示为用不同样品孵育后的活/死大肠杆菌和枯草芽孢杆菌的荧光显微镜图像。其中,图5(a)和(b)所示为大肠杆菌的荧光显微镜图像,可见未经染色的薄膜表面生长着大量的细菌,而复合纳米银颗粒的PDMS 表面只能观察到微球存在。经过染色对比后,活/死细菌的数量PDMS 远远比Ag-PDMS 复合薄膜的多。图5(c)和(d)所示为枯草杆菌的荧光显微镜图像,与大肠杆菌的检测结果类似,Ag-PDMS表面生长的细菌量很少,说明Ag-PDMS具有良好的抑菌活性。
2.5 纳米银修饰PDMS表面的细胞毒性
实验结果表明:纳米银修饰PDMS表面具有很好的抑制革兰氏阳性/阴性细菌的活性,即对原核微生物具有很好的抑制作用,但同时需要保证该材料对哺乳性动物细胞特别是人类细胞不要造成伤害。为验证经纳米银修饰PDMS 的安全性,采用MTT 方法以细胞存活率作为定量的标准,选用蜂毒肽作为阳性参照物,空白磷酸缓冲溶液作为阴性对照物,与纳米银修饰的PDMS进行比较,实验选用人脑微血管内皮细胞(hCMEC/D3),该细胞与普通人体细胞非常接近,具有良好的形态学特征,适合开展细胞毒性实验[25]。
细胞毒性曲线如图6所示。从图6可见:蜂毒肽对hCMEC/D3 细胞具有强烈的杀伤作用;当蜂毒肽的质量浓度为16 mg/L 时,hCMEC/D3 细胞全部死亡;而当PDMS 表面纳米银的质量浓度低于64 mg/L时,细胞存活率并未受到影响(约100%),因此,可认为当纳米银的质量浓度低于64 mg/L时,不具备杀伤性;而随着样品中纳米银质量浓度逐渐增加,达到128~256 mg/L 时,依然有50%~90%的细胞存活,此时,其质量浓度相比蜂毒肽的致死质量浓度高8~16 倍,这表明当PDMS 表面纳米银质量浓度低于128 mg/L时,几乎不抑制人类细胞的增值。
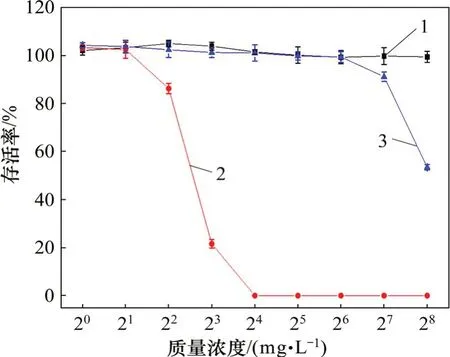
图6 细胞毒性曲线Fig.6 Curves of cytotoxicity
3 结论
1)利用光点击化学反应通过二氧化硅微球将纳米银颗粒键合在柔性硅基质材料(PDMS)表面,利用纳米银颗粒独特的抑菌性能,降低PDMS吸附和滋生细菌的可能性。
2)Ag-PDMS 薄膜对大肠杆菌和枯草芽孢杆菌的生长均有明显的抑制作用,同时具有较低的生物毒性,在一定程度上可以替代抗生素、消毒剂或杀菌剂,为食品安全及医用卫生等无菌操作的领域提供材料。
