小球藻生长及协同净化畜禽养殖废水研究
2019-09-18朱中强何雪薛梦婷余冉
朱中强,何雪,薛梦婷,余冉
(1.东南大学能源与环境学院,江苏南京,210096;2.东南大学能源热转换及其过程测控教育部重点实验室,江苏南京,210096)
微藻是一种极其细小、肉眼不可见的自养植物,因其具有比一般植物更高的光合作用效率及更高的生物质产量,并且生长周期短、可适应复杂的生态条件(如盐碱地、沙漠等)[1-3],故在营养保健食品行业、医学领域、环境治理等方面应用广泛。微藻具有多种代谢途径,既可光合自养,也可化能异养,可混合代谢生长,并能在不同的培养条件下,通过改变其合成蛋白质、多糖、脂质的途径实现其自身增殖[4]。而微藻的混合代谢模式可帮助其利用废水中的有机物并减少其自养生长对光的依赖[5-6],从而同步实现废水净化与资源的有效利用。目前,微藻养殖种类主要包括小球藻、螺旋藻、栅藻,其中,小球藻生长速率快,固碳效率高,pH 适应性广,因而,成为应用与研究的热点。人们对小球藻的废水养殖技术已有一定研究,在光照条件下,二氧化碳和废水中的有机物可协同促进小球藻的生长[7]。LU等[8]利用小球藻处理肉类加工废水,发现生长在混合废水中的小球藻的生物量比分别生长在单一废水和培养基中的高,达到0.68~1.54 g/L,此外,氨氮去除率(68.75%~80.3%)和总氮去除率(30.06%~50.94%)也有不同程度地提高。GE等[9]利用厌氧消化液分别自养、异养、混合培养小球藻,发现相比于其他2种培养模式,在混合模式下的小球藻具有更高的生长量((0.72±0.01)g/L)和更高质量浓度的叶绿素((14.2±0.1)g/L)及类胡罗素((12.9±0.4)g/L),并且氮磷污染物几乎全部去除。我国畜禽养殖业发展迅速,随之产生的畜禽养殖废水的有效处理问题受到广泛关注。目前,该类废水的典型处理工艺有水解-序批式活性污泥工艺(SBR)、氧化沟工艺等,但这些工艺都存在操作复杂、成本较高的缺点。然而,畜禽养殖废水具有氨氮浓度高、有机物浓度高的特点,其中部分有机物可用于回收再利用。虽然已有研究表明,利用畜禽养殖废水进行微藻养殖具有可行性,但该模式下微藻固碳机理的研究仍然较少,为此,本文作者研究小球藻对畜禽养殖废水的净化能力以及废水与小球藻代谢生长的协同作用关系与机理,重点探讨小球藻对有机与无机碳源的竞争利用策略,小球藻细胞增殖速率与合成代谢产物(色素、油脂)含量的关系,并解析有机碳利用的影响因素与小球藻固碳机理,以期为畜禽养殖废水的小球藻净化工艺提供参考。
1 材料与方法
1.1 藻种及培养基
实验所用的小球藻(Chlorella vulgaris)(FACHB-8)购于中国科学院水生生物研究所(中国,武汉)。采用高温灭菌(121 ℃,30 min)后的BG11培养基进行扩增培养。
1.2 反应器设计及运行
本次废水处理装置示意图如图1所示,具体包括藻培养系统及pH控制系统(控制pH为7.5±0.5)。反应器容积为1 L,有效容积为400 mL。反应器试验全程置于光照培养箱(温度为28 ℃,光暗时间比为12 h:12 h,光照强度为56.67 W/m2)。
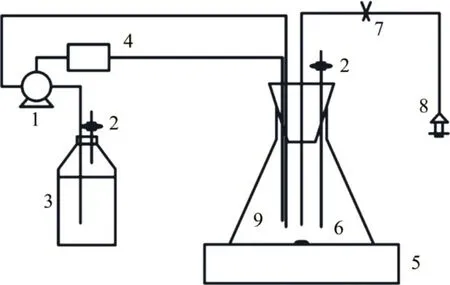
图1 废水处理装置示意图Fig.1 Diagram of wastewater treatment device
1.3 畜禽养殖废水组成
试验用废水参考南京市某养殖中心的废水成分进行人工配制,模拟废水以C6H12O6为碳源,以NH4Cl为氮源、以K2HPO4为磷源,添加必需金属元素。模拟废水组分如下:1.000 g/L C6H12O6;0.200 g/L NH4Cl;0.040 g/L K2HPO4;0.075 g/L MgSO4·7H2O;0.036 g/L CaCl2·2H2O; 0.003 g/L FeCl3·6H2O;1 mL/L A5(痕量金属溶液)。其中,A5 组分如下:2.86 g/L H3BO3; 1.86 g/L MnCl2·4H2O; 0.22 g/L ZnSO4·7H2O; 0.39 g/L Na2MoO4·2H2O; 0.08 g/L CuSO4·5H2O;0.05 g/L Co(NO3)2·6H2O。模拟废水(接种后)成分如表1所示。

表1 模拟废水成分(质量浓度)Table1 Composition of simulated wastewater mg/L
考虑到pH 对藻类生长及固碳机理的影响,为研究小球藻对无机碳(HCO-3)和有机碳的竞争利用规律,在模拟水质基础上分别采用NaHCO3和Na2CO3组合以及4-羟乙基哌嗪丙磺酸(HEPPS)作为模拟废水的pH缓冲剂,分别设置4 个实验组(见表2),以对比不同实验组中初始的无机碳浓度,同时避免小球藻培养过程中为调节pH而投加无机碳源对小球藻生长的影响。其中HEPPS 作为一种生物缓冲剂,对细胞无毒性作用,且不能够被细胞利用,故可以作为缓冲剂而不会增加培养液中的有机碳浓度。

表2 实验设计方案Table2 Experimental design schemes
1.4 实验方法
将小球藻先于BG11培养基中进行培养,待生长至稳定期(10 d)后,按照1:50 体积比分别接种进4 个(分别编号为A,B,C 和D 组)装有400 mL 高温灭菌(121 ℃,30 min)废水的反应器中进行序批式培养,监测小球藻的生长及水质变化情况。同时,监测藻细胞内色素、油脂的含量变化,每批实验重复2次。
1.5 测定指标及分析方法
1.5.1 藻生长情况及比生长速率计算
在波长为680 nm条件下,利用紫外-可见分光光度计测定的吸光度表征藻的生长情况。比生长速率计算公式如下:
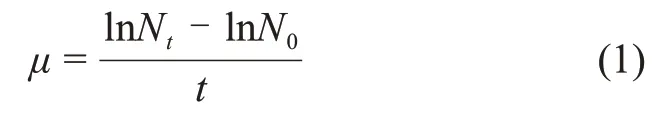
式中:μ为比生长速率,d-1;t为小球藻的培养时间,d;Nt和N0分别为第t天和初始时测定的藻密度。实验发现,在藻培养过程中,前3 d为对数增长期,因此,在计算比生长速率时,统一取第3天藻密度和初始藻密度进行计算,即t=3,Nt为N3。
1.5.2 废水中成分测定
取适量的小球藻液,以8 000 r/min 离心5 min 后取上清过滤(滤膜孔径为0.45 μm)。采用纳氏试剂光度法测定NH+4-N浓度,采用碱性-过硫酸钾分光光度法测定总氮(TN)质量。采用钼酸铵分光光度法测定总磷(TP)质量[10];采用快速消解法测定COD 质量浓度[11]。由于实验组中添加的生物缓冲剂会体现为COD 质量浓度,但不可被小球藻利用,因此,添加有生物缓冲剂的实验组中COD 质量浓度的计算公式如下:
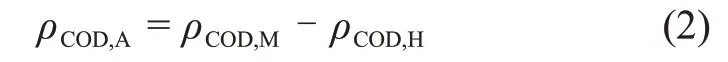
式中:ρCOD,A为小球藻可以利用的COD 质量浓度,mg/L;ρCOD,M为测定的COD 质量浓度,mg/L;ρCOD,H为添加生物缓冲剂后体现的COD质量浓度,mg/L。
1.5.3 色素及油脂测定
采取分光光度法测定色素的含量(叶绿素a、叶绿素b、类胡萝卜素)[12];采用氯仿-甲醇法测定油脂质量[13]。
1.6 统计学分析
本文实验测得的藻生物量以及COD,TN,TP,NH4-N 和叶绿素的质量浓度、脂质质量等采用Excel进行分析,并表示为T±ΔT,其中T为各指标的平均值,ΔT为各指标的平均偏差,并对数据进行t 检验。当概率p<0.05时说明结果具有统计学意义。
2 结果与讨论
2.1 无机碳对藻类生长及水质净化的影响
2.1.1 小球藻的生长
小球藻在模拟畜禽养殖废水中的生长情况对比如图2所示。其中,“*”表示该组实验结果与C组实验结果相比具有显著性差异(p<0.05);“&”表示该组实验结果与D 实验结果相比具有显著性差异(p<0.05)。由图2可知:无机碳的添加不影响小球藻的生长周期,4 个实验组的小球藻在经过1 d 的适应期后,均快速进入对数增长期,在第3天时小球藻的生物量达到最大,并逐渐进入生长稳定期(见图2(a))。其中,B 实验组(以HEPPS 为初始缓冲液,用NaHCO3调节pH)中的小球藻经过7 d 培养后,生物量达到最大。由于初始无机碳的存在,小球藻的生长速率以及达到稳定期时的生物量明显降低(见图2(b))。当pH为7.0~8.0 时,CO2在液相的主要存在形式为可被藻类吸收利用的。A 和B 组中的小球藻经过7 d 培养,藻的生物量并没有显著性差异(p>0.05),但均明显高于C 和D 实验组的小球藻生物量(p<0.05)。这说明当缺少无机碳源时,小球藻可以通过改变其代谢途径对废水中有机碳源进行吸收,以满足藻类生长的需要[15];另一方面,在以空气中的CO为无机碳源且水中溶解性无机碳极少的情况下,可能会引发藻细胞内的“二氧化碳浓缩机制”[16],藻细胞可以主动运输HCO-3或者在微藻胞内和胞外酶共同作用下将HCO-3转化为CO2扩散至细胞内,使得小球藻在无机碳源受限时依然可维持快速增长。但是B实验组中小球藻的比生长速率仍然明显高于其他实验组中小球藻的比生长速率(p<0.05),说明适当添加无机碳源利于藻的快速增长。这可能是由于藻类在生长过程中,为保持体内平衡而向外分泌H+与HCO-3,二者反应后释放出CO2,通过扩散作用快速被藻类吸收[17]。C 和D 实验组中藻的生长速率和藻的密度明显比A 和B 组中的低,说明添加过量无机碳源(HCO3-)可能使藻类合成碳的途径发生改变,并对有机碳的有效吸收产生负面影响,从而抑制了高质量浓度有机碳条件下藻的生长[18]。因此,当pH为7.0~8.0时,添加一定量的无机碳(HCO-3)能够促进高质量浓度有机碳培养条件下藻的生长,但过高浓度的无机碳会抑制藻的生长。
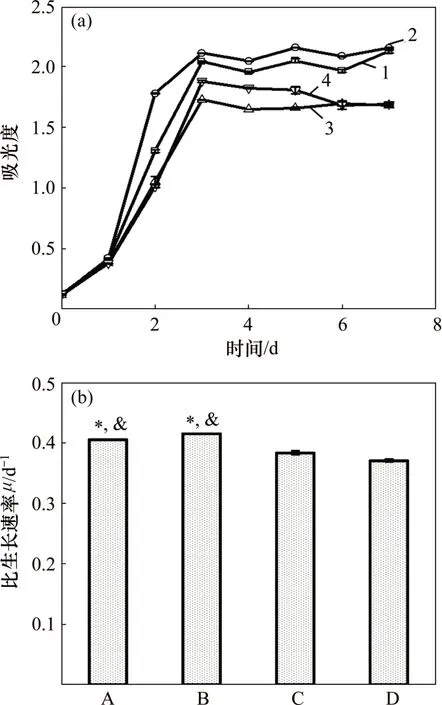
图2 小球藻在模拟畜禽养殖废水中的生长情况对比Fig.2 Comparison of growth of Chlorella vulgaris in simulated livestock and poultry aquaculture wastewater
2.1.2 无机碳对水质净化的影响
模拟畜禽养殖废水培养小球藻过程中COD 质量浓度变化如图3所示。由图3可知:利用模拟畜禽养殖废水培养小球藻过程中,所有实验组中废水的ρCOD均随着小球藻的生长而明显降低。A~D实验组ρCOD去除率在7 d 培养期结束时分别为(91.0±1.3)%,(77.8±14.4)%,(68.8±5.6)%和(64.8±12.1)%,但除A 组外,ρCOD均呈现出先减少后缓慢增加的趋势;同时,C实验组中ρCOD分别为A 和B 这2 组ρCOD的5.9 倍与1.4倍,D实验组中的ρCOD分别为A和B这2组ρCOD的6.7倍与1.5 倍。由于碳源存在竞争关系,小球藻可能优先吸收无机碳,从而影响了有机碳的吸收。B实验组的ρCOD经过2 d 培养后迅速降至(46.8±16.9)mg/L,显著小于同时期其他实验组的ρCOD(p<0.05)。在藻类对数增长末期,所有实验组藻类的ρCOD随着时间延长而逐渐上升,这可能是因为藻向胞外分泌有机物。
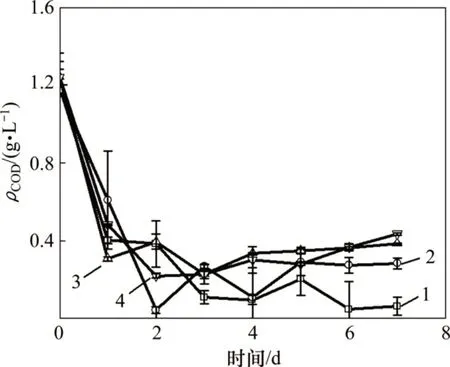
图3 模拟畜禽养殖废水培养小球藻过程中ρCOD变化Fig.3 Change of ρCOD during cultivation of Chlorella vulgaris in simulated livestock and poultry aquaculture wastewater
氮是藻类细胞的重要组成成分,对藻的结构蛋白、酶、核酸及叶绿素等合成至关重要[19]。模拟废水培养小球藻过程中氨氮和总氮的质量浓度变化如图4所示。由图4可知:随着小球藻的生长,氨氮和总氮的质量浓度都呈现下降趋势;A~D 实验组中小球藻对氨氮去除率均达到100%,总氮的去除率分别为(96.5±2.7)% , (97.0±0.6)% , (96.9±1.1)% 和(96.8±0.5)%,但是,各个实验组出水总氮质量浓度并无显著性差异,且均达到城镇污水厂一级A 的排放标准(总氮质量浓度<15 mg/L)。由此可见,添加无机碳对氨氮和总氮的去除影响不显著。
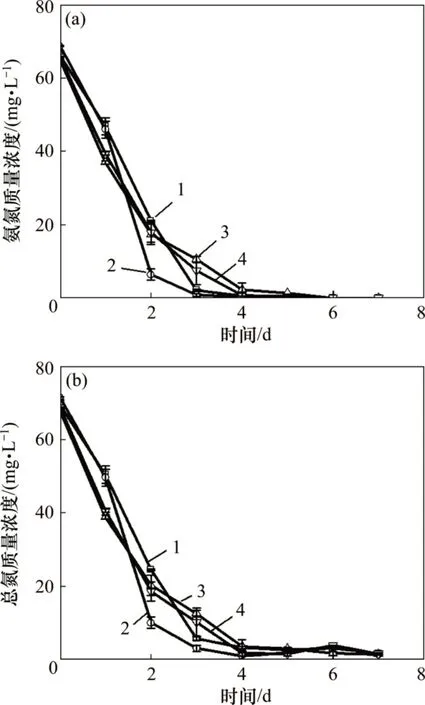
图4 模拟畜禽养殖废水培养小球藻过程中氨氮与总氮质量浓度变化Fig.4 Changes of ammonia nitrogen and total nitrogen mass concentrations during the cultivation of Chlorella vulgaris in simulated livestock and poultry aquaculture wastewater
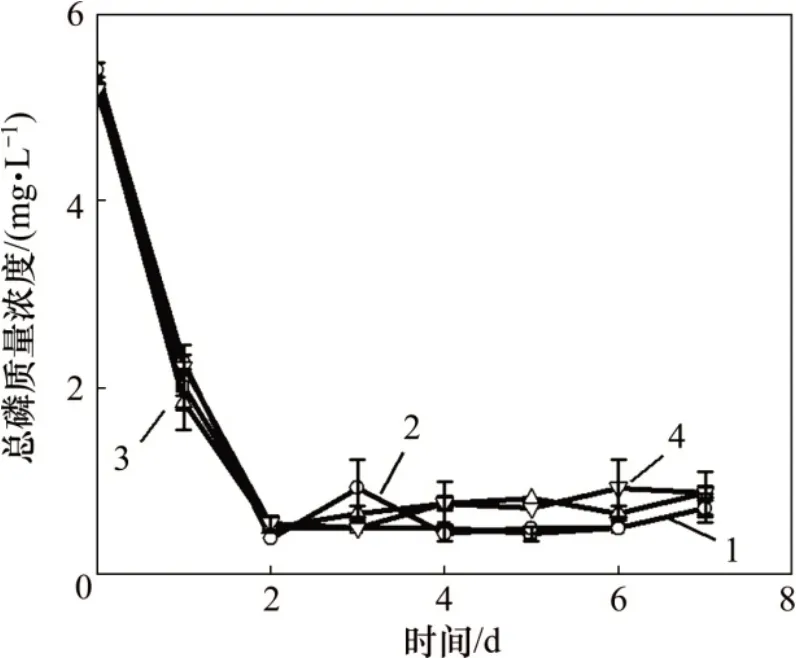
图5 模拟畜禽养殖废水培养小球藻过程中总磷质量浓度的变化Fig.5 Change of total phosphorus mass concentration during the cultivation of Chlorella vulgaris in simulated livestock and poultry aquaculture wastewater
磷是藻类生长必需的营养元素之一,它可以影响藻类磷脂、蛋白质和核酸的合成,并且对能量循环具有重要作用[20-21]。模拟畜禽养殖废水培养小球藻过程中总磷质量浓度的变化如图5所示。由图5可知:随着小球藻培养时间的延长,A~D 组废水中总磷质量浓度都呈现下降趋势,最终总磷去除率均大于80%。A 和B 实验组的总磷去除率分别为(86.8±3.9)%和(86.8±2.8)%),比C和D实验组的总磷去除率(分别为(83.4±1.7)%和(83.3±5.7)%)略高,但C 和D 实验组中的最终出水总磷质量浓度与A和B实验组中的总磷质量浓度并没有显著性差异(p>0.05)。因此,当利用畜禽养殖废水培养小球藻时,是否添加无机碳对废水中总磷的去除无影响。
2.1.3 小球藻胞内色素、油脂质量变化
在小球藻培养过程中,无机碳浓度对油脂在藻细胞中积累量的影响如图6所示。由图6可知:经过7 d培养,B 实验组中单个小球藻细胞内的油脂质量为(0.26±0.004)ng,显著高于其他实验组中藻细胞的油脂质量(p<0.05)。这是因为,适量无机碳源的添加可能促进了细胞对有机物的吸收与油脂的转化积累;另一方面,B 实验组藻的生长速率较快,加快了其对氮的消耗,导致生长过程中提前形成了“氮饥饿”,从而更利于油脂的积累[22-24]。但无机碳的过量添加明显抑制藻细胞对油脂的转化积累,从而导致A和B组的藻细胞油脂质量均显著高于C和D组的藻细胞油脂质量。
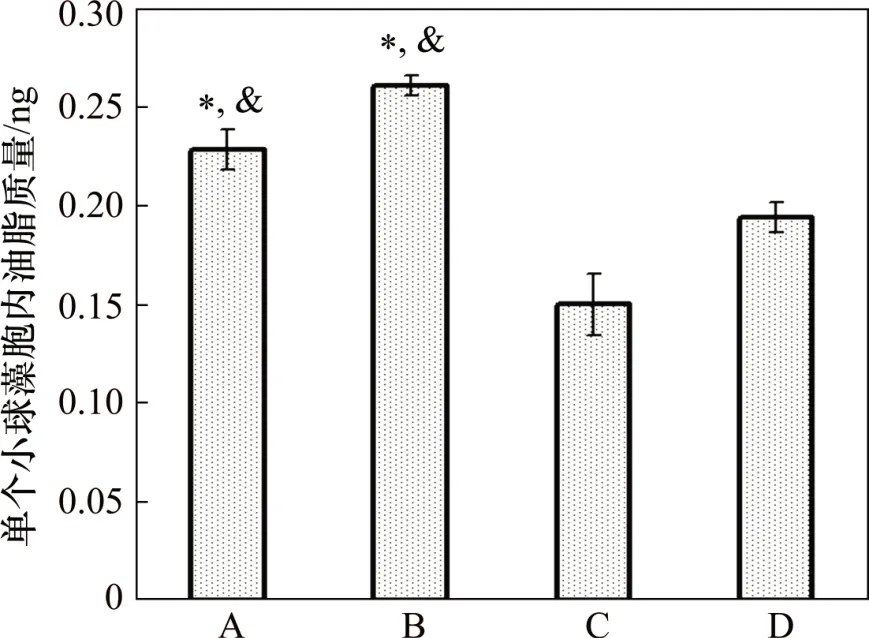
图6 模拟畜禽养殖废水培养的小球藻油脂积累情况Fig.6 Accumulation of oil of Chlorella vulgaris in simulated livestock and poultry aquaculture wastewater
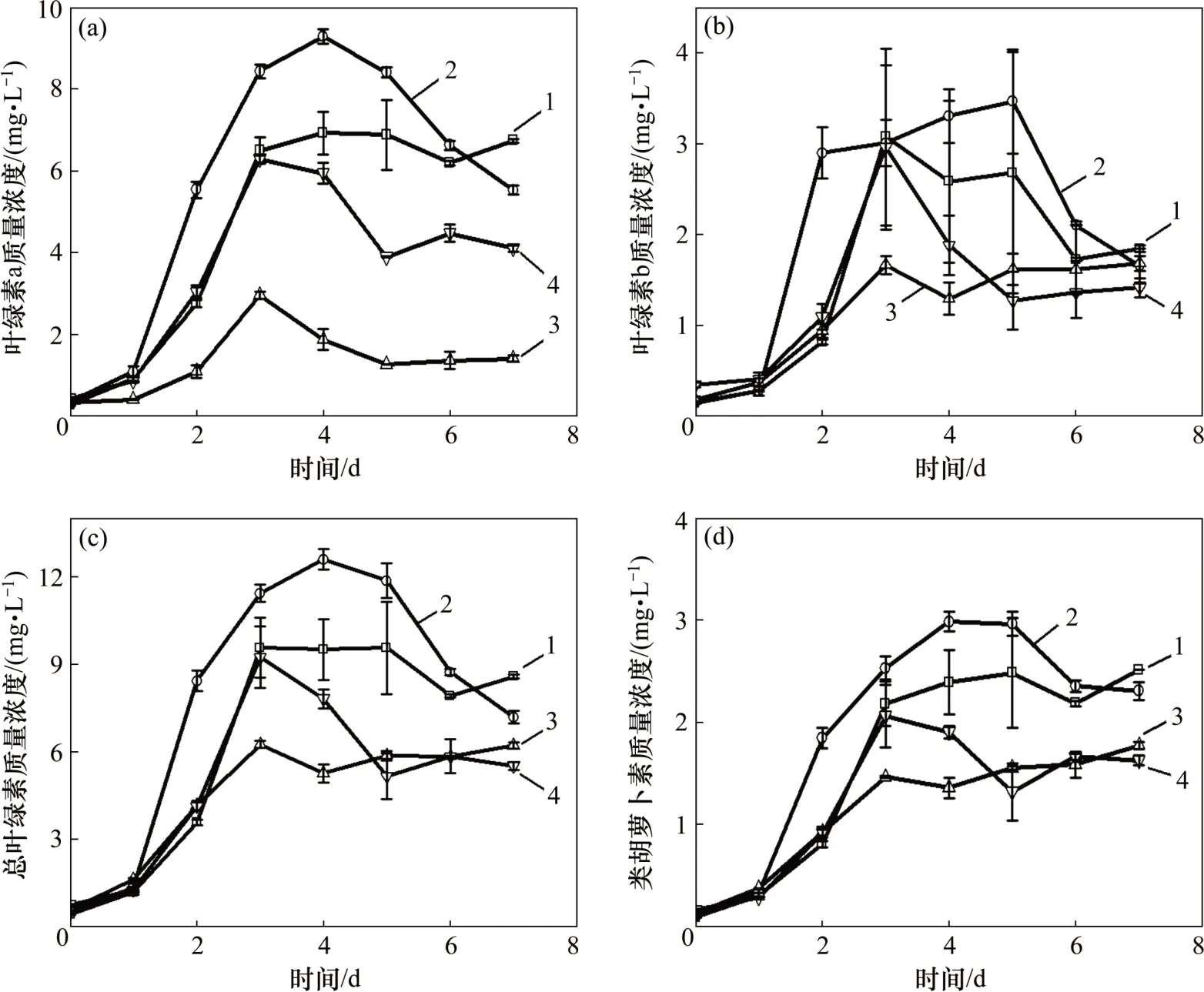
图7 模拟废水培养小球藻过程中叶绿素a、叶绿素b、总叶绿素与类胡萝卜素质量浓度的变化Fig.7 Changes of chlorophyll a,chlorophyll b,total chlorophyll and carotenoid mass concentrations in process of cultivating Chlorella vulgaris in simulated wastewater
叶绿素是小球藻进行光合作用的重要色素,其质量浓度直接影响小球藻光合效率和自养生长速率[25]。类胡萝卜素在捕集光能、维持光合作用和消除多余能量等方面具有重要作用[26]。模拟废水培养小球藻过程中叶绿素a、叶绿素b、总叶绿素与类胡萝卜素质量浓度的变化如图7所示。由图7可见:小球藻中测得的各叶绿素质量浓度均呈先增加后减小趋势,其中,B实验组中各类叶绿素的质量浓度在对数增长期末期(第4 天)均明显高于其他实验组中各类叶绿素的质量浓度;在第3和第4天(即小球藻生长对数增长末期与平台期)时,实验组A和实验组B中的叶绿素a和叶绿素b 的质量浓度与第5 天时的并无显著性差异(p>0.05),表明这2 个实验组藻细胞中叶绿素a 和叶绿素b的质量浓度达到最大并稳定一段时间后逐渐减少,而实验组C和实验组D的变化规律类似,在第3天时达到最大后迅速下降后并逐渐趋于稳定。其中,B 组叶绿素a 质量浓度最高达(8.43±0.17)mg/L,比同时期的A,C 和D 组中叶绿素a 质量浓度高34.1%,133.7%和56.4%。但是经过7 d培养,B组中叶绿素a质量浓度却显著低于A组叶绿素a质量浓度(p<0.05),说明经过7 d 培养,B 实验组的光合效率明显下降。这是因为,第6天时B组的小球藻生长情况显著优于A 组的小球藻生长情况(p<0.05)(见图2),B 组小球藻对模拟废水中Mg2+的吸收增加,导致第7天时B组中的小球藻在缺镁条件下生长,严重影响B组叶绿素的合成[27],故7 d 后B 组的叶绿素质量浓度显著低于A组的叶绿素质量浓度。另外,叶绿素b、总叶绿素、类胡萝卜素质量浓度的变化趋势与叶绿素a 的均一致。A和B组的总叶绿素和类胡萝卜素水平明显比同期的C和D组的高,说明适量的无机碳可促进藻的光合作用,从而可释放更多的能量用于藻对有机碳的吸收(见图3)。
3 结论
1)小球藻可在有效净化高质量浓度有机畜禽废水的同时完成自身增殖,有机物、总氮、总磷和NH+4-N 的去除率分别高达(91.0±1.3)%,(97.0±0.6)%,(86.8±3.8)%和100%。
2)一定浓度的无机碳(0.1~1 μmoL/L)可以促进小球藻的生长及其对有机物的吸收,COD 去除率可提高12.9 %~40.4%,同时,油脂和叶绿素转化积累能力也有一定程度提高。
