GO通过氧化损伤激活秀丽线虫未折叠蛋白反应
2019-09-17赵云利洪运李佳钰李仁杰吴华彰
赵云利,洪运,李佳钰,李仁杰,吴华彰
1. 蚌埠医学院公共卫生学院,蚌埠 233030 2. 蚌埠医学院生命科学系,蚌埠 233030
氧化石墨烯(graphene oxide, GO)是石墨粉末化学氧化及剥离后的产物,通常为单一原子层的薄层。由于其独特的光、电等特性,以及低廉的生产成本,在生物医药、电子元件和复合材料等领域崭露头角、应用前景诱人[1]。然而,氧化石墨烯在给人类带来巨大经济利益和技术突破的同时,也对人类健康与环境安全产生了潜在的威胁[2]。体内外研究显示GO具有潜在毒性效应:进入动物体内的GO可以分布聚集在肠道、肝脏、肾脏和肺等组织部位,通过诱导血栓的形成、基因表达改变、线粒体损伤和炎症反应等对动物产生损伤[3-5];体外研究证实,GO可以降低细胞活力,诱导caspase-3活性增高、乳酸脱氢酶(LDH)释放和活性氧(ROS)的产生,进而导致细胞粘附性改变与凋亡的产生[4,6-8]。因此,GO毒作用机理被认为与氧化应激发生有关。
在正常的生理状态下,人体内的氧化与抗氧化体系处于动态平衡之中。但是,当机体处于饥饿、理化因素刺激等不利环境时,机体内的这种平衡被打破,自由基、ROS等在机体内累积,导致氧化损伤[9]。机体内自由基产生过量时,会攻击脂类、蛋白质和DNA等人体的生物大分子,使其结构遭到破坏[9]。这时,机体可能通过未折叠蛋白反应(unfolded protein response, UPR)来应对错误折叠与未折叠蛋白聚集以及钙离子平衡紊乱所带来的伤害[10]。已有研究显示纳米材料可以诱导UPR:纳米金可以激活内质网PERK信号通路和UPR信号跨膜感受蛋白肌醇依赖酶1(IRE1)诱导细胞凋亡,纳米银通过caspase-4降解UPR信号跨膜转录因子6(ATF-6)、通过非经典信号通路诱导秀丽线虫UPR应答[11-13];纳米二氧化硅可以激活内质网UPR应答[14]。但针对非金属纳米材料对UPR应答的诱导研究还很少。
钙稳态的失衡、膜泡转运受损、蛋白降解和氧化应激均能诱导线粒体UPR(UPRmt)和内质网UPR(UPRER)[15-16]。本研究利用秀丽线虫作为在体模型,旨在探讨GO暴露对机体氧化损伤及UPR应答的激活,并通过抗氧化剂谷胱甘肽(GSH)的保护作用分析GO诱导的UPR应答与氧化应激的关系。秀丽线虫(C.elegans)是一种在发育、遗传等研究领域广泛应用的模式动物[17],具有繁殖周期短(2~3 d)、繁殖力高(一只秀丽线虫可产生约200~300条后代)、周身透明便于观察、易于培养且成本低廉、遗传背景清楚等众多优良特性。C.elegans中存在的抗氧化酶与人体的抗氧化酶十分相似,主要是超氧化物歧化酶(SOD)和过氧化氢酶(CAT)。另外,C.elegans体内还含有谷胱甘肽S-转移酶(GST)和过氧化物酶基因(PRDX)等[18],C.elegans的抗氧化功能检测对研究人体抗氧化功能有着重要意义。
1 材料与方法(Materials and methods)
1.1 实验材料
野生型秀丽线虫N2、指示内质网未折叠蛋白反应SJ4005(zcIs4[hsp-4::GFP])、线粒体未折叠蛋白反应SJ4100(zcIs13[hsp-6::GFP])转基因秀丽线虫和尿嘧啶缺陷型大肠杆菌E.coliOP50由美国CaenorhabditisGenetics Center(CGC)提供。
GO按照文献方法制备[19]。BCA蛋白浓度测定试剂盒为碧云天生物技术研究所提供, SOD、CAT和谷胱甘肽过氧化物酶(GSH-Px)等试剂盒购自南京建成生物工程研究所。
1.2 实验方法
1.2.1 秀丽线虫培养
野生型和突变体秀丽线虫培养于秀丽线虫生长培养基(NGM),待大量线虫处于产卵期时以M9洗下,置于1.5 mL离心管中,M9溶液中含22 mmol·L-1KH2PO4、33.71 mmol·L-1Na2HPO4、85.56 mmol·L-1NaCl和1 mmol·L-1MgSO4,清洗2~3次以去除虫体表面的食物;加入裂解液(0.45 mol·L-1NaOH,质量分数为2%的NaClO),待虫体完全裂解后离心去除裂解液,M9清洗2~3次去除残留的裂解液。离心搜集卵置于无食物的K buffer(53 mmol·L-1NaCl和32 mmol·L-1KCl)中20 ℃培养12~18 h,即可获得大量处于L1时期的幼虫,L1幼虫经过30 h即可发育到L4时期。
1.2.2 GO暴露实验
用K-buffer配制不同浓度的GO溶液,使用前混合均匀。采用野生型秀丽线虫L4幼虫暴露24 h的急性暴露方法。L4幼虫置于含有OP50的3.5 cm NGM培养皿上,每皿加200L暴露液,轻轻旋转摇晃,使GO均匀分布于NGM表面。暴露结束后收集虫体,提取秀丽线虫蛋白并立即进行酶活性的分析。
1.2.3 GO对秀丽线虫氧化应激水平的影响
LDH是一种稳定存在于细胞质内的糖酵解酶。一般情况下,LDH稳定存在于细胞质内部,但当细胞受到刺激,LDH根据细胞膜受损情况而释放出不同的量,进入到细胞培养液中,通过检测培养液和细胞内LDH含量,计算出LDH释放率而推断细胞的受损程度。
线虫体内丙二醛(MDA)含量的测定:L4秀丽线虫暴露24 h后以M9洗下,在冰浴条件下匀浆,1 000 r·min-1,离心20 min,取上清液(每组3个平行样),按试剂盒说明测定总蛋白含量和MDA含量。
ROS检测:采用5-(and-6)-carboxy-2’,7’-dichlorodihydrofluorescein diacetate (CM-H2DCFDA)检测秀丽线虫体内的氧自由基含量。ROS水平检测时,将受试秀丽线虫转移到含有1 μmol·mL-1CM-H2DCFDA的M9缓冲液中20 ℃孵育3 h,然后转移到2%琼脂平面上,利用激光扫描共聚焦显微镜于488 nm激发波长和510 nm发射过滤器激发秀丽线虫产生荧光并照相记录。用Image J软件对所激发的荧光强度进行半定量分析,以荧光的强弱反映ROS水平(RFU)。每个处理50只线虫,每个实验3次重复。
1.2.4 GO对秀丽线虫抗氧化酶的影响
GO暴露后秀丽线虫体内CAT、SOD和GSH-Px的检测均依照南京建成生物研究所提供的试剂盒进行。
GO暴露后秀丽线虫体内SOD酶活性的变化同时采用CF1553 [muIs84[pAD76(sod-3::GFP)]]转基因线虫检测GO暴露后秀丽线虫体内SOD-3的实时表达水平。sod-3::GFP转基因线虫同步化,L4幼虫暴露于GO,24 h后置于2%凝胶垫上于荧光显微镜下观察荧光强度变化,实时反映SOD-3表达水平。
1.2.5 GO对秀丽线虫UPR的激活
hsp-4和hsp-6转录表达水平:野生型秀丽线虫暴露于GO,同时以K buffer为对照,暴露结束后以K buffer洗下秀丽线虫,Trizol法提取总RNA,用逆转录试剂盒进行RNA纯化和cDNA合成,用SYBR Green PCR试剂盒进行实时定量分析,以act-1为内参进行均一化,△△Ct计算hsp-4和hsp-6基因的相对表达水平。
HSP-4和HSP-6蛋白水平检测:SJ4005(zcIs4[hsp-4::GFP] V)和SJ4100(zcIs13[hsp-6::GFP])转基因线虫同步化,L4幼虫暴露于GO,24 h后转移到2%琼脂糖凝胶垫上,荧光显微镜下观察荧光强度变化,用Image J软件对所激发的荧光强度进行半定量分析,以相对荧光单位(RFU)表示。
1.2.6 GSH的保护作用
将同步化后的卵放置在含有5 mmol·L-1GSH的NGM培养基上孵化,直至L4时期[20]。
1.3 数据统计与分析
2 结果(Results)
2.1 GO对秀丽线虫机体氧化应激水平的影响
如图1所示,GO短期暴露可以引起秀丽线虫体内氧化应激水平上升,机体各种氧化指标呈上升趋势。随着GO暴露浓度的增加,秀丽线虫体内ROS的积累逐渐增加(图1a、b)。秀丽线虫体内MDA含量也随着GO浓度的增加而逐渐增加,10 mg·L-1GO暴露24 h就可导致秀丽线虫MDA含量升高(图1b)。同样,GO暴露秀丽线虫体内LDH含量也随着GO暴露浓度的增加而逐渐上升,呈剂量依赖性(图1c)。
2.2 GO对秀丽线虫机体抗氧化酶活性的影响
随着机体氧化应激水平上升,SOD、GSH-Px等清除自由基和抗氧化的酶活性也随之增加,以维持机体的氧化-抗氧化状态处于一个新的平衡,但当GO浓度达到500 mg·L-1时,SOD、CAT和GSH-Px活性不再增加,SOD和GSH-Px活性甚至有所下降(图2)。
进一步选择sod-3::GFP转基因秀丽线虫以100 mg·L-1GO进行短期暴露,结果显示GO处理24 h可以显著增加秀丽线虫体内SOD-3表达水平,尤其是肠道部位SOD-3表达水平(图3)。
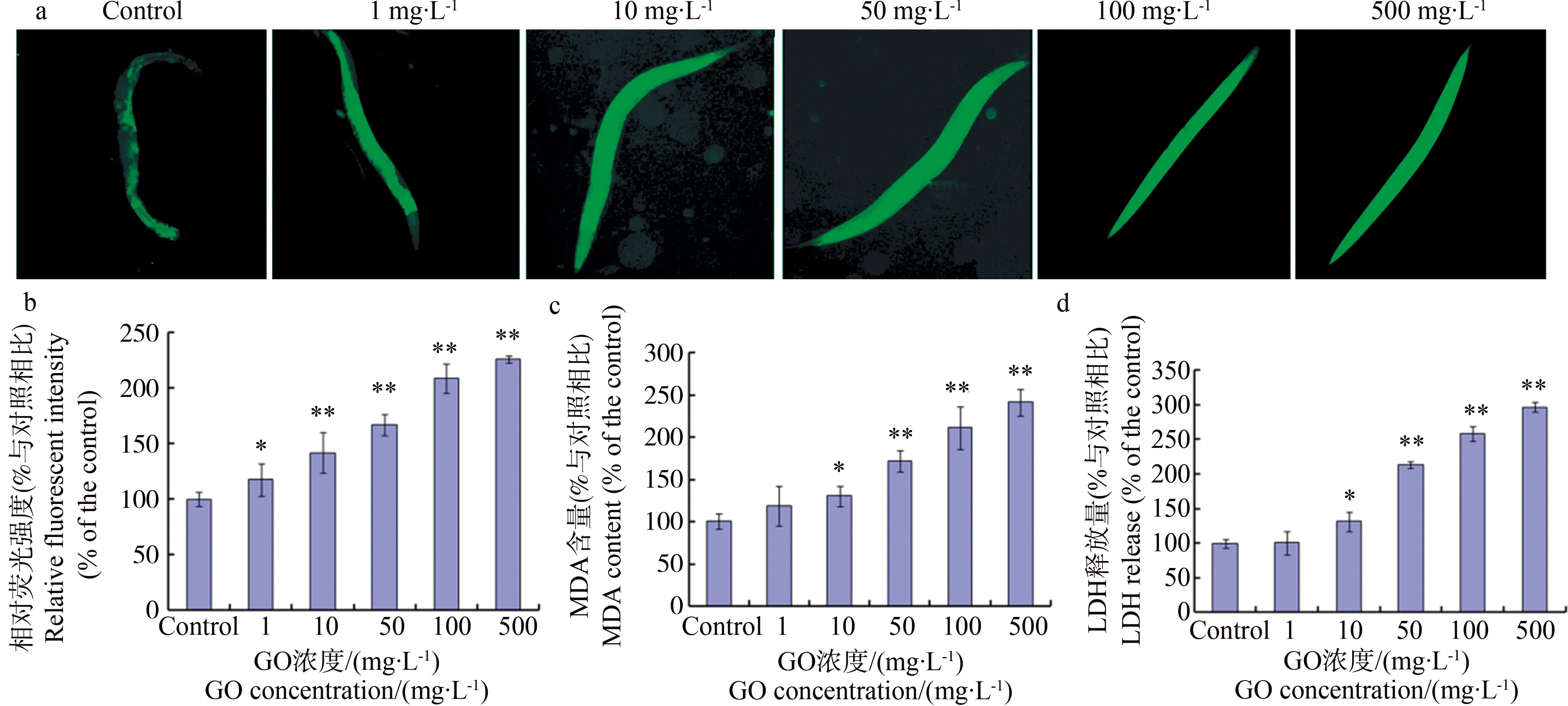
图1 氧化石墨烯(GO)对秀丽线虫机体氧化应激水平的影响注:a和b为GO对秀丽线虫活性氧簇(ROS)的诱导。*、**与对照相比有统计学意义,P<0.05、P<0.01。Fig. 1 Effects of graphene oxide (GO) exposure on intestinal oxidative stress of C. elegans Note: a and b show the intestinal production of reactive oxygen species (ROS) after GO exposure. * P<0.05 vs. control; ** P<0.01 vs. control.
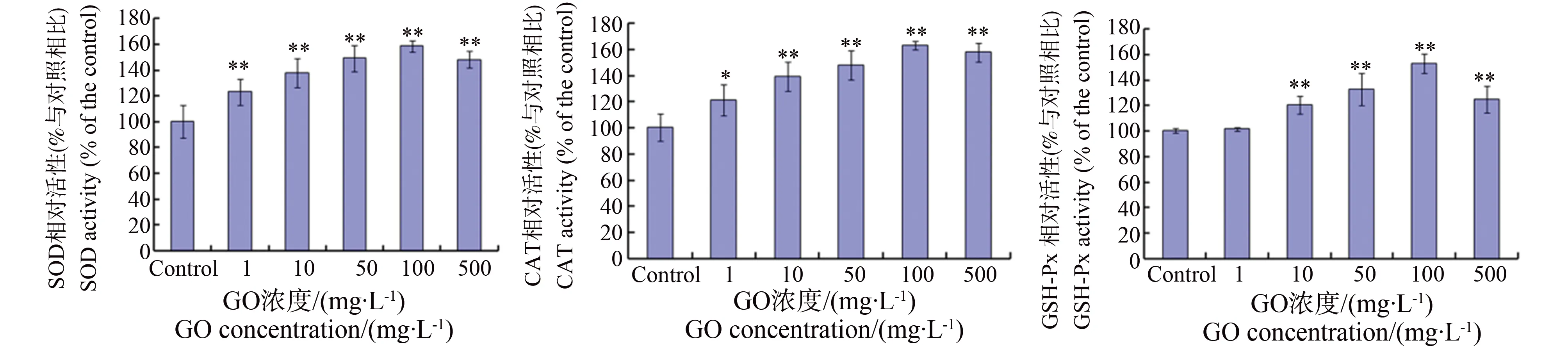
图2 GO对秀丽线虫机体抗氧化酶活性的影响注:*、**与对照相比有统计学意义,P<0.05、P<0.01。Fig. 2 Effects of GO exposure on the antioxidant enzyme levels in C. elegans Note: * P<0.05 vs. control; ** P<0.01 vs. control.
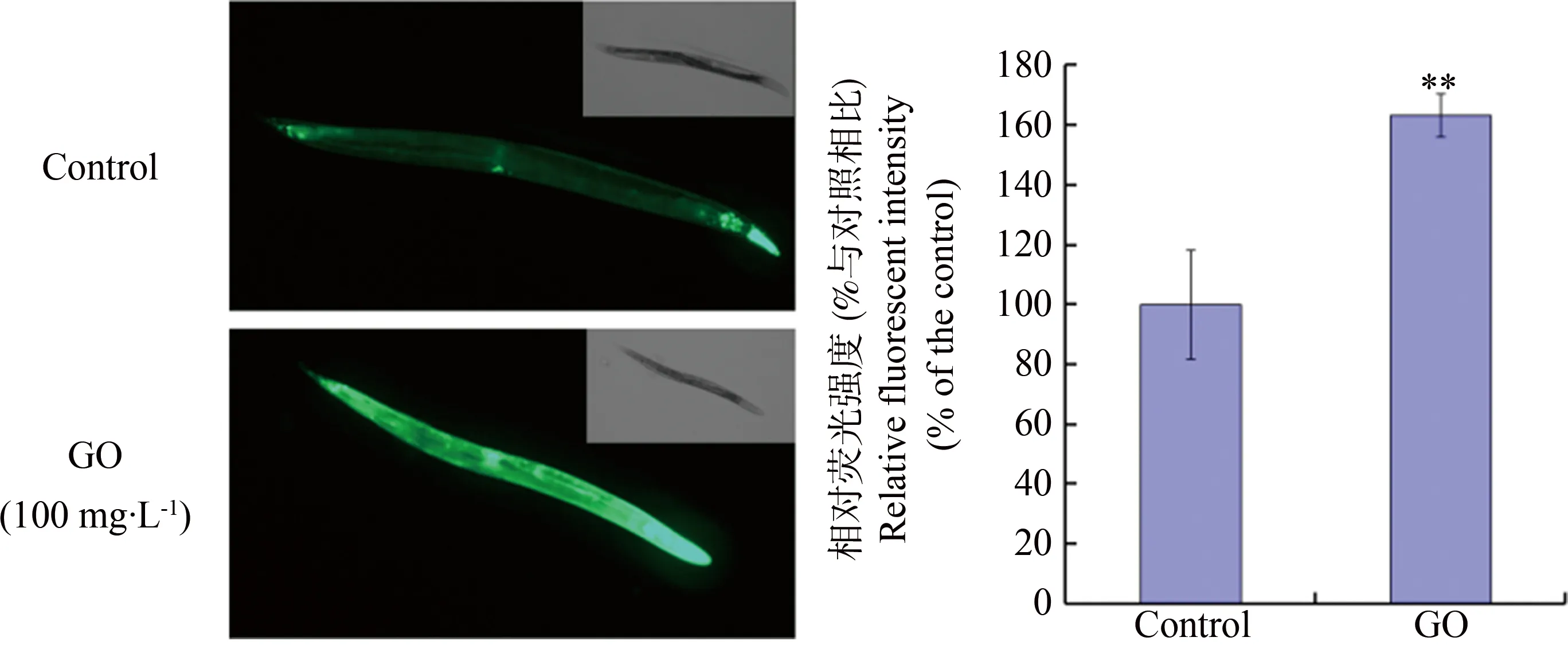
图3 GO对秀丽线虫SOD-3表达水平的影响注:**与对照相比有统计学意义,P<0.01。Fig. 3 Effects of GO exposure on the expression of SOD-3 in C. elegans Note: ** P<0.01 vs. control.
2.3 GO诱导秀丽线虫未折叠蛋白反应
qRT-PCR结果显示,100 mg·L-1GO暴露后秀丽线虫UPRER和UPRmt的指示基因hsp-4和hsp-6的表达水平均较对照有明显升高(图4a)。进一步以100 mg·L-1GO暴露内质网UPR(hsp-4作为报告基因)和线粒体UPR(hsp-6作为报告基因)的转基因秀丽线虫,暴露结束后荧光显微镜下观察。结果显示,GO暴露后,hsp-4::GFP和hsp-6:GFP秀丽线虫体内的荧光水平明显增强,说明GO可以诱导秀丽线虫UPRER和UPRmt应答(图4b)。
为进一步探讨GO诱导的UPR反应与氧化应激的关系,我们采用GSH进行抗氧化保护,然后检测秀丽线虫对GO诱导的UPR反应。结果显示,以GSH预处理秀丽线虫可以明显降低秀丽线虫UPRER和UPRmt应答代表基因hsp-4和hsp-6转录水平和蛋白水平的表达(见图4),暗示着降低氧化应激可以部分抑制UPR反应。
3 讨论(Discussion)
正常条件下,机体的氧化还原体系保持动态平衡,而外源化学物的刺激可以打破机体的这种平衡,使机体处于氧化应激状态。本研究显示GO短期暴露可以引起秀丽线虫体内氧化应激水平上升,ROS水平、MDA含量和LDH含量随着GO浓度的增加而上升(图1)。相应的,为保持机体的氧化-抗氧化体系的动态平衡、清除机体过多的自由基,秀丽线虫体内的抗氧化酶类也随之上升。在GO浓度低于100 mg·L-1时,秀丽线虫体内的SOD、GSH-Px等清除自由基和抗氧化的酶活性也随GO浓度的增加而升高,机体的氧化-抗氧化状态处于一个新的平衡(图2)。但当GO的浓度达到500 mg·L-1时,SOD和GSH-Px活性不再增加反而有所下降,可能是由于高剂量GO所致的氧化应激超出了机体抗氧化的清除能力,增加了抗氧化酶的消耗,氧化-抗氧化的平衡被打破(图2)。
在氧化应激状态下,自由基、ROS等在机体内累积,攻击蛋白质、DNA等生物大分子使其结构被破坏,造成细胞内环境稳态的失衡,进而使呼吸系统、神经系统和心肌系统出现氧化应激反应,产生相应疾病[21-22]。内质网和线粒体是细胞内重要的细胞器:内质网是真核细胞中蛋白质合成、折叠与分泌的重要场所,线粒体调控多种细胞内信号通路。环境应激会使细胞内蛋白质合成过快以至于超过蛋白折叠能力、内质网钙代谢紊乱等引发内质网应激[20];大量错误折叠或未折叠蛋白堆积在线粒体则会造成线粒体功能紊乱[15]。未折叠蛋白反应是机体通过监督和识别未正确折叠与修饰的蛋白质,引起一系列特定的靶基因转录和蛋白质翻译水平下调,从而维持细胞正常功能的一种自我保护机制[10]。hsp-4编码哺乳动物grp78/BiP的同源物,是秀丽线虫UPRER的指示[23],hsp-6编码dnak/hsp70分子伴侣超级家族成员的线粒体特异性转录因子受体,常作为UPRmt的指示[24]。研究结果提示,GO可以诱导秀丽线虫UPRER和UPRmt应答,而抗氧化剂GSH的保护可以有效降低UPRER和UPRmt应答,说明GO诱导的UPR反应是与氧化应激相关的(见图4)。Runkel等[15]发现抗氧化剂可以抑制UPRmt,潘丽等[25]发现丙烯腈(ACN)引起的大鼠肝脏氧化损伤是引起内质网应激(ERS)发生的原因之一,这与本研究结果相似。因此推测,机体在氧化应激条件下可以激活UPR应答,通过启动UPR降低机体未能正确折叠或修饰的蛋白质,进而提高机体应对和缓解应激的能力,维持机体内环境的稳定。
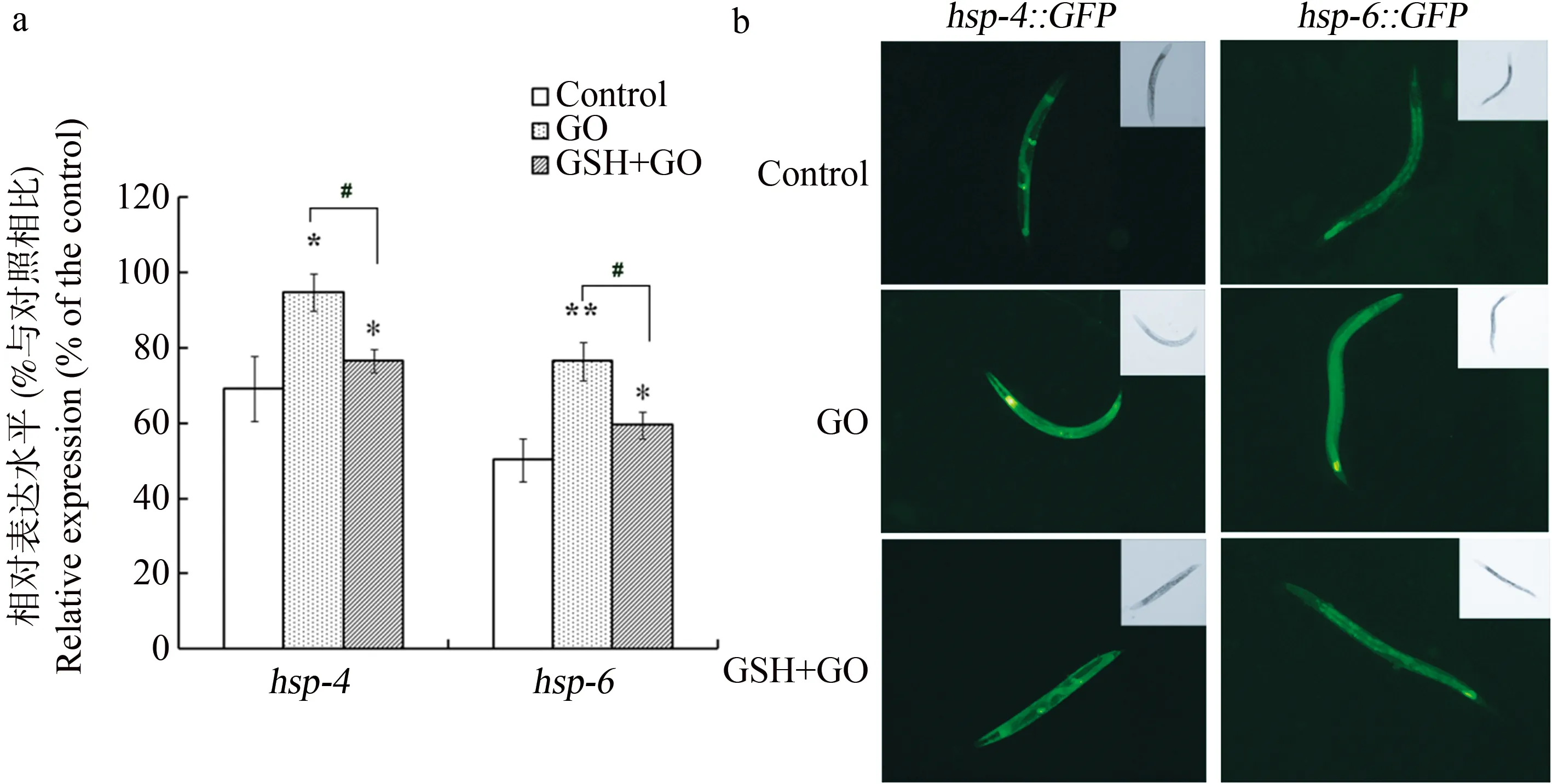
图4 GO诱导秀丽线虫未折叠蛋白反应(UPR)及谷胱甘肽(GSH)的保护作用注:a. GO对hsp-4和hsp-6转录水平的影响;b. GO对HSP-4和HSP-6蛋白水平的影响。 *、**与对照相比有统计学意义,P<0.05、P<0.01。#与GO暴露组相比有统计学意义,P<0.05。Fig. 4 The unfolded protein response (UPR) induced by GO and the protection effects of glutathione (GSH) in C. elegans Note: a. transcriptional regulation of GO on hsp-4 and hsp-6; b. effects of GO on the protein levels of HSP-4 and HSP-6. * P<0.05 vs. control; ** P<0.01 vs. control; # P<0.05 vs. GO group.
