乙虫腈悬浮剂对新出房意大利蜜蜂的毒性研究
2019-09-17牛新月齐素贞吴黎明张中印石明旺
牛新月,齐素贞,吴黎明,张中印,石明旺,*
1. 河南科技学院资源与环境学院,新乡 453000 2. 中国农业科学院蜜蜂研究所,北京 100093
蜜蜂是一种重要的经济昆虫,不仅能为人类提供多种绿色健康的蜂产品,而且蜜蜂作为重要的授粉昆虫,能够为农作物传花授粉,增加产量和质量,并且在濒危植物、绿化植被及生态保护方面都发挥着重要作用[1-5]。近年来,在世界范围内普遍发生的蜂群衰竭失调症(Colony Collapse Disorder, CCD)引起了人们对蜜蜂保护的极大关注,并进行了系统研究[6-7]。Farooqui[8]曾做过蜂群衰竭失调症的调查,发现影响蜂群发展的胁迫因子很多,包括各种外界因素(气候、温度和湿度),但更主要的原因是化学农药的滥用[9]。研究表明,有些杀虫剂可以直接造成蜜蜂死亡,有些杀虫剂虽不会直接造成蜜蜂的死亡,但长期亚致死剂量暴露下,会对蜂群生理代谢、幼虫生长发育、工蜂采集和蜂王的生殖力等行为产生消极影响,造成蜜蜂的经济效益和农业生产受损[10]。当今农业发展离不开农药,因此如何维持蜜蜂数量与种群可持续性发展,已成为全球普遍关注的生物安全问题[11]。
乙虫腈(ethiprole),化学名称(R,S)-5-氨基-1-(2,6-二氯-对三氟甲基苯基)-4-乙基亚磺(硫)酰基吡唑-3-腈基,与同类杀虫剂氟虫腈具有相似的化学结构(图1),但二者对非靶标生物的毒性却相差甚远。文献报道氟虫腈对蜜蜂、甲壳类水生生物风险较高,禁止在花期使用[12-13],而乙虫腈对非靶标生物毒性则相对较低,在中国、巴西、日本和越南等多个国家允许在水稻、玉米和大豆等粮食作物上使用[14-17]。目前国内外对乙虫腈的研究主要集中于生物活性、药效、残留分析方法、环境行为及生物体内代谢等方面[18-21],关于其对非靶标生物的毒性作用鲜见报道。
作为第二代作用于GABA受体的杀虫剂,乙虫腈对多种咀嚼式和刺吸式害虫均有良好防效,特别是极难防治的水稻害虫稻绿蝽,并且持效期长,在未来的农药市场上具有良好的发展前景。鉴于以上研究背景和乙虫腈在农业生产上的广泛使用,为进一步明确乙虫腈对蜜蜂的毒性作用,本研究选取新出房意大利蜜蜂工蜂为研究对象,测定100 g·L-1乙虫腈悬浮剂对其48 h的急性毒性和7 d、14 d的慢性毒性,并测定蜜蜂体内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽-S-转移酶(GST)和乙酰胆碱酯酶(AChE)的活力变化,以及还原型谷胱甘肽(GSH)和丙二醛(MDA)的含量变化,以期为乙虫腈对蜜蜂影响的作用机制提供参考,为乙虫腈的合理使用和风险评估提供科学依据,为新农药的开发创制提供思路。
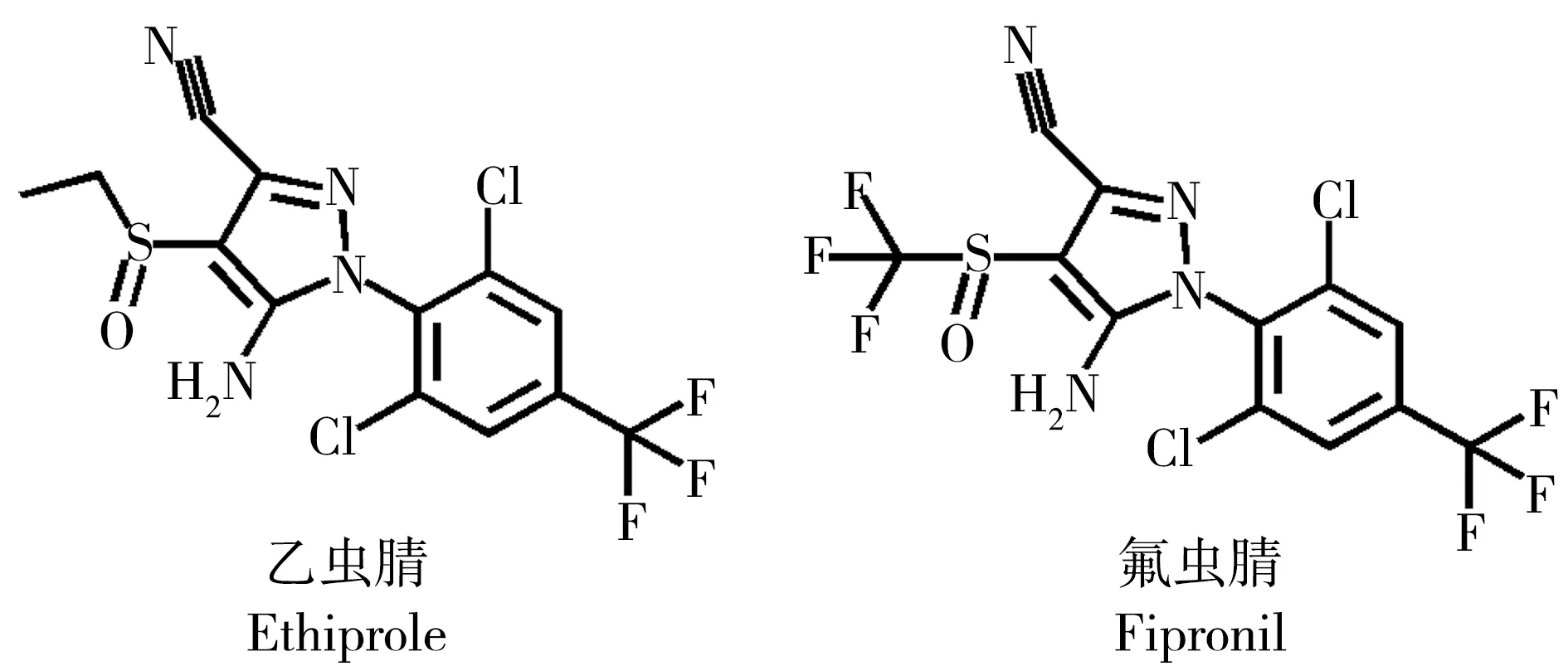
图1 乙虫腈和氟虫腈的化学结构式Fig. 1 Chemical structure of ethiprole and fipronil
1 材料与方法(Materials and methods)
1.1 供试生物
意大利蜜蜂(Apismellifera),由中国农业科学院蜜蜂研究所位于北京市北京植物园的养蜂场提供。供试物对蜜蜂的48 h急性经口毒性和7 d、14 d慢性毒性实验均采用新出房24 h内的健康工蜂。
1.2 实验仪器与试剂
供试药剂:100 g·L-1乙虫腈悬浮剂,商品名酷毕,德国拜耳生产。
供试材料:Bradford蛋白浓度测定试剂盒(P006),购自上海碧云天生物技术有限公司;超氧化物歧化酶测定试剂盒(SOD, A001-3)、过氧化氢酶测定试剂盒(CAT, A007-2)、谷胱甘肽-S-转移酶测定试剂盒(GST, A004)、还原型谷胱甘肽测定试剂盒(GSH, A006)、丙二醛测定试剂盒(MDA, A003-1)、乙酰胆碱酯酶测定试剂盒(AChE, A024),均购自南京建成生物工程研究所。
所需仪器:智能人工气候箱(RXZ-380C,中国,宁波江南仪器制造厂)、医用低温保存箱(DW-86L626Haier,中国,青岛海尔特种电器有限公司)、研磨杵(300114,中国,天根生化科技(北京)有限公司)、离心机(TGL-20M,中国,湖南湘仪动力测试仪器有限公司)、酶标仪(Spectra Max®i3,中国,美谷分子仪器(上海)有限公司)、紫外可见分光光度计(UV-1800PC,中国,上海美谱达仪器有限公司)。
1.3 蜜蜂的急性经口毒性测定方法
根据文献中报道的饲喂法[22-23]测定100 g·L-1乙虫腈悬浮剂对出房蜂的急性经口毒性。首先用蒸馏水将乙虫腈悬浮剂溶解配制成100 mg·L-1的母液,然后用50%的蔗糖水将母液分别稀释为0.05、0.10、0.20、0.40和0.80 mg·L-1实验药液。实验开始前,将蜂脾中的新出房蜂转移至贮蜂笼内,每笼中10只蜜蜂,饥饿2 h后,采用2 mL注射器吸取1.0 mL实验药液悬挂于蜂笼饲喂孔中连续饲喂48 h,观察记录48 h后蜜蜂死亡和中毒情况、累积食物摄入量并计算48 h-LC50值(mg·L-1)和48 h-LD50值(μg a.i.·蜂-1)[23-24]。每个处理3个重复,以不含药剂的50%的蔗糖溶液为空白对照(CK)。
1.4 蜜蜂的慢性毒性测定方法
参照Kling和Schmitzer[25]报道的意大利蜜蜂慢性毒性实验方法,采用饲喂法测定100 g·L-1乙虫腈悬浮剂对蜜蜂的7 d和14 d慢性毒性。根据乙虫腈悬浮剂对蜜蜂的急性饲喂浓度和预实验,慢性毒性的最终实验浓度为1×10-5、1×10-4、1×10-3mg·L-1,以50%蔗糖溶液为空白对照(CK)。每个浓度处理分2组进行,每组2个蜂笼,将每20只新出房的蜜蜂转移至一个贮蜂笼内,按1 mL·笼-1·d-1的给药量连续饲喂,一组饲喂7 d后收集蜜蜂头部和腹部样品,另一组饲喂14 d后收集蜜蜂头部和腹部样品。样品收集时每3只蜜蜂头部为一个样品处理,每2只蜜蜂腹部为一个样品处理,-80 ℃冻存用于后续生化指标测定。实验过程中每天测定各贮蜂笼内试验药液的消耗量,观察蜜蜂的死亡情况并更换新配制的实验药液。蜜蜂在人工气候培养箱内的饲养温度为(27±1) ℃,相对湿度50%,无光照。
1.5 蜜蜂组织粗酶液的制备及生化指标的测定
蜜蜂组织粗酶液的制备参照李梦[26]的方法及试剂盒说明书。准确称量蜜蜂头或腹部组织样品,按质量(g)∶体积(mL)=1:9,加入生理盐水,震荡5 s后冰上研磨,破碎匀浆后4 500 r·min-1离心10 min。取上清液转移至新的离心管中,采用Bradford蛋白浓度测定试剂盒测定粗酶液中的蛋白浓度,随后根据试剂盒说明用于目标酶活力和物质含量变化的测定。蜜蜂腹部样品的具体测定指标为SOD、CAT和GST酶活力,以及GSH和MDA含量变化;蜜蜂头部样品测定指标为AChE酶活力;每个指标的测定浓度组设置3个样品处理。每个实验重复2次。
1.6 数据分析
采用SPSS17.0 Probit分析方法计算乙虫腈100 g·L-1悬浮剂对蜜蜂的48 h-LC50和48 h-LD50值及95%置信区间。慢性毒性实验中,实验结果均以平均值±标准差(Mean±SD)表示,并用Graphpad prism 6.0软件进行单因素方差分析(One-way ANOVA),采用Tukey’s HSD检验比较处理组与对照组之间的差异,当P<0.05(*)、P<0.01(**)时表示差异显著。
2 结果与分析(Results and analysis)
2.1 乙虫腈悬浮剂对新出房意大利蜜蜂的急性毒性
经过48 h连续饲喂后,意大利蜜蜂有明显的中毒症状,包括行动缓慢、仰躺、颤抖、取食减少和反应迟钝等,且死亡率随乙虫腈暴露浓度的增加而增加,死亡蜜蜂身体蜷缩、翅膀呈“一”或“V”字形展开。10%乙虫腈悬浮剂对新出房意大利蜜蜂的48 h-LC50值为0.21 mg·L-1,95%置信区间为0.16~0.26 mg·L-1,线性相关系数为0.965;相应的48 h-LD50值为5.0×10-3μg a.i.·蜂-1,95%置信区间为1.0×10-3~1.0×10-2μg a.i.·蜂-1,线性相关系数为0.867。具体实验结果见表1。
2.2 乙虫腈悬浮剂对新出房意大利蜜蜂的慢性毒性
乙虫腈悬浮剂对新出房意大利蜜蜂亦有一定的慢性毒性作用。如图2所示,经过7 d连续饲喂蔗糖溶液后,对照组中蜜蜂无死亡,处理组中蜜蜂的死亡数量随暴露浓度的增加而逐渐增加,累积死亡数最高为6(10-4mg·L-1处理组),占总处理蜜蜂的30%,显著高于对照组。同时,每个蜂笼中的累积摄食量呈现下降趋势,与对照相比(3.1 g),在10-5、10-4和10-3mg·L-1处理组中的蜜蜂的累积摄食量分别下降了25.2%(显著)、1.94%(不显著)和22.6%(显著)。
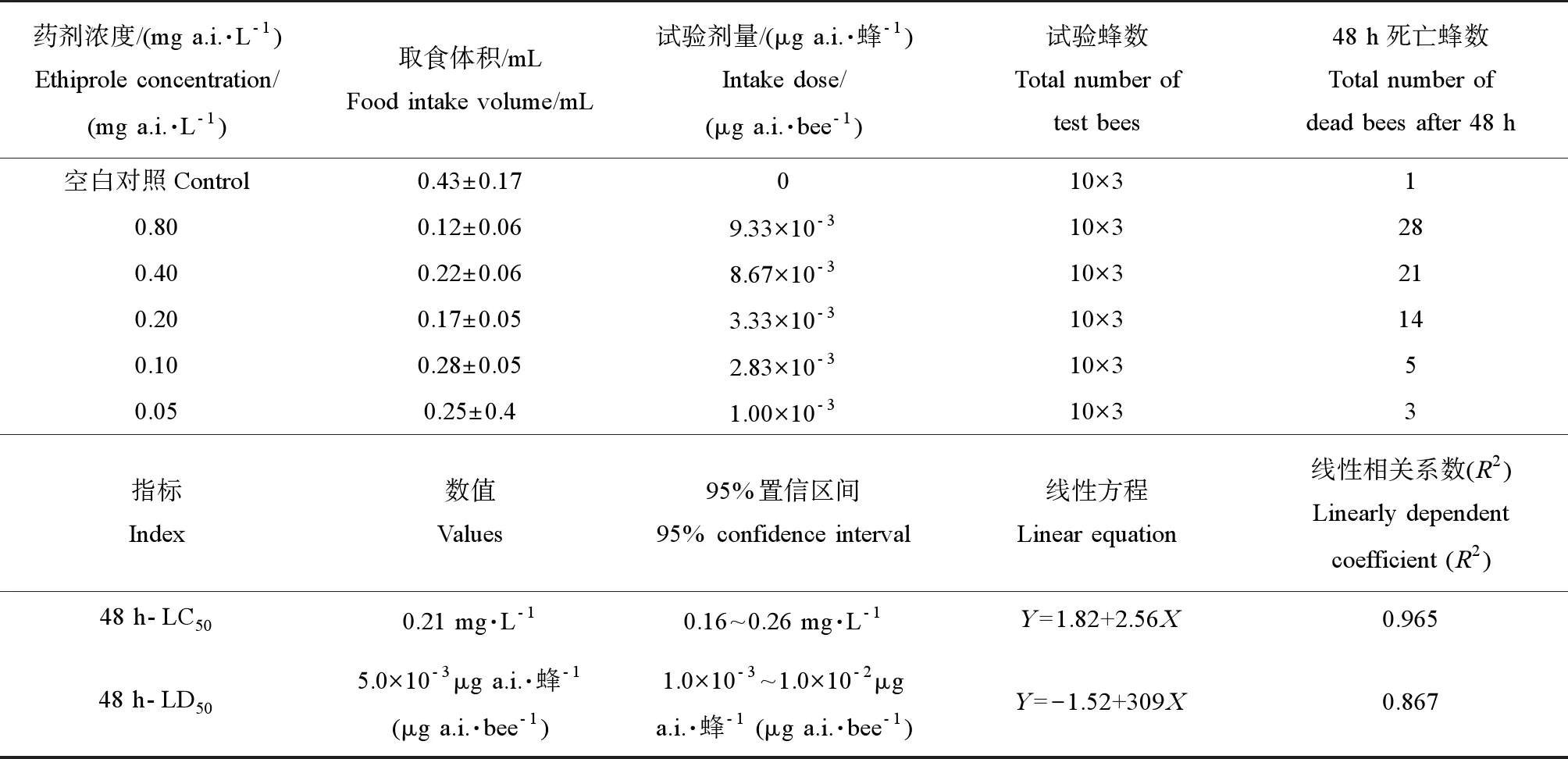
表1 10%乙虫腈悬浮剂对蜜蜂的48 h急性经口毒性实验结果Table 1 Acute oral toxicity of 10% suspension concentrate (SC) of ethiprole to honey bees after 48 h exposure
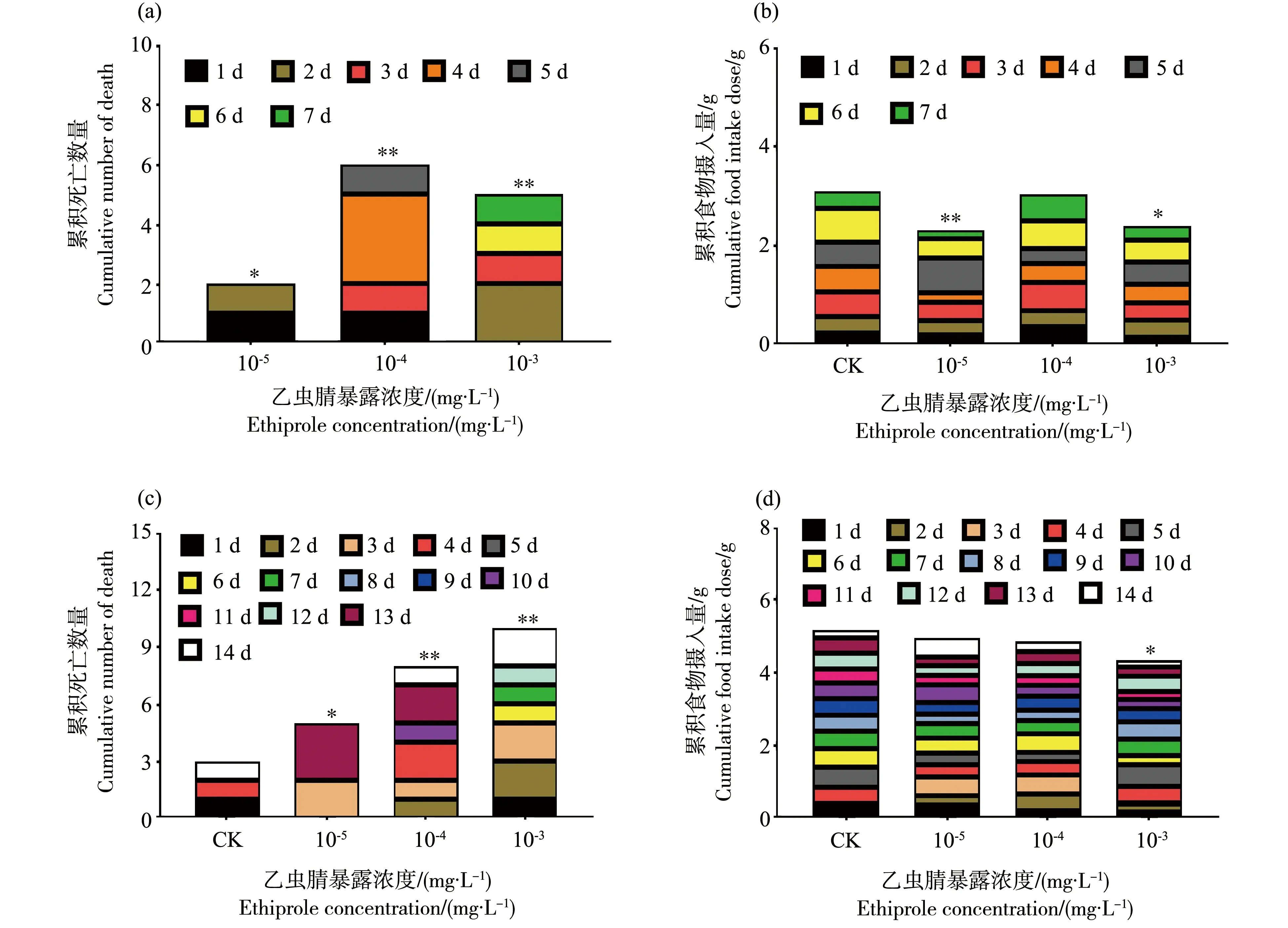
图2 10%乙虫腈悬浮剂连续饲喂对意大利蜜蜂成蜂死亡和摄食量的影响Fig. 2 Effect of 10% SC of ethiprole on mortality and food intake of adult bee of Apis mellifera L.
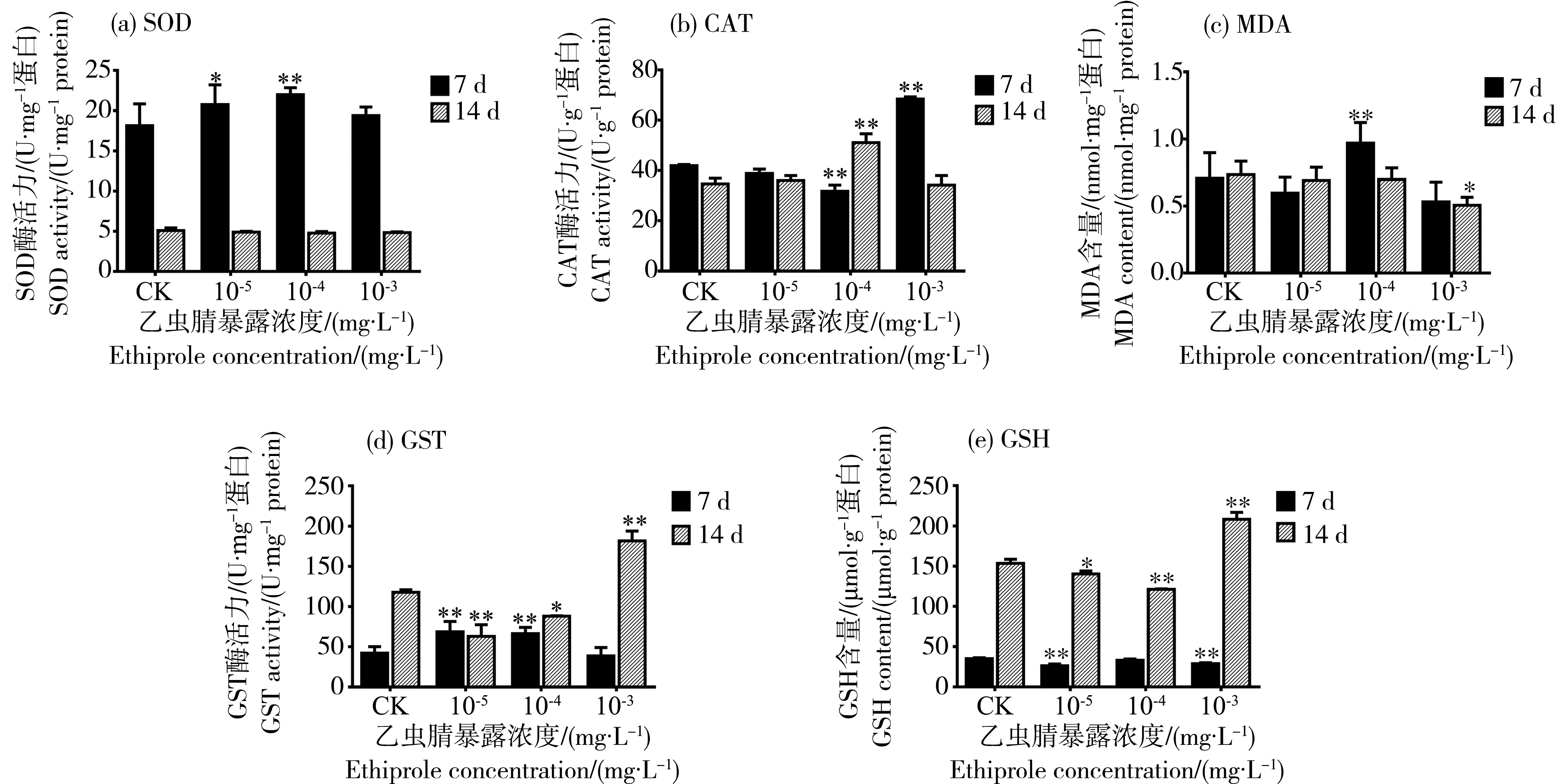
图3 乙虫腈悬浮剂对蜜蜂腹部关键酶活性及产物含量变化的影响Fig. 3 Effects of 10% SC of ethiprole on the activities of key enzymes and content of products in bees’ abdomen
随着连续饲喂的时间延长至14 d时,蜜蜂累积死亡数量呈现显著性上升,在对照及3个处理组中的累积死亡数量分别为3、5、8和10只;每个蜂笼的累积摄食量也呈现逐渐下降的趋势,但整体下降趋势不明显,在最高浓度10-3mg·L-1处理组中的累积摄食量为4.34 g,相当于对照组(5.18 g)的89.3%,表现为显著性降低。
2.3 乙虫腈悬浮剂对意大利蜜蜂腹部关键酶活性和产物含量的影响
当蜜蜂连续摄入含乙虫腈悬浮剂的糖水后,其腹部各种抗氧化和解毒酶活力均受到了一定的影响。由图3(a)可知,经含乙虫腈的50%蔗糖水连续饲喂7 d后,蜜蜂腹部组织的SOD酶活力显著上升,与对照相比,在10-5mg·L-1和10-4mg·L-1处理组中的上升比例分别为15%和21%,10-3mg·L-1处理组中则变化不显著。当饲喂时间延长至14 d时,与对照组相比,各处理组中蜜蜂腹部SOD酶活力没有发生显著变化。
与SOD变化不同,CAT酶活力在7 d时先下降后上升,14 d时则呈现先上升后下降的趋势(图3(b)),转折点均在10-4mg·L-1,7 d和14 d时其处理组中的CAT酶活力分别为(31.74±2.46) U·g-1protein、(51.03±3.60) U·g-1protein。
用乙虫腈悬浮剂连续饲喂蜜蜂后,其腹部MDA含量的变化见图3(c)。由图可知,MDA含量在7 d和14 d处理组中均呈先升后降的趋势。在连续饲喂7 d时,MDA含量在10-5和10-3mg·L-1处理组中与对照组中的(0.71±0.11) nmol·mg-1protein相比变化不显著,10-4mg·L-1处理组中MDA含量为(0.97±0.05) nmol·mg-1protein,显著高于对照组。当连续饲喂时间延长至14 d时,在10-5和10-4mg·L-1处理组中MDA含量与对照相比无显著变化,而高浓度10-3mg·L-1处理组中其含量显著下降,仅为(0.51±0.06) nmol·mg-1protein。
GSTs是昆虫解毒代谢杀虫剂的一类关键酶。由图3(d)可知,经过乙虫腈悬浮剂的饲喂处理后,蜜蜂腹部组织内的GST活力显著上升。处理7 d时,在10-5和10-4mg·L-1处理组中,蜜蜂腹部组织的GST酶活力分别是(68.76±2.80)、(66.52 ±4.58) U·mg-1protein,相比对照组的(42.22±3.96) U·mg-1protein,显著上升了61%和63%;在10-3mg·L-1处理组中,GST酶活力是(38.70±4.37) U·mg-1protein,与对照组无显著差异。当乙虫腈悬浮剂连续饲喂14 d时,所有处理组中GST酶活力均与对照差异显著,在10-3mg·L-1处理组中活力最高,为(181.57±12.34) U·mg-1protein,是对照组(117.64±3.28) U·mg-1protein的1.5倍。
GST是一类催化GSH与各种亲电化合物亲核加成反应的酶,GST的活力变化会直接引起GSH的含量发生变化,用乙虫腈悬浮剂饲喂蜜蜂后,其腹部组织内的GSH含量变化见图3(e)。由图可知,GSH含量在7 d时显著下降,但下降趋势较缓。在14 d时,与对照组的(153.44±5.23) μmol·g-1protein相比,GSH含量在10-5和10-4mg·L-1处理组中显著下降,分别为(140.44±3.57) μmol·g-1protein和(121.22±0.65) μmol·g-1protein;但在10-3mg·L-1处理组中,GSH含量则显著上升为(208.06±8.88) μmol·g-1protein,是对照组的1.4倍。
2.4 乙虫腈悬浮剂对意大利蜜蜂头部AChE活性的影响
乙虫腈悬浮剂对意大利成蜂头部AChE活性的影响结果如图4所示。处理7 d时,与对照组相比,处理组意大利蜜蜂头部AChE酶活力无显著变化,仅在10-4mg·L-1处理组中显著下降,下降比例为28%。在14 d时,意大利蜜蜂头部AChE酶活力在10-5mg·L-1和10-4mg·L-1处理组中无显著变化,而在10-3mg·L-1处理组中呈现显著上升,酶活力比值为(2.83±0.32) U·mg-1protein,是对照组(0.67±0.17) U·mg-1protein的4.2倍。
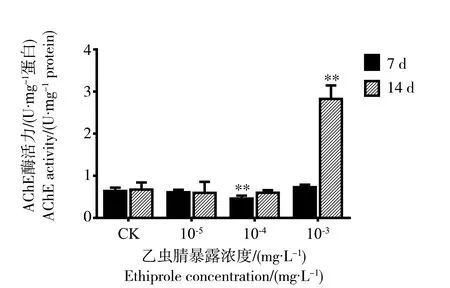
图4 乙虫腈悬浮剂对蜜蜂头部AChE酶活性变化的影响Fig. 4 Effects of ethiprole 10% SC on AChE activity changes in bees’ head at different exposure time points
3 讨论(Discussion)
3.1 乙虫腈悬浮剂对新出房意大利蜜蜂的毒性效应
苍涛等[27]评估了手性乙虫腈对3种非靶标生物的急性毒性,发现乙虫腈外消旋体及2个对映异构体对意大利蜜蜂的48 h-LD50值分别为0.0187、0.0181和0.0188 μg·蜂-1,三者之间无显著性差异。拜耳公司发布的数据显示100 g·L-1乙虫腈悬浮剂对蜜蜂的48 h接触LD50为0.067 μg a.i.·蜂-1,48 h经口LD50为0.015 μg a.i.·蜂-1[28]。根据我国农药对蜜蜂毒性的分级标准,乙虫腈及其制剂对蜜蜂的接触和经口毒性均为高毒,具有高风险。本研究中10%乙虫腈悬浮剂对新出房意大利蜜蜂的48 h经口LC50为0.21 mg·L-1,根据蜜蜂取食的糖水体积换算后相应的48 h-LD50值约为5.0×10-3μg a.i.·蜂-1,95%置信区间为1.0×10-3~1.0×10-2μg a.i.·蜂-1,说明10%乙虫腈悬浮剂对新出房意大利蜜蜂的急性毒性同样为高毒。如前所述,乙虫腈为苯基咪唑类的二代杀虫剂,是一代杀虫剂氟虫腈的良好替代药剂,氟虫腈对蜜蜂等传粉昆虫具有很高的风险,Bovi等[29]测定了乙虫腈对非洲地区意大利蜜蜂的24 h摄入和接触LD50分别为(0.2316±0.0626)和(0.0080±0.0021) μg·蜂-1,与本研究中乙虫腈对新出房意大利蜜蜂的毒性相近。各研究中报道数据的差异可能与实验用蜂、暴露及分析方法等因素的不同相关。
蜜蜂的个体生长需要经历卵、幼虫、蛹和成虫4个阶段,当蜜蜂成虫在蛹体内发育完全时便咬破巢房蜡盖羽化出房,随后经过数天的再发育,出房蜂体内各器官发育成熟,才成为我们常见到的工蜂,因此出房蜂的数量和健康是保证蜂群健康发展的关键之一[30]。在我国及经济合作与发展组织(OECD)现行的化合物环境安全评价准则中,蜜蜂毒性试验所采用的试材均为成年工蜂,通常指常见的采集蜂,这在很大程度上可以反映药剂对蜂群的综合毒性和风险。但比较本研究中的急性结果与报道数据可以发现,新出房意大利蜜蜂可能对乙虫腈更敏感,可以在低剂量下反映出药剂对其的毒害作用。而同样对蜜蜂毒性较高的新烟碱类杀虫剂而言[31-32],岳孟[33]指出,在意大利蜜蜂的成蜂阶段,随着日龄的增加其对噻虫嗪的敏感性也增加,其中采集蜂对噻虫嗪最敏感(48 h-LC50=20.019 μg·g-1),新出房蜂最不敏感(48 h-LC50=50.371 μg·g-1),吡虫啉具有类似作用效果(新出房蜂:48 h-LC50=48.740 μg·g-1;采集蜂:48 h-LC50=19.276 μg·g-1),因此新出房意大利蜜蜂对不同药剂的敏感性差异及机制还有待研究。鉴于新出房蜂在蜂群发展中的衔接作用、对药剂的敏感性和实验操作的安全性,在未来对化合物的安全性评价尤其是风险评估研究上,可考虑将新出房蜜蜂作为对化合物毒性评估的早期预警实验生物之一。
3.2 乙虫腈悬浮剂引起意大利蜜蜂工蜂的氧化应激反应
活性氧(reactive oxygen species, ROS)是生物体内重要的氧自由基,主要包括过氧化物(H2O2)、超氧化物阴离子(O2-)、羟自由基(HO-)、氮氧化物(NOx)等,在正常状态下,生物机体内的自由基浓度很低且处于平衡状态,发挥着重要的生理功能。但是当环境中的物理因素或外源化学物质直接或间接对生物体产生胁迫时,会诱导机体产生大量氧自由基,当其含量超过机体的清除能力时便会产生氧化损伤,造成机体损伤、抵抗力下降而死亡[34]。
昆虫体内的抗氧化酶主要包括SOD、CAT、GSH-Px(谷胱甘肽过氧化物酶)、GR(谷胱甘肽还原酶)、GST(谷胱甘肽-S-转移酶)等,面对各种胁迫时,昆虫体内自由基大量产生,各抗氧化酶发挥协同作用清除自由基(图5),避免造成更严重的不可挽回的损伤[35]。
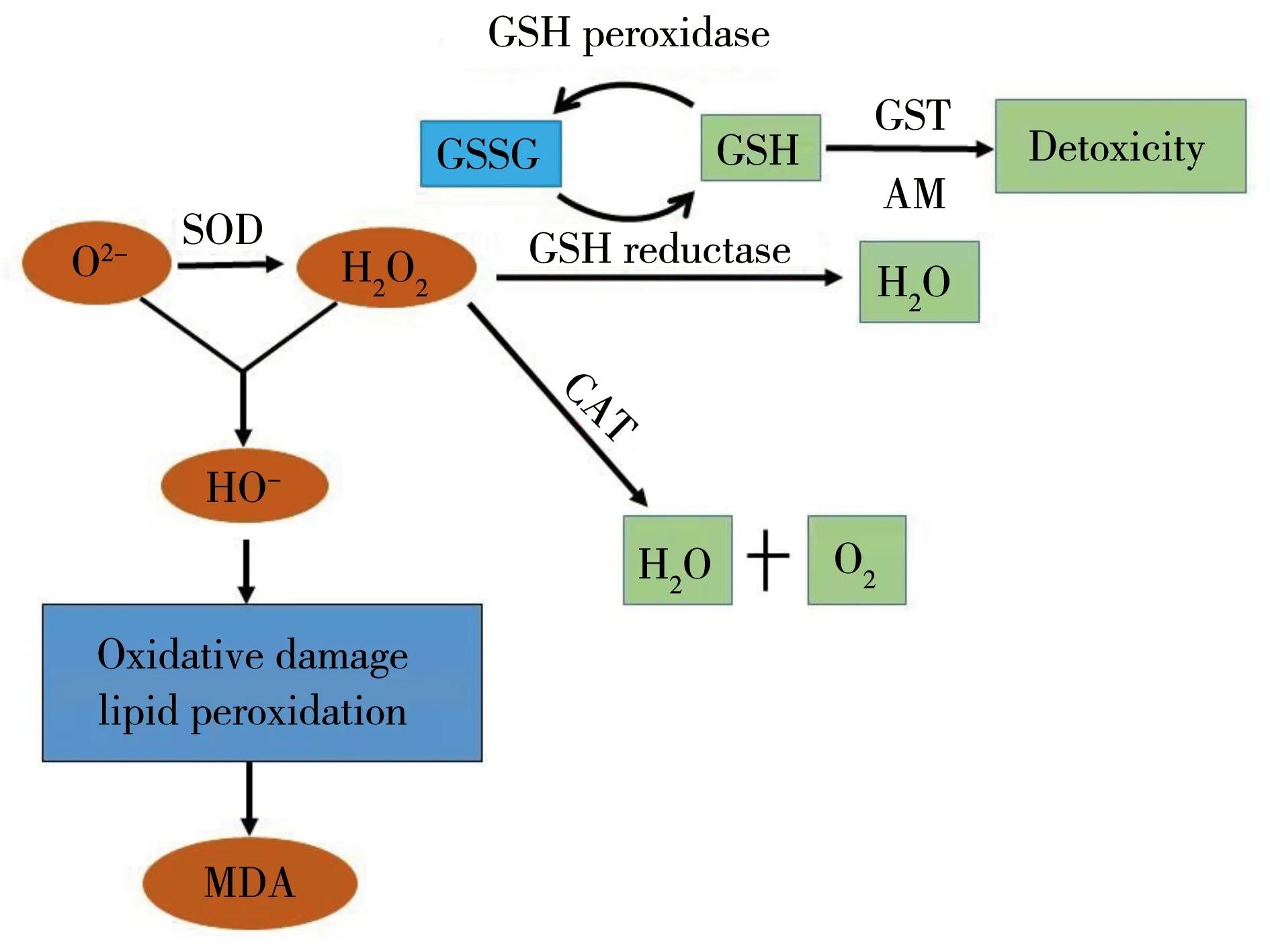
图5 生物体内氧自由基清除机制示意图注:SOD为超氧化物歧化酶;CAT为过氧化氢酶; GST为谷胱甘肽-S-转移酶;MDA为丙二醛;GSH为还原型 谷胱甘肽;GSSG为氧化型谷胱甘肽;AM为外源性物质。Fig. 5 Schematic diagram of reactive oxygen species (ROS) deletion in organisms Note: SOD stands for superoxide dismutase; CAT stands for catalase; GST stands for glutathione S-transferase; GSH stands for reduced glutathione; GSSG stands for oxidized glutathione; MDA stands for malondialdehyde; AM stands for allogenic material.
在本研究中,经过7 d和14 d的连续饲喂,10%乙虫腈悬浮剂引起蜜蜂腹部组织中的SOD、CAT和GST 3种抗氧化酶活力的显著变化,说明其对蜜蜂形成了一定的氧化胁迫。结果显示,7 d时SOD和CAT的酶活力显著上调,在14 d时则变化不显著,这说明在乙虫腈造成的氧化胁迫中,SOD和CAT可能在初期发挥着更重要的作用,积极清除O2-,降低损伤。
GST是生物体内重要的Ⅱ相解毒酶,其一方面可通过催化GSH与有毒疏水亲电物质的轭合反应而达到解毒目的,另一方面可通过提高抗氧化酶活性而降低氧化损伤[36-38]。用乙虫腈悬浮剂饲喂蜜蜂7 d后,蜜蜂腹部组织内的GST酶活力在较低浓度组中(10-5和10-4mg·L-1)呈上升趋势,高浓度组(10-3mg·L-1)中则有所降低,GSH的含量先下降后上升,推测GST在此阶段可能直接通过代谢解毒作用而积极减少乙虫腈悬浮剂在蜜蜂体内的累积而降低损伤;在14 d时,蜜蜂腹部GST和GSH均呈现先缓慢下降后急剧上升的趋势,结合SOD和CAT酶活力的基本无显著变化,推测在长期亚致死剂量的累积暴露下,O2-经过SOD和CAT的转化后造成H2O2的过量累积,随之可能同时激活了GST催化的GSH与外源物质结合的解毒机制与GSH-GSSG的氧化还原,维持生物体机能平衡,降低胁迫危害。
在生物体内,ROS可与生物膜中的多不饱和脂肪酸和核酸等大分子发生脂质过氧化反应,MDA是脂质过氧化的最终产物,是反映机体受氧化损伤程度的重要标志物[39]。乙虫腈悬浮剂暴露处理后,蜜蜂腹部组织中MDA含量仅在7 d时于10-4mg·L-1处理组中上升26%,在14 d时于10-3mg·L-1处理组中下降22%,但整体变化趋势不剧烈,且在其他处理组中MDA含量均维持在对照水平,说明用乙虫腈悬浮剂连续饲喂蜜蜂后,可引起一定的脂质过氧化,但不严重。已有研究证明,将蝌蚪暴露于35、120和180 μg·kg-1剂量的氟虫腈7 d,蝌蚪体内的GST、葡萄糖-6-磷酸脱氢酶(G6PDH)、CAT酶活力和MDA含量均受到显著影响,造成了显著的氧化胁迫压力[40]。未来可增加观测时间和检测指标种类,评估乙虫腈是否会引起蜜蜂体内显著的脂质过氧化。
3.3 乙虫腈悬浮剂影响意大利蜜蜂AChE活性
在田间生态环境下,农药残留水平较低但对蜜蜂造成的慢性危害并不亚于急性致死毒性。在实验室条件下,Williamson和Wright[41]指出,吡虫啉、蝇毒磷可造成蜜蜂嗅觉学习与记忆能力下降。Henry等[42]研究发现,蜜蜂接触亚致死剂量噻虫嗪后,蜜蜂的定位、采集和归巢等日常活动均受干扰。Colin等[43]发现神经毒剂杀虫剂能够引起蜜蜂运动功能失调,如浑身颤抖、动作紊乱等表象。新烟碱类杀虫剂作用靶标为乙酰胆碱受体(nAChR),而AchE是催化乙酰胆碱(Ach)水解为胆碱的关键酶,在昆虫中枢及外周神经系统中参与神经冲动的正常传递[44-46],常作为农药检测的生物标记使用。AChE属于丝氨酸水解酶,在正常情况下,神经冲动传导至突触前膜后释放ACh,一部分与突触后膜上的AChR结合,改变酶的通透性,产生兴奋性突触后电位(EPSP),继而传导信号;使用药剂后,AChE被抑制,造成酶的磷酰化或氨基甲酰化,酶的活性被钝化不能正常水解ACh,最终造成神经阻塞。此外,AChE对肽类物质的代谢和细胞的发育、神经元电活动,乃至神经再生发挥着重要的调节作用[47]。蜜蜂头部富含AChE,其在蜜蜂的学习、记忆和运动等方面都发挥着重要的作用。在意大利蜜蜂的的工蜂和蜂王蛹发育后期,AChE的活性逐渐增加,出房蜂有最大值,新出房的蜜蜂的可溶性AChE (sAChE)和膜结合AChE(mAChE)的活性都是最高的[45-46]。苯基吡唑类杀虫剂的作用靶标为昆虫的γ-氨基丁酸(GABA)受体,干扰神经系统门控氯离子通道,造成昆虫神经和肌肉的过度兴奋而死亡[47-48],虽然此类杀虫剂的直接作用靶标不是AChE,但其对昆虫神经系统造成的影响可在一定程度上反应在AChE活性上。
本文发现,亚致死剂量下乙虫腈悬浮剂暴露处理意大利蜜蜂14 d后,其头部组织中的AChE活性在10-3mg·L-1处理组中显著升高,说明乙虫腈可显著诱导AChE活性,进而干扰蜜蜂的神经传递,诱发蜜蜂行为的改变。目前关于乙虫腈对意大利蜜蜂神经毒性作用几乎未见报道,但Zaluski等[49]研究发现,氟虫腈对意大利蜜蜂毒性高,致死或亚致死剂量的氟虫腈(8 μg·L-1)均可抑制蜜蜂的活动,表现为蜜蜂活动量减少,抽搐、抖动和麻痹等;在蜂巢中饲喂含8 μg·L-1氟虫腈的糖浆时,蜂群中孵化卵、幼虫和蛹的数量以及巢脾上工蜂的覆盖率均显著下降,采集蜂表现为嗜睡无力,蜂群发展受抑制。同时,在田间暴露下,Zaluski等[50]发现,2.5 μg·L-1的氟虫腈与850 μg·L-1的唑菌胺酯联合暴露6 d大大降低了工蜂下颚腺的分泌细胞数量和储液体积,二者共同作用下咽下腺中总腺泡数量没有受到影响,但却显著减少了大腺泡数量,同时增加了小腺泡的数量,进而减少了工蜂蜂王浆的分泌量,阻碍蜂群健康发展。此外,对于同科不同属的无刺蜂(MeliponascutellarisLatreille),de Morais等[51]发现,氟虫腈对其的24 h-LD50为0.40 (0.235~0.710) ng a.i.·蜂-1,当在0.40、0.040、0.0040 ng a.i.·蜂-1剂量下对采集蜂进行点滴处理后发现,受试蜂的平均爬行速度显著下降,还可引起蜜蜂昏睡、行动困难、麻痹及过度兴奋和攻击行为,更值得关注的是在最低剂量0.0040 ng a.i.·蜂-1下处理24 h,受试蜂的蘑菇体和触角神经叶中均观测到明显的细胞核异染色体分布和移除,细胞核、细胞器及细胞死亡等均可能引起蜜蜂大脑退化,影响其学习、记忆等功能,最终影响蜜蜂生存和蜂群发展。推测乙虫腈可能具有相似的作用效果,未来可进一步测定10%乙虫腈悬浮剂在田间生产环境中的实际残留水平,并在此水平上完善其对蜜蜂行为、生理机能、神经毒性和基因毒性的风险评估。
