圣愈汤联合放射治疗对人宫颈癌荷瘤小鼠脾脏 DCs 细胞功能的影响*
2019-09-17孙立哲李磊强耿翠翠刘宝刚
孙立哲,李磊强,耿翠翠,张 杨,刘宝刚
陕西中医药大学第二附属医院(咸阳 712000)
圣愈汤出自清代吴谦编写的《医宗金鉴》,由熟地、白芍、川芍、当归、人参、黄芪组成,是益气补血的常用方。在临床中也有不少医生用本方来辅助治疗恶性肿瘤,改善患者放疗后的机能状况,提高免疫力[1]。在肿瘤免疫治疗中,树突状细胞(DCs)在其中起着关键的作用 ,DCs能通过识别肿瘤细胞特异性抗原,与T淋巴细胞结合并激活 T 细胞增殖,诱导细胞毒性T淋巴细胞(CTLs)生成,介导Th1型免疫应答 ,起到监测、杀灭肿瘤的功能[2-3]。本研究观察了圣愈汤联合放疗对荷瘤小鼠脾脏DCs活性、细胞因子分泌的影响。
资料和方法
1 材 料 健康6~7周龄雌性昆明种小鼠,体重 18-22 g,购自陕西中医药大学实验动物中心。 宫颈癌Hela细胞株购自中科院细胞库。圣愈汤生药饮片 (熟地黄、 白芍、当归、川芎、人参、黄芪)购于仁和大药房,按人参 (用生晒参)9 g, 黄芪20 g, 熟地、 白芍各 15 g, 当归、 川芎各 10 g 的比例,取中药浸泡 1 h, 文火煎煮约 1 h, 过滤并浓缩至生药 1 g/ml,无菌分装, 置于 4 ℃冰箱保存。CD11c、CD86、 MHC-Ⅱ等流式检测抗体购自eBioscience公司,ELISA 检测试剂盒购自 R&D 公司,LDH 试剂盒购自 Thermo 公司,磁珠分选系统购自 BD 公司。放疗设备为大恒公司6MV-X线治疗机。
2 研究方法
2.1 Hela细胞培养:人宫颈癌Hela细胞株,购自中科院细胞库。使用含10%小牛血清的髙糖DMEM培养基,置于37℃、5%的CO2饱和湿度的培养箱内培养传代。使用接种后处于对数生长期的细胞作为实验细胞。
2.2 小鼠宫颈癌模型的建立:取健康昆明种小鼠,复苏传代Hela细胞株,待Hela细胞生长至5×109/ml时胰酶消化,培养基终止消化,离心取沉淀,计数后调整细胞密度。采用细胞悬液皮下种植法制备荷瘤鼠模型,小鼠双侧大腿内侧皮下接种细胞悬液0.2 ml(约1×108个/ml细胞),隔天观察小鼠皮下宫颈癌的成瘤及生长情况,直至肿瘤大小约为5 mm×5 mm×5 mm,随机抽取3只小鼠,取肿瘤组织行HE染色进行形态学观察,确定荷宫颈癌小鼠模型的成功建立。
2.3 实验分组及处理:将成功建立的荷瘤小鼠模型随机分为对照组、圣愈汤组、放疗组和圣愈汤联合放疗组,每组10只。对照组:不做治疗。圣愈汤组:以圣愈汤0.4 ml灌胃,连续给药2周。放疗组:给予6MV-X线局部照射,剂量20Gy/2d,小鼠移植瘤皮肤表面予以凡士林均匀涂抹做剂量补偿,其余部位予以铅挡保护,源皮距100 cm。圣愈汤联合放疗组:圣愈汤给药时间同圣愈汤组,局部放疗时间同放射组。
2.4 流式细胞术检测脾脏DCs的活化情况:在给药至14 d时,取各组小鼠新鲜脾脏组织修剪成5 mm×5 mm×5 mm大小的组织块,PBS冲洗后,置于培养皿内,在尼龙网上使用5 ml注射器柱塞行机械研磨,制成匀浆,300 μlPBS混匀;加入3倍体积的红细胞裂解液4℃,静置5 min;低温离心5 min,倒掉上清液,400μlPBS重悬,调整细胞密度为1×106/ml;滴加抗体:a管为空白管,不加入任何抗体;b管为同型对照管,加入c管所加抗体等量的同种属同型对照抗体;c管滴加不同巧光素标记的CD11c、CD86、MHC-Ⅱ抗体。震荡器混匀,室温避光孵育30 min,PBS洗涤,离心,300 g×5 min,弃上清,低温PBS洗涂两次,然后200μlPBS重悬,加入流式管中,4℃避光保存;流式细胞仪检测分析。
2.5 酶联免疫吸附法(ELISA)检测脾脏细胞IFN-γ的分泌水平:治疗 14 d后,取出各组小鼠脾脏,剪碎成1 cm3大小组织块,研磨组织至匀浆状,适量生理盐水冲洗研磨器并收集悬液, 经尼龙网过滤,850转/min离心2 min,弃上清,生理盐水洗涤3次,离心去上清后,用含10%胎牛血清的RPMI1640 培养液重悬,制成密度为 1×107/ml细胞悬液;再次离心取沉淀,按10倍细胞压积的比例加入红细胞裂解液,混合,静置5 min后用 PBS冲洗后,以含2%FBS 的保护液重悬沉淀,加入LC分离液,离心后取中间层细胞,PBS 洗涤后重悬,使用MACS磁珠分选系统分离出 DCs,37℃、5%CO2培养48 h后收集上清。用ELISA法检测上清中的 IFN-γ含量,按试剂盒说明书进行操作,结果在酶标仪450 nm处检测OD值,绘制标准曲线,计算质量浓度,单位是pg/ml。
2.6 LDH实验检测脾脏细胞毒性T淋巴细胞(Cytotoxic T lymphocytes,CTLs)杀伤活性:无菌取小鼠脾脏,制备脾细胞悬液,并分离CD8+CTLs。以CD8+CTLs为效应细胞,宫颈癌Hela细胞为靶细胞,将效应细胞及靶细胞按20∶1比例混合,接种于培养瓶,37℃、5%CO2培养48 h;PBS重悬细胞,加入细胞裂解液 4℃低温裂解 5 min,12 000转/min离心3 min, 取上清为细胞裂解产物。使用LDH 试剂盒检测CD8+CTLs 杀伤活性 ;细胞杀伤活性计算;杀伤率(%)=(实验组A值-效应细胞自然释放组A值-靶细胞自然释放组A值)/(最大释放组A值-靶细胞自然释放组A值)×100%。
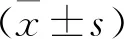
结 果
1 各组小鼠脾脏DCs活化情况 小鼠经圣愈汤灌胃第7天时,圣愈汤组、放疗组及圣愈汤联合放疗组脾脏活化DCs数量均较对照组升高(P<0.05),且圣愈汤联合放疗组活化DCs更高(P<0.05),见表1。
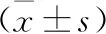
表1 脾脏DCs活化情况流式细胞测定结果
注:与对照组比较,*P<0.05;组间比较, #P<0.05
2 各组小鼠细胞因子分泌水平 圣愈汤组、放疗组及圣愈汤联合放疗组INF-γ分泌量均较对照组升高(P<0.05),且圣愈汤联合放疗组INF-γ分泌量与其余各组比较更高(P<0.05),见表2。
3 圣愈汤联合放疗可明显提高脾脏CD8+CTLs杀伤活性 圣愈汤组、放疗组及圣愈汤联合放疗组脾脏CD8+CTLs杀伤均较对照组升高(P<0.05),且圣愈汤联合放疗组脾脏CD8+CTLs杀伤与其余各组比较更高(P<0.05),见表3。

表2 各组小鼠细胞因子分泌水平
注:与对照组比较,*P<0.05;组间比较, #P<0.05

表3 各组小鼠CD8+CTLs杀伤活性检测结果(%)
注:与对照组比较,*P<0.05;组间比较, #P<0.05
讨 论
圣愈汤以补益元气的人参和滋阴养血的熟地为主药,辅以黄芪健脾益气,白芍敛阴养血,当归、川芎补血活血,共奏益气补血之效[4-5]。有研究表明,圣愈汤能调整免疫抑制小鼠的T细胞亚群分布及细胞因子含量,对小鼠免疫功能有一定的促进和调节作用[6-8];本实验在此基础上,观察圣愈汤联合放疗对荷宫颈癌小鼠脾脏DCs分泌细胞因子及CTLs对肿瘤细胞杀伤活性的影响,以进一步明确圣愈汤的免疫调节作用及其机理。
树突状细胞(DCs)机体重要的抗原提呈细胞,通过表达丰富的MHC分子、共刺激分子及粘附分子,刺激T细胞增殖,诱导抗原特异性的CTL细胞生成,从而在肿瘤免疫中起主导作用[9-11]。 本实验通过流式细胞术检测经圣愈汤及放疗干预后各组小鼠脾脏的DCs活化情况,结果表明:圣愈汤组、放疗组及圣愈汤联合放疗组脾脏活化DCs数量均较对照组升高,且圣愈汤联合放疗组活化DCs更高。说明圣愈汤促进了体内DC的分化、成熟,而放疗组DCs也出现活化增多,则可能与放疗后肿瘤细胞坏死,抗原物质释放后激活机体抗肿瘤免疫有关;而圣愈汤联合放疗后可放大这种肿瘤免疫反应。
DCs细胞活化后,可将抗原提呈给CD4+T细胞,调节CD4+T细胞分化为Th1/Th2细胞,其中Th1可通过分泌多种细胞因子(如INF-γ)参与细胞免疫,具有显著的抗肿瘤作用;同时DCs摄取抗原后,可激活CD8+T细胞,增强CTLs杀伤活性,产生对宫颈癌特异性的细胞毒性杀伤作用[12];本研究结果表明:圣愈汤及圣愈汤联合放疗均能增加INF-γ的分泌,并由此促进CTLs细胞的成熟活化,增强CTLs杀伤活性;且提示联合治疗更有效激活抗原提呈细胞,增强机体的抗肿瘤免疫。
综上所述,圣愈汤可促进荷瘤小鼠脾DC的分化、成熟,增加INF-γ分泌,诱导T淋巴细胞向CTLs的分化,增强CTLs杀伤活性,进而提高小鼠抗肿瘤免疫;并且圣愈汤联合放疗后,可放大其免疫促进作用;而这种免疫增强作用是否持久,能否达到稳定的治疗效果,则还需进一步的研究。
