苦马豆素致糖基转移酶活性改变对小鼠生殖激素分泌的影响
2019-09-16王毅彭铭高欣赵宝玉吴晨晨
王毅,彭铭,高欣,赵宝玉,吴晨晨
西北农林科技大学动物医学院,杨凌 712100
疯草是黄芪属(Astragaius)与棘豆属(Oxytropis)有毒植物的统称,是目前世界上危害最大,影响草原畜牧业发展最严重的一类有毒植物,家畜大量采食后引发机体生产性能下降,甚至死亡[1-2]。疯草中毒的母畜不仅易发生流产、胎儿浸溶等,还可能诞下弱胎、死胎、畸形胎或腐胎等,同时胎盘上皮细胞、卵巢黄体和流产胎儿的实质器官出现不同程度的空泡变性[3-7]。公畜则出现繁殖能力降低,严重者甚至死亡[8]。
苦马豆素(swainsonine, SW)是疯草主要有毒成分,是一种吲哚兹啶生物碱,因为其阳离子空间结构与甘露糖苷水解过程中形成的甘露糖阳离子半椅状结构相类似,并对α-甘露糖苷酶有非常高的亲和力,所以会抑制α-甘露糖苷酶正常生理功能[9-10]。α-甘露糖苷酶是N-聚糖加工过程中主要的修饰酶,苦马豆素中毒同时可以竞争性地抑制溶酶体内α-甘露糖苷酶,引起大量的混合天冬酰胺低聚糖堆积在溶酶体内,蛋白质合成受阻,从而导致细胞广泛性的空泡变性和坏死[11-14]。糖蛋白是分支的寡糖链与多肽链共价相连所构成的复合糖,主链较短,在大多数情况下,糖的含量小于蛋白质[15]。糖蛋白激素是一种通过2个不同的糖基化亚基之间非共价作用形成的异二聚体[16]。并且,糖蛋白激素具有特异性的膜受体,受体的结合情况取决于是否形成了完整的α/β异二聚体,糖蛋白激素的亚基具有较高的序列及结构相似性,其中哺乳动物中α-亚基的氨基酸序列都相当保守,但是β-亚基却具有激素特异性和种间的特异性。这种特异性决定了激素的生物活性和免疫活性[17]。由垂体前叶释放的促性腺激素属于糖蛋白激素:包括黄体生成素(luteinizing hormone, LH)、促卵泡生成激素(follicle-stimulating hormone, FSH)和绒毛膜促性腺激素(chorionic gonadotropin, CG)。下丘脑分泌促性腺释放激素作用于垂体,继而引起垂体分泌促性腺激素(FSH和LH),然后作用于性腺,性腺分泌类固醇激素如雌激素(estradiol, E2)和孕激素(progesterone, P4),作用于卵巢,影响卵泡发育[17-18]。合成类固醇激素的组织器官主要是在肾上腺皮质、睾丸、卵巢和胎盘,这些器官中含有不同种类、数量的固醇激素合成酶,它们可以产生各种不同的激素。常见的调控类固醇激素生成的分子包括:类固醇激素合成急性调节蛋白(steroidogenic acute regulatory, StAR)、3-β羟基类固醇脱氢酶(3-β hydroxysteroid dehydrogenase, 3-βHSD)和细胞色素P450胆固醇侧链裂解酶(cytochrome P450 cholesterol side chain lyase, P450scc)[19]。
笔者课题组前期研究表明:苦马豆素中毒后α-甘露糖苷酶活性降低,糖蛋白激素肽链上N-聚糖糖链结构发生改变,引起糖蛋白激素活性发生改变[20]。那么苦马豆素中毒后N-聚糖加工过程中其他的糖基转移酶和糖苷酶活性是否也发生变化?苦马豆素中毒后生殖激素水平及其受体和类固醇激素限速酶如何改变?因此在本试验中,笔者应用苦马豆素对小鼠进行腹腔注射,分别于妊娠后7 d、15 d和分娩后7 d采集血液、子宫和卵巢组织。应用荧光定量PCR检测4种生殖激素受体在卵巢上的核酸表达量,应用ELISA的方法检测糖基转移酶活性和生殖激素水平,应用Western-blot检测性类固醇激素限速酶蛋白表达量。以此来分析苦马豆素中毒致N-聚糖加工过程的异常对生殖激素及其受体表达量的影响,为以后疯草中毒致家畜生殖性能紊乱的分子生物学机制研究奠定理论基础。
1 材料与方法(Materials and methods)
1.1 试验动物的分组与染毒
随机选取6~8周龄雌性昆白小鼠60只,分为2组,一组为试验组,腹腔注射苦马豆素(n=30,1/10 LD50为0.04 mg·kg-1),一组为对照组,腹腔注射生理盐水(n=30,0.04 mg·kg-1)[20]。每隔1 d染毒一次,连续染毒21 d后,按雌雄比例为2:1进行合笼,雌性小鼠继续攻毒,隔2 d注射一次。分别在妊娠期7 d、15 d和分娩后7 d处死(每次每组5只),收集小鼠血液、子宫和双侧卵巢组织,记录母鼠产仔数。
1.2 主要试剂
总RNA提取试剂盒、BCA蛋白质定量试剂盒购自天根生化科技(北京)有限公司,分析纯三氯甲烷购自洛阳昊华化学试剂有限公司,分析纯无水乙醇购自成都市科龙化工试剂厂,反转录试剂盒、2×PCR Taq MasterMix/with dye购自ABCOM,组织蛋白抽提试剂盒、荧光染料SYBR Green I购自北京康为世纪生物科技有限公司,引物来自北京奥科鼎盛生物科技有限公司,小鼠溶酶体α-甘露糖苷酶-I试剂盒、小鼠高尔基体α-甘露糖苷酶-Ⅱ试剂盒、小鼠N-乙酰葡萄糖胺转移酶-Ⅰ试剂盒和小鼠N-乙酰葡萄糖胺转移酶-Ⅱ试剂盒购自江西海联生物科技有限公司,5X蛋白上样缓冲液购自西安赫特生物科技有限公司(HEART),Aromatase兔抗鼠抗体、StAR兔抗鼠抗体购自Cell Signaling Technology,3-βHSD兔抗鼠抗体、β-Actin兔抗鼠抗体购自艾博抗(上海)贸易有限公司(Abcam),山羊抗兔抗体购自安诺伦(北京)生物科技有限公司(ZETA),牛血清白蛋白(BSA)购自北京索莱宝科技有限公司,PVDF膜购自广州赛国生物科技有限公司(Biosharp)。
1.3 试验方法
1.3.1 提取小鼠卵巢总RNA
卵巢放置液氮中磨碎并加入裂解液RZ。将样品置于裂解液RZ中5 min(15~30 ℃)。4 ℃下以12 000 r·min-1离心5 min后,吸出上清液然后加入到另一个不含RNA酶的离心管中。在离心管中加入200 μL氯仿,震荡15 s后,于室温下静置3 min。4 ℃下以12 000 r·min-1离心10 min,样品会被划分为3层,上层水相中含有RNA。将水相转移至新管中,加入0.5倍体积的无水乙醇并充分混匀。将溶液倒入吸附柱CR3中,4 ℃下以12 000 r·min-1离心30 s,排出收集管中液体。吸取已加入乙醇的去蛋白液RD 500 μL于吸附柱CR3中,4 ℃下以12 000 r·min-1离心30 s,排出液体后将CR3放入收集管。吸取已加入乙醇的漂洗液RW 500 μL于吸附柱CR3中,4 ℃下以12 000 r·min-1离心30 s,排出液体。将吸附柱放置在2 mL收集管,4 ℃下以12 000 r·min-1离心2 min,排出液体。将吸附柱CR3放入1.5 mL的离心管,加100 μL不含RNA酶的ddH2O,4 ℃下以12 000 r·min-1离心2 min,所得液体为RNA。提取RNA后进行反转录获得cDNA。
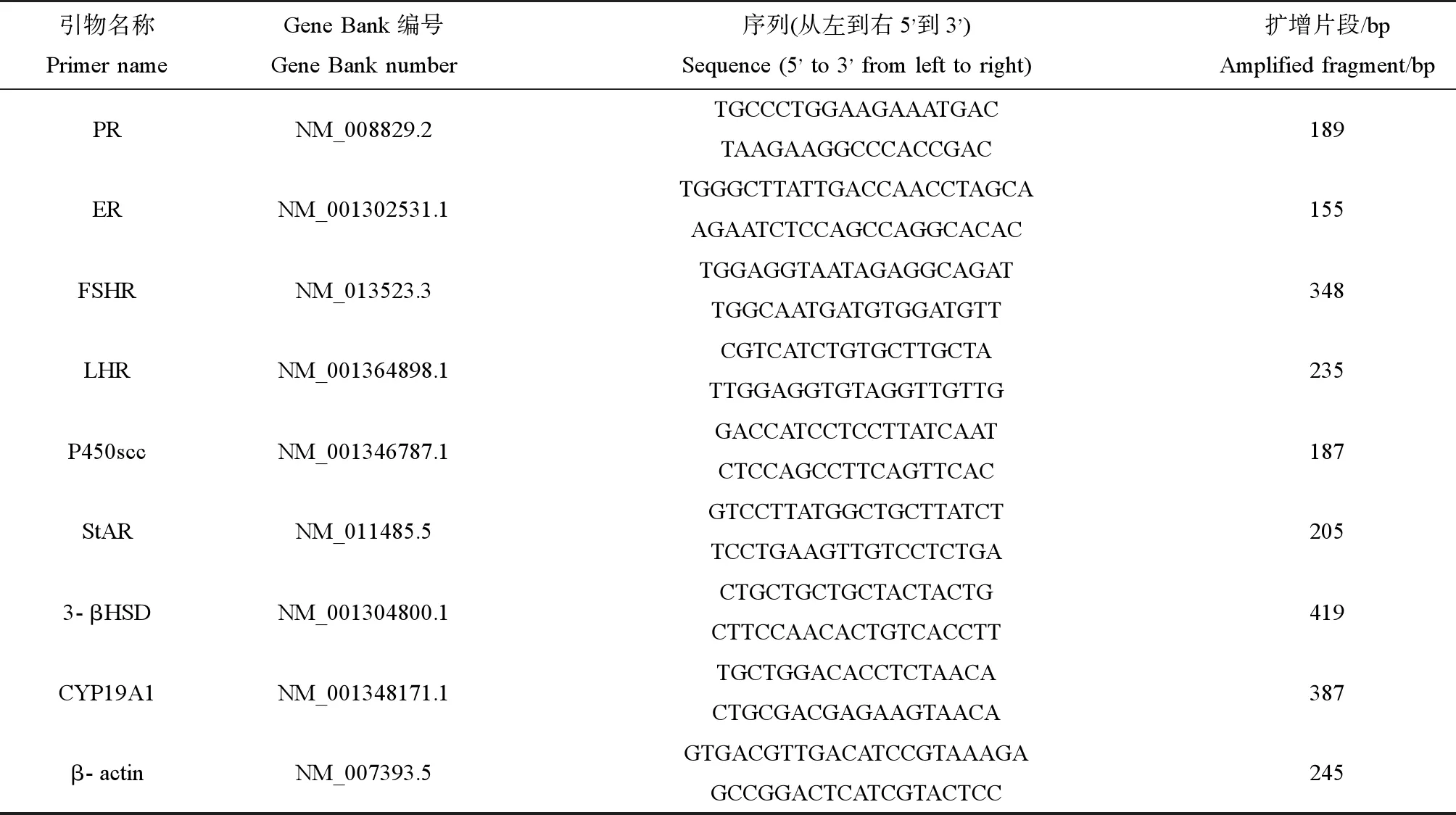
表1 4种激素受体的引物序列Table 1 Primer sequences for four hormone receptors
1.3.2 实时荧光定量PCR
根据Gene Bank设计促卵泡素、促黄体素、孕酮和雌二醇受体4个因子以及类固醇激素合成急性调节蛋白(StAR)、3-β羟基类固醇脱氢酶(3-βHSD)、细胞色素P450胆固醇侧链裂解酶(P450scc)和细胞色素P450芳香酶(cytochrome P450 aromatase, P450arom,由CYP19基因编码)的引物序列如表1所示,并按照表2体系进行反应。

表2 实时荧光定量PCR反应体系Table 2 Realtime-PCR reaction system
将上述混合液体放置在PCR仪上,开始设置反应程序:预变性设置为3 min、95 ℃,然后进入循环扩增阶段:变性设置为30 s、95 ℃,退火为30 s、50~60 ℃,延伸为32 s、72 ℃,设置40次循环。
1.3.3 卵巢组织总蛋白质提取
应用组织蛋白抽提试剂盒,按照说明书方法进行:取出Tissue Protein Extraction Reagent进行预冷,解剖小鼠摘掉卵巢,置于提前高压灭菌并预冷的研钵中,加入液氮进行研磨,研磨时及时加入液氮防止融化降解。将研磨的粉末加入离心管中放置2~3 min后,取适量的Tissue Protein Reagent并按照体积比为1∶99加入Protease Inhibitor Cocktail,即1×工作液。每1 g组织中加入10 mL 1×工作液匀浆处理。而后置于冰上孵育20 min,在离心机中10 000 r·min-1离心20 min。将得到的上清液移到新管中,准备蛋白含量测定。
1.3.4 蛋白质浓度的检测
使用TIANGEN BCA蛋白质定量试剂盒检测蛋白质浓度。(1)标准品的稀释:用与样品相同缓冲体系的稀释剂对BSA标准品进行稀释(具体参数如表3所示)。(2)配制BCA工作液:按照所提取的蛋白量制备适量BCA工作液,并轻摇至充分混匀。(3)微管测定方法:分别取25 μL新鲜配制的BSA标准液和待检测的样品蛋白,加入96孔板中。在每个孔中加入200 μL BCA工作液,然后轻轻混匀。加盖,放入37 ℃恒温箱内孵育30 min或者在室温中放置2 h。之后放到酶标仪中,用紫外分光光度计检测562 nm处的吸光度。根据酶标仪所测得的标准曲线计算样品的蛋白浓度。

表3 牛血清白蛋白(BSA)标准样品稀释Table 3 Bovine serum albumin (BSA) standard sample dilution
1.3.5 蛋白质免疫印迹(Western Blot)法
清洗薄厚玻璃板,并用去离子水冲洗干净,装入制胶架中,用移液枪加入搅拌充分的10%分离胶,室温静置30 min后加入混匀充分的5%浓缩胶并插入梳子。室温静置30 min后,置入电泳槽中加入新配制的1×电泳液,拔出梳子,加入样液和蛋白maker,80 V电泳30 min然后再100 V电泳1 h。电泳后进行转膜,根据凝胶块大小剪取滤纸和PVDF膜(面积:滤纸>膜>胶),将其全部浸泡于电转缓冲液中15 min,其中膜需提前浸泡甲醇5 min,然后按滤纸-胶-膜-滤纸的“三明治”方式重叠,不能有气泡;100 V转膜50 min。转膜后把膜放入5% BSA封闭液中室温封闭2 h,然后放入配制好的一抗中4 ℃过夜,第2天拿出膜用TBST清洗,每次10 min,一共清洗6次。在用适当浓度的二抗室温孵育2 h,清洗6次每次10 min,表面涂新配制的发光液,放入仪器内曝光,观察蛋白条带。
1.3.6 ELISA法分析糖基转移酶和生殖激素的活性
(1)将试剂盒在室温下放置20 min后,从铝箔袋中取出所需板条。(2)吸取不同浓度50 μL标准品加入标准品孔中。(3)空白孔不加入待测样品,而将50 μL待测样品加入样本孔中。(4)吸取100 μL带有辣根过氧化物酶(HRP)标记的抗体加入每个孔中,空白孔除外,然后用封板膜封住反应孔并于恒温箱温育60 min或水浴锅水浴37 ℃。(5)弃去液体,残余水分用吸水纸吸干,每孔加入350 μL洗涤液,放置1 min,弃去洗涤液,残余水分用吸水纸吸干,用此法洗5次。(6)在每个孔中加入50 μL的A液和B液,37 ℃避光孵育15 min。(7)在每个孔中加入终止液50 μL,于15 min内在450 nm波长处测OD值。
1.3.7 PAS染色法
糖原染色法即将新鲜组织编号取材后投入AFF液、Carnoy固定液或者放入冰箱内低温固定。放入无水酒精中脱水、二甲苯透明、浸蜡和包埋。常规切片厚5 μm,脱蜡至水;使用质量分数为0.5%~1%的高碘酸试剂氧化5~10 min,环境温度以下不高于20 ℃为宜,室温高时氧化时间适当缩短。流水冲洗5 min,再用去离子水冲洗2次;Schiff氏液从冰箱取出升至室温后,避光染色10~30 min;质量分数为0.5%的偏重亚硫酸钠每次浸洗1~2 min,一共2次,以达到分化的目的;流水冲洗5~10 min,去离子水冲洗;Haris苏木精染2~5 min,去离子水冲洗;质量分数为1%的盐酸酒精分化,再用去离子水充分冲洗;温水(或者质量分数为1%的氨水)返蓝,核染色稍浅为好;流水冲洗,常规脱水,二甲苯透明,中性树胶封固。
1.4 数据统计
采用平均值±标准差来表示试验数据。使用SPSS13.0(SPSS, Chicago. IL. USA)分析数据,包含2个相关样本分析。结果中,概率(P)值低于0.05可认为具有统计学意义,*P<0.05,试验组与对照组同一时间阶段进行对比。
2 结果(Results)
2.1 苦马豆素对仔鼠存活率的影响
雌性小鼠妊娠7 d、15 d和分娩后7 d观察小鼠产仔数和仔鼠存活率。如表4所示,染毒组仔鼠在妊娠7 d和15 d的存活率显著低于对照组(P<0.05)。
2.2 小鼠子宫糖原染色
妊娠期后7 d、15 d和分娩后7 d采取小鼠子宫组织,应用PAS法染色,显微镜观察发现:与对照组相比,染毒组小鼠分娩后7 d,小鼠子宫内膜固有层上出现大量红色糖类物质沉积,并在子宫内膜上出现大量的空泡变性,如图1所示。
2.3 苦马豆素对小鼠血液中生殖激素含量的影响
收集2组雌性小鼠妊娠期7 d、15 d和分娩后7 d血液,检测血液中雌二醇、孕酮、促卵泡素和促黄体素水平(图2)。结果显示,在妊娠后15 d和分娩后7 d,染毒组小鼠血液中雌二醇和孕酮的含量显著低于正常对照组(P<0.05);在妊娠期后7 d、15 d和分娩后7 d,染毒组小鼠血液中促卵泡素和促黄体素的含量显著低于对照组(P<0.05)。

表4 雌性小鼠产仔数Table 4 Number of litters of female mice
注:*P<0.05,相同时间内,同组比较两者之间差异显著。
Note: *P<0.05, at the same time, the difference between the two groups is significant.
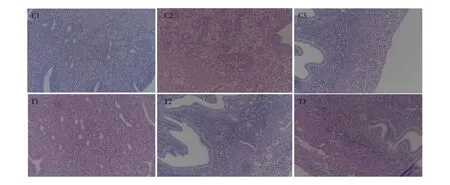
图1 妊娠小鼠子宫糖原染色注:C. 对照组,T. 染毒组;1. 妊娠期后7 d,2. 妊娠期后15 d,3. 分娩后7 d。Fig. 1 Uterine glycogen staining in pregnant mice Note: C. control group, T. test group; 1. 7 days after pregnancy, 2. 15 days after pregnancy, 3. 7 days after childbirth.

图2 苦马豆素对小鼠血液生殖激素水平的影响注:与对照组相比,* P<0.05。E2为雌激素,P4为孕激素,FSH为卵泡刺激素,LH为促黄体生成素。Fig. 2 Effect of swainsonine on blood reproductive hormone levels in mice Note: compared with the control, * P<0.05. E2 stands for estrogen; P4 stands for progesterone; FSH stands for follicle stimulating hormone; LH stands for luteinizing hormone.
2.4 苦马豆素对小鼠生殖激素受体mRNA表达量的影响
在小鼠妊娠7 d、15 d和分娩后7 d,收集2组雌性小鼠卵巢组织,应用实时荧光定量PCR检测小鼠卵巢中4种生殖激素受体mRNA的表达量。结果显示:在妊娠7 d和15 d,染毒组小鼠孕激素受体(progesterone receptor, PR)、雌二醇受体(estradiol receptor, ER)、促卵泡素受体(follicle stimulating hormone receptor, FSHR)和促黄体素受体(luteinizing hormone receptor, LHR)mRNA表达量均显著低于对照组(P<0.05)。在分娩后7 d,染毒组小鼠PR、FSHR和LHR mRNA表达量显著高于对照组(P<0.05),而ER mRNA表达量略低于对照组,但差异不显著(P>0.05)(表5)。
2.5 苦马豆素对小鼠糖基转移酶活性的影响
应用ELISA方法检测小鼠子宫溶酶体α-甘露糖苷酶-(图3a)、高尔基体α-甘露糖苷酶-Ⅱ(图3b)、N-乙酰葡萄糖胺转移酶-Ⅰ(图3c)和N-乙酰葡萄糖胺转移酶-Ⅱ(图3d)的酶活性。结果显示:在妊娠7 d,染毒组小鼠溶酶体α-甘露糖苷酶-Ⅰ、高尔基体α-甘露糖苷酶-Ⅱ和N-乙酰葡萄糖胺转移酶-Ⅱ的活性显著低于对照组(P<0.05),而与对照组相比,染毒组小鼠子宫N-乙酰葡萄糖胺转移酶-Ⅰ的活性差异不显著(P>0.05);在妊娠15 d和分娩后7 d,染毒组小鼠溶酶体α-甘露糖苷酶-Ⅰ、高尔基体α-甘露糖苷酶-Ⅱ、N-乙酰葡萄糖胺转移酶-Ⅰ和N-乙酰葡萄糖胺转移酶-Ⅱ的活性显著低于对照组(P<0.05)。
2.6 小鼠性类固醇激素限速酶蛋白表达量
收集各组小鼠卵巢组织,在妊娠7 d、15 d以及分娩后7 d,提取总蛋白质及总RNA,通过Western Blot以及RT-PCR检测P450scc、StAR、3-βHSD和CYP19A1的蛋白质和mRNA表达量(图4)。在妊娠7 d、15 d和分娩后7 d,染毒组与对照组小鼠比较,卵巢中P450scc和StAR蛋白表达量无显著差异(P>0.05)。妊娠7 d,染毒组和对照组小鼠卵巢中3-βHSD和CYP19A1蛋白表达差异无统计学意义(P>0.05)。在妊娠15 d和分娩后7 d,染毒组小鼠卵巢3-βHSD和CYP19A1蛋白表达量均显著低于对照组(P<0.05)。妊娠7 d、15 d和分娩后7 d,染毒组和对照组小鼠卵巢中P450scc和StAR mRNA表达差异无统计学意义(P>0.05)。妊娠7 d,染毒组和对照组小鼠卵巢中3-βHSD和CYP19A1 mRNA表达差异无统计学意义(P>0.05)。妊娠15 d和分娩后7 d,染毒组小鼠卵巢中3-βHSD和CYP19A1 mRNA表达量显著低于对照组(P<0.05)。
3 讨论(Discussion)
疯草的主要有毒成分是吲哚里西啶类生物碱苦马豆素,其含量直接影响疯草的毒性[21]。Huang等[22]发现低剂量苦马豆素不会引起黄体细胞损伤并促进孕酮分泌,而高剂量苦马豆素可诱导黄体细胞凋亡并抑制黄体中孕酮分泌。Wu等[20]发现苦马豆素影响小鼠的发情周期和生殖性能。
苦马豆素阳离子与甘露糖苷水解过程中形成的甘露糖阳离子在结构上有相似性,均呈半椅状空间结构,这导致苦马豆素对甘露糖苷酶表现出高度的亲和性。并且甘露糖苷酶作用的靶间室中pH通常为4.5,这使苦马豆素表现出弱碱性,从而使其成为α-甘露糖苷酶的强烈抑制剂[23]。α-甘露糖苷酶是N-聚糖加工过程中的关键酶,由于苦马豆素对于α-甘露糖苷酶有强烈的抑制作用,故而引起N-聚糖加工过程紊乱。在N-聚糖加工过程中起主要催化作用的酶有α-甘露糖苷酶和N-乙酰葡萄糖胺转移酶。N-乙酰葡萄糖胺转移酶位于真核生物的高尔基体中,是一种催化N-聚糖核心D-甘露糖(Man)与UDP-N-乙酰葡萄糖胺(UDP-Glc NAc)中的GlcNAc连接,形成N-糖链分支结构的酶类[20]。本研究发现小鼠腹腔注射苦马豆素后,不仅溶酶体α-甘露糖苷酶-Ⅰ和高尔基体α-甘露糖苷酶-Ⅱ的活性受到抑制,N-乙酰葡萄糖胺转移酶-Ⅰ和N-乙酰葡萄糖胺转移酶-Ⅱ的活性也受到抑制。这表明苦马豆素对N-聚糖加工过程中的关键酶均有显著抑制作用,进而导致N-聚糖加工过程紊乱。

表5 各处理组生殖激素受体mRNA表达量Table 5 The mRNA expression of reproductive hormone receptor in different groups
注:PR、ER、FSHR和LHR分别表示孕激素受体、雌激素受体、卵泡刺激素受体和黄体生成素受体。*P<0.05,相同时间内,与相应的对照组比较差异显著。C1、C2和C3分别代表对照组小鼠妊娠7 d、15 d和妊娠后7 d;T1、T2和T3分别代表染毒组小鼠妊娠7 d、15 d和妊娠后7 d。
Note: PR, ER, FSHR, LHR stand for progesterone receptor, estrogen receptor, follicle stimulating hormone receptor, luteinizing hormone receptor. *P<0.05, at the same time, the difference is significant compared with the corresponding control. C1, C2, C3 represent the control group on 7th day, 15th day after pregnancy and 7th day after childbirth; T1, T2, T3 represent the exposed group on 7th day, 15th day after pregnancy and 7th day after childbirth.
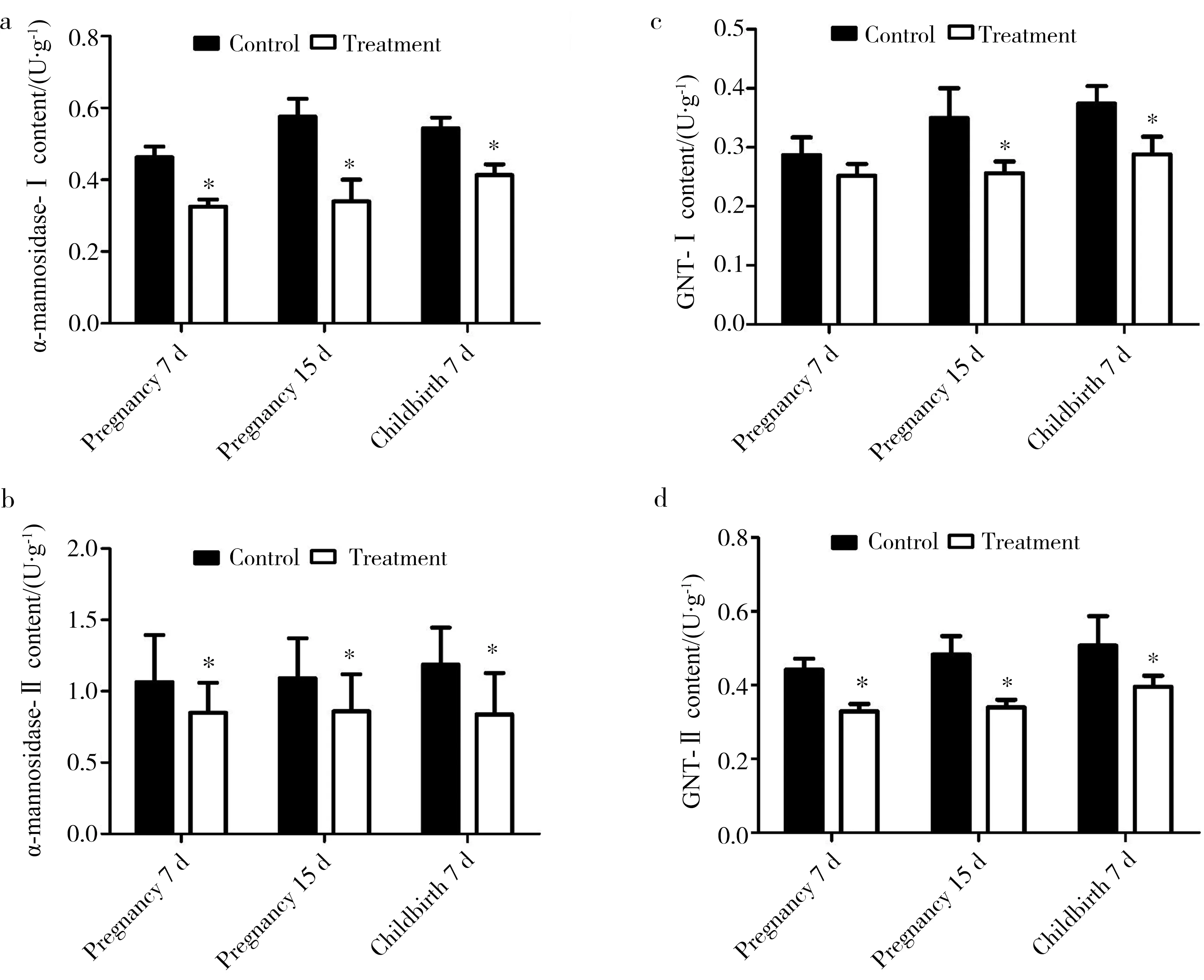
图3 苦马豆素对小鼠子宫糖基转移酶活性的影响注:与对照组相比,* P<0.05。a. 溶酶体α-甘露糖苷酶-Ⅰ;b. 高尔基体 α-甘露糖苷酶-Ⅱ;c. N-乙酰葡萄糖胺转移酶-Ⅰ;d. N-乙酰葡萄糖胺转移酶-Ⅱ。Fig. 3 Effect of swainsonine on uterine glycosyltransferase activity in mice Note: compared with the control, * P<0.05. a. lysosomal α-mannosidase-Ⅰ; b. Golgi α-mannosidase-Ⅱ; c. N-acetylglucosamine transferase-Ⅰ; d. N-acetylglucosamine transferase-Ⅱ.

图4 小鼠性类固醇激素限速酶蛋白与基因表达量注:与对照组相比,* P<0.05。Fig. 4 The steroid hormone rate-limiting enzyme protein and gene expression in mice Note: compared with the control, * P<0.05.

图5 苦马豆素对生殖激素作用机理Fig. 5 Mechanism of action of swainsonine on reproductive hormones
糖蛋白(glycoprotein)是分支的寡糖链与多肽链共价相连所构成的复合糖,主链较短,在大多数情况下,糖的含量小于蛋白质。同时,糖蛋白还是一种结合蛋白质,糖蛋白是由短的寡糖链与蛋白质共价相连构成的分子,糖链作为缀合蛋白质的辅基[23]。促性腺激素(gonadotropin, Gn)是一类糖蛋白激素,它通常包括:黄体生成素、促卵泡生成激素和绒毛膜促性腺激素,它可以通过调节脊椎动物性腺发育来促进性激素的生成和分泌。糖蛋白激素与其受体结合后,通过cAMP途径,促进E2和P4合成与分泌,作用于卵巢,影响卵泡发育[24]。促性腺激素是由α、β两条肽链通过非共价键的方式组合而成,其中α-肽链结构性同,β-肽链具有较大差异性,可以识别并结合靶组织的特异受体[25]。本课题组前期试验结果表明,苦马豆素中毒可导致促性腺激素肽链上的糖链结构发生改变[20]。糖蛋白是蛋白质经过糖基化修饰后才可发挥其生物学功能,那么N-聚糖糖链结构的改变势必会影响糖蛋白激素的分泌紊乱。本研究同样发现苦马豆素中毒可导致妊娠期小鼠生殖激素分泌紊乱。下丘脑促黄体生成激素释放激素、促性腺激素和性激素的分泌之间互相联系,通过下丘脑激素分泌轴可以得知性激素是促性腺激素的靶腺产物,而下丘脑促黄体生成激素释放激素调控垂体促性腺激素的合成和分泌,所以这3种激素分泌量之间的变化互相影响,具有一定的周期性(图5)[20]。另外,在雌激素和孕激素与它们的受体结合形成复合物后,受体三维结构发生变化,激素受体复合物被转移到细胞核中,并以高亲和力与目标DNA结合,以二聚体的形式诱发或抑制转录。由于苦马豆素使N-聚糖加工过程紊乱,苦马豆素影响促卵泡素和促黄体素的分泌,使功能性促卵泡素和促黄体素含量下降,通过下丘脑-垂体-性腺轴,随血流到达卵巢的促卵泡素和促黄体素含量下降,与其受体结合后,对卵巢等组织分泌的雌激素和孕激素也起到了抑制作用[25]。生殖激素与其受体结合后才能发挥生理活性,因此,苦马豆素中毒后引起妊娠期生殖激素及其受体表达量降低,致使染毒组小鼠产仔数和活胎数显著低于对照组。

图6 生殖类固醇激素合成关键步骤简图Fig. 6 Schematic diagram of key steps in reproductive steroid synthesis
下丘脑分泌促性腺释放激素作用于垂体,垂体正反馈作用分泌促性腺激素,然后作用于性腺,促使性腺分泌雌激素和孕激素(属于类固醇激素),目前研究证明苦马豆素可以抑制促性腺激素的分泌,促性腺激素在卵巢类固醇激素的形成中起重要作用[26]。FSH刺激芳香酶的表达,雌激素在颗粒细胞中合成,FSH可增加颗粒细胞中细胞色素P450芳香酶(P450arom,由CYP19基因编码)的表达和活性,LH可增加黄体细胞中P450scc的表达,二者分别增加了雌二醇和孕酮的含量[27]。另外,LH可以与卵泡膜细胞上的LH受体结合并促进膜细胞中雄激素的合成,产生的雄激素穿过基底膜进入粒状细胞[28]。FSH与颗粒细胞上的FSH受体结合并激活芳香酶的表达。在这种酶的作用下,雄激素被芳香化成雌激素。LH还可以通过cAMP/PKA信号通路调节性类固醇生成途径中重要调节酶StAR、P450scc、3-βHSD和CYP19的转录。类固醇生成酶在类固醇激素的生产中发挥重要作用[29]。StAR的表达催化线粒体内膜胆固醇和细胞色素P450胆固醇侧链切割酶P450scc的组合以产生类固醇。这是类固醇激素生产的第一个酶促步骤(图6)[30]。在P450scc的作用下,胆固醇转化为孕烯醇酮。作为前体,孕烯醇酮通过3-βHSD的作用代谢成黄体酮[31]。在细胞色素P45017α-羟化酶的催化作用下,孕酮被用作产生雄激素的底物[32]。最后,雄烯二酮或睾酮用作合成雌二醇的底物,由细胞色素P450芳香酶催化。本试验结果表明:苦马豆素中毒小鼠卵巢的P450scc和StAR蛋白的表达与对照组无明显差异,而3-βHSD和CYP19A1则明显下调。苦马豆素中毒仅影响甾体激素妊娠后期阶段类固醇限速酶的表达。类固醇激素活性的下降主要是由于FSH和LH含量降低,正向导致类固醇物质的合成减少,从而负反馈调节导致类固醇激素限速酶减少,引起雌二醇和孕酮含量下降。
综上所述,苦马豆素能显著抑制N-聚糖加工过程的关键酶活性,进而抑制N-聚糖的代谢过程,导致细胞内低聚糖大量蓄积,破坏了生殖器官的细胞功能。低聚糖的蓄积引起促性腺激素分泌降低,并且抑制类固醇激素合成过程中后期限速酶的蛋白表达量,间接导致类固醇激素(E2和P4)的水平下降,性类固醇激素分泌紊乱;同时,苦马豆素使妊娠期的生殖激素受体表达量下降,导致生殖激素与受体结合后活性下降,最终引起生殖机能障碍。
