壬基酚聚氧乙烯醚对斑马鱼精巢组织的影响
2019-09-16刘仁彬姜锦林张宇峰梁霞单正军
刘仁彬,姜锦林,张宇峰,梁霞,单正军
1. 南京工业大学环境科学与工程学院,南京 210009 2. 国家环境保护农药环境评价与污染控制重点实验室,环境保护部南京环境科学研究所,南京 210042
壬基酚聚氧乙烯醚(nonylphenol ethoxylates, NPEO)由壬基酚(nonylphenol, NP)和环氧乙烷加合而成,是全球使用量第二大的商用非离子表面活性剂[1]。因其性能稳定、耐酸碱且价格低廉,被广泛应用于洗涤剂、化妆品、纺织、造纸、印刷、农药、制药、冶金、石油、合成橡胶、塑料甚至食品等产品的加工和生产[2-4]。近些年来,全球NPEO的年产量大约70万t[5]。随着工业和农业的迅速发展,NPEO可以通过各种途径释放到环境中[6]。但在自然环境中,NPEO通常会降解成短链壬基酚聚氧乙烯醚、壬基酚和羧酸衍生物[7]。因此,这些降解产物经常会在废水、地表水和沉积物中被检测到[8],NPEO及其降解产物对环境的潜在影响受到人们的广泛关注。NP已被证实具有很强的雌激素活性,被称为内分泌干扰物(endocrine disrupting chemicals, EDCs)[9-10]。NPEO及其降解产物大量进入环境中,会对人体正常的激素分泌产生影响,造成致畸、致癌和致突变效应,还可以通过食物链在动物和人体内积聚。研究表明,EDCs可以通过与天然激素相结合、模仿天然激素作用等方式引起内分泌紊乱,对生物的发育和生殖产生影响,导致产卵量下降[11-12]。
截至目前,国内外已对NPEO降解产物NP开展了多项毒性效应研究,低浓度的NP能够抑制虹鳟鱼的生长发育[13]。NP作为一种环境雌激素,能与雌激素受体结合,促使鱼类体内卵黄蛋白原(vitellogenin, VTG)的升高[14]。刘晓丽等[15]定量研究了NP对成熟雄性斑马鱼性腺细胞色素P450酶系表达的影响,发现NP可以通过抑制精巢中雄激素合成相关酶基因的表达影响精巢发育。但关于NPEO对鱼类精巢组织结构影响的研究不多,NPEO对鱼类性腺发育影响的机理还不是很清楚。因此,本实验以成熟雄性斑马鱼(Daniorerio)为实验材料,探究不同浓度NPEO暴露对受试鱼性腺中类固醇激素受体基因(ERα和AR)以及细胞色素P450酶基因表达量的影响,观察斑马鱼精巢组织结构的变化,深入探究NPEO对成熟雄性斑马鱼精巢组织结构影响的作用机制。
1 材料与方法(Materials and methods)
1.1 试剂与仪器
试剂:壬基酚聚氧乙烯醚(分析纯)购自阿拉丁化学公司,乙醇(分析纯)和二甲苯(分析纯)购自南京化学试剂有限公司,丙酮(分析纯)购自上海凌峰化学试剂有限公司,17β-雌二醇(>99%)购自Sigma-Aldrich公司。
仪器:Leica DM4000 B显微镜,Bio-Rad Experion全自动电泳系统,Bio-Rad Gel DocTMXR+凝胶成像分析系统,Bio-Rad CFX96TMReal-Time System荧光定量PCR仪,Bio-Rad DNA Engine PCR仪。
1.2 实验材料和试验设计
斑马鱼购自南京大学模式生物研究中心,为性成熟雄性个体,平均体重(0.315±0.064) g,在环境保护部南京环境科学研究所斑马鱼实验系统中心驯养2周以上,驯养鱼用水为曝气除氯后的自来水,每天定时投喂新鲜孵化的卤虫无节幼体(Artemianauplii)。
NPEO暴露设计:NPEO较难溶于水,需以丙酮作为助溶剂,配制成的母液浓度为500 mg·L-1(丙酮:5.0 mL·L-1)。设置5个试验浓度组,分别为0.001、0.01、0.1、1.0和10.0 mg·L-1,设置雌二醇(E2:80.0 μg·L-1)试验组、空白对照组和溶剂对照组。试验在10 L(含8 L暴露液)的玻璃缸中进行,每个试验组设3组平行,每组平行随机放入试验用鱼30尾。采用半静态水体暴露的方式进行试验,试验期间每天喂食3次,48 h更换一次暴露液,水温控制在(25±2) ℃,光照周期14 h∶10 h,暴露周期为21 d。暴露21 d后取样,取样时将斑马鱼置于冰上,冻僵后迅速取精巢,立即放入液氮中速冻,放在-80 ℃冰箱中保存待用,精巢组织学研究的样品用4%多聚甲醛固定待用。
1.3 斑马鱼精巢中相关基因的表达
采用高纯总RNA快速抽提试剂盒(离心柱型)提取雄性斑马鱼性腺组织总RNA,取1L总RNA根据HiScriptTM1ST strand cDNA Synthesis kit的说明进行反转录,使用CFX96TMReal-Time System进行实时荧光定量PCR检测,实时荧光定量PCR反应体系为20 μL,其中包括10 μL Faststart Universal SYBR Green Master,4 μL cDNA模板(反转录后按1∶10稀释),2 μL引物(6 mmol·L-1),4 μL RNase-free water。反应条件如下:95 ℃ 10 min,1个循环;95 ℃ 10 s,55 ℃ 3 s,40个循环,4 ℃保存。3次重复实验以减少误差。通过分析反应后各引物的溶解曲线来检测目标片段扩增产物、引物二聚体或DNA污染物情况。用1%凝胶电泳检测目标片段扩增产物的长度(标准化内部参照)。
本研究选择β-actin基因作为内参基因,检测雌激素受体α(ERα)、雄激素受体(AR)以及细胞色素P450酶基因mRNA的相对表达量,基因名称、引物序列及序列号见表1。
1.4 总RNA的检测
将提取的斑马鱼性腺组织的总RNA进行1.0%琼脂糖凝胶电泳,结果显示:可观察到清晰的28S、18S和5S rRNA条带,说明所提取的总RNA完整性较好,可继续进行后续试验。另外,用微量紫外分光光度计测定样品在260 nm和280 nm的吸收值及OD260/OD280比值,测得比值介于1.8~2.0之间,因此可用于后续反转录实验。
1.5 精巢组织石蜡切片
精巢组织学研究采用常规石蜡切片:取出固定好的精巢组织,经梯度乙醇(50%~100%)脱水,二甲苯透明,石蜡包埋,制成石蜡切片(厚5 μm)。切片样本经二甲苯脱蜡和HE染色后,在显微镜下观察并拍照。
1.6 数据统计分析
采用2-ΔΔCt法进行相对基因表达量的计算。荧光实时定量得到的数据进行单因素方差分析(ANOVA)。所有实验数据采用SPSS19.0统计软件处理分析,利用方差分析检验实验组和对照组之间的数据差异,用Tukey法检验计算P值,当P<0.05、P<0.01时认为差异显著。
2 结果(Results)
2.1 NPEO对斑马鱼精巢性类固醇激素受体基因表达的影响
经过21 d的暴露,未观察到斑马鱼出现死亡的情况。由图1可知,不同浓度的NPEO暴露可以影响斑马鱼精巢中ERα和AR基因的相对表达量,与对照组相比,暴露于0.01和0.1 mg·L-1NPEO的斑马鱼精巢中ERα基因的表达量上调显著(P<0.05),10.0 mg·L-1NPEO处理组对斑马鱼精巢中ERα基因表达量的影响显著(P<0.01)。仅10.0 mg·L-1的NPEO暴露显著上调了斑马鱼精巢中AR基因的表达量(P<0.05),其在低浓度NPEO的处理下没有出现显著性变化。

表1 基因名称、引物序列和引物序列号Table 1 Gene name, sequence of the primers and accession number of primers
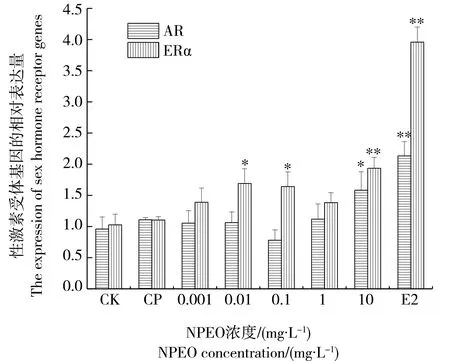
图1 壬基酚聚氧乙烯醚(NPEO)对斑马鱼 精巢中ERα、AR基因表达的影响注:*P<0.05、**P<0.01,与对照组相比;CK、CP表示对照组和溶剂组。Fig. 1 Expression of ERα mRNA and AR mRNA in the testis of zebrafish exposed to nonylphenol ethoxylates (NPEO) Note: *P<0.05, **P<0.01, compared with the control; CK stands for control; CP stands for solvent control.
2.2 NPEO对斑马鱼精巢中细胞色素P450酶相关基因表达的影响
由图2可知,斑马鱼精巢中CYP17基因的表达量与NPEO的浓度存在明显的负剂量-效应关系,与对照组相比,在0.1 mg·L-1和10.0 mg·L-1NPEO的作用下,斑马鱼精巢中CYP17基因的表达量显著下调(P<0.05)。在10.0 mg·L-1的NPEO暴露下,CYP19a基因的表达量最高,与对照组相比具有显著性差异(P<0.05)。
2.3 NPEO对斑马鱼精巢影响的组织学观察
如图3a和图3b所示,雄性斑马鱼性腺为正常发育的精巢组织,由许多生精小管(ST)和管间结构组成。精巢组织中可以看到精子(Sp)均匀分布于管腔中央及大小不一的生精小管中,每个生精小管内含有处于精原细胞(Sg)、初级精母细胞(PS)、次级精母细胞(SS)和精细胞(St)等不同发育时期的生精小囊。在本研究涉及的浓度范围内,部分NPEO暴露组可导致成熟斑马鱼精巢组织结构的改变。与对照组相比,在NPEO暴露21 d后的斑马鱼精巢组织切片中可以看到,0.001 mg·L-1的NPEO暴露组未对斑马鱼精巢组织结构产生影响(图3c);0.01 mg·L-1NPEO处理组的斑马鱼精巢生精小管中处于精母细胞和精细胞时期的生精小囊数量减少,精子数量减少(图3d);0.1 mg·L-1NPEO处理组的斑马鱼生精小管管腔中精子密度增加,还出现了非细胞区域(图3e);1.0和10.0 mg·L-1NPEO处理组可见部分精子在生精小管管腔中央聚集,管腔内空隙明显增大(图3f和图3g)。
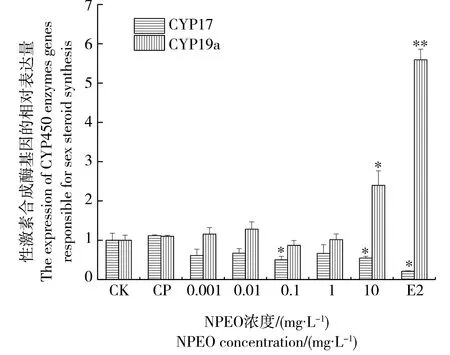
图2 NPEO对斑马鱼精巢中性激素合成 酶基因CYP17、CYP19a表达的影响Fig. 2 Effects of NPEO on the expression of steroidogenic genes CYP17, CYP19a in the testis of zebrafish
3 讨论(Discussion)
研究结果显示,在本研究所涉及到的NPEO浓度范围内,1.0 mg·L-1以上的NPEO暴露对ERα、AR和CYP17、CYP19a基因表达量的影响与E2对这些基因的影响明显一致。E2是一种典型的雌性激素,可以诱导雄性动物或未成熟的动物体内产生卵黄蛋白原,影响鱼类的繁殖能力[16],这显示出NPEO暴露的类雌激素效应。
研究表明,E2会对小鼠精巢中CYP17基因的表达产生干扰,减少睾酮的合成[17]。在脊椎动物中,CYP17基因编码的细胞色素P45017α-羟化酶是体内雄激素合成的限速酶,可以控制精巢中性激素的合成量,主要分布于肾上腺和性腺的间质细胞中[18]。在精巢中,P45017α-羟化酶将胆固醇转化为睾酮[19]。本研究结果显示,斑马鱼精巢中CYP17基因的表达量与NPEO的浓度存在明显的负剂量-效应关系,10.0 mg·L-1的NPEO暴露能显著下调斑马鱼精巢中CYP17基因的表达量。类似的影响在BPA暴露实验中也存在,暴露于1 000 μg·L-1BPA的斑马鱼精巢中CYP17基因的表达量显著下调,表现出显著的负剂量-效应关系[20]。这说明斑马鱼精巢中睾酮的合成减少,性激素分泌能力下降。由此可以推断,NPEO暴露抑制斑马鱼精巢中CYP17基因表达是一种拟雌激素效应。
鱼类CYP19a基因编码的P450芳香化酶(P450arom)是调控雌激素形成的关键酶,主要在卵巢中表达[21],在雄鱼精巢间质细胞中仅有少量的表达,合成的雌激素参与调控原始精原细胞的增殖[22]。鱼类精巢中ERα和CYP19a基因的表达量是环境雌激素对精巢影响的生物标志物。研究结果显示,NPEO暴露导致雄性斑马鱼精巢中CYP19a及ERα基因的表达量明显增加。这说明,NPEO暴露能够促进斑马鱼精巢中内源雌激素的合成,干扰斑马鱼精巢中原有性激素的平衡。以往的研究表明,NPEO是一种弱雌激素,NPEO进入环境后其EO链被打断,形成保留1~2个EO的NP1EO和NP2EO,这些代谢物进一步氧化成相应的羧酸(NP1EC和NP2EC),最终转化为NP[23]。White等[24]证实4-壬基苯酚(NP)和4-壬基-苯氧基-双氧乙烯醚(NP2EO)在虹鳟鱼活体里具有一定雌激素活性,短链的NPEO在结构上与NP比较接近,表现出的雌激素活性也接近NP。Metcalfe等[25]观察到100 μg·L-1的NP1EO和NP2EO混合暴露组导致一条雄性青鳉出现雌雄间性。在0.1 mg·L-1的NPEO作用下,斑马鱼精巢中ERα基因的相对表达量显著上升,与NPEO的弱雌激素效应基本保持一致。而暴露于0.01 mg·L-1NPEO试液中的斑马鱼精巢中ERα基因的表达量也上调显著,推测可能与其降解产物NP有关,例如Balch和Metcalfe[26]在NP1EO试液中检测到降解产物NP存在,NP的存在也可能是促进斑马鱼精巢中内源雌激素合成的原因之一。NPEO进入生物体后能形成包括NP1EO、NP2EO和NP在内的多种相对稳定的代谢物[23],因此,NPEO降解产物对斑马鱼精巢发育的可能影响同样不容忽视,所以需要进一步研究它们之间联合作用对斑马鱼的影响。以往的研究表明,ERα也可以通过正反馈调节来影响CYP19基因的表达[27]。因此,NPEO暴露对斑马鱼精巢中CYP19a基因表达量的影响也可能是ERα正反馈调节的结果。研究发现,BPA暴露可使金鱼(Carassiusauratus)精巢中雄激素受体以及芳香化酶基因的表达量增加,BPA可以通过抗雄激素和雌激素双重途径减少金鱼精子数量[28]。10.0 mg·L-1的NPEO暴露对斑马鱼精巢中AR基因的表达量有显著影响,可以认为NPEO对雄性斑马鱼精巢发育的影响存在抗雄激素和雌激素双重效应。
研究表明,高剂量E2暴露会使成熟雄鱼精巢内精液量下降,精子密度增加,并且有可能导致不育[29],本研究中E2处理组观察到的结果与其保持一致。研究结果显示,与对照组相比,在1.0和10.0 mg·L-1NPEO处理组的斑马鱼精巢组织切片中可见,部分精子集中在生精小管管腔中央,明显增大了管腔内空隙。10.0 mg·L-1的NPEO暴露显著上调了斑马鱼精巢中CYP19a基因的表达量,诱导内源性雌激素的合成。由此可见,NPEO可能通过内分泌干扰改变斑马鱼的精巢结构,在NPEO与内源雌激素的共同作用下,斑马鱼精巢生精小管内产生精子浓缩效应。因此,NPEO暴露会损伤斑马鱼成鱼的精巢组织。
综上所述,考察浓度范围内,NPEO暴露可以导致性成熟的雄性斑马鱼精巢发育退化,NPEO暴露对雄性斑马鱼精巢发育的影响存在抗雄激素和雌激素双重效应。NPEO作为一种弱雌激素,低浓度的NPEO(0.01 mg·L-1)通过降解产物NP对斑马鱼精巢中相关基因的表达产生影响,影响斑马鱼精巢结构。中高浓度的NPEO(≥0.1 mg·L-1)暴露通过抑制CYP17基因的表达干扰睾酮的合成;同时,NPEO暴露通过诱导CYP19a和ERα基因的表达增强雌激素效应,增加内源雌激素的合成,干扰斑马鱼精巢中原有的性激素平衡,最终导致斑马鱼成体精巢组织结构发生改变。需要注意的是,NPEO进入生物体后可以形成包括NP1EO、NP2EO和NP在内的多种代谢物,这些共存组分的雌激素效应影响也不应忽视。
