光照和pH对血红密孔菌生长及抗氧化活性的影响
2019-09-16陈艳通侯典海王福悦赵亚烜高媛媛林维平孙同毅
陈艳通, 侯典海, 杨 晓, 王福悦,赵亚烜, 高媛媛, 林维平*,孙同毅*
(1.潍坊医学院 生物科学与技术学院,山东 潍坊 261053;2.潍坊医学院 护理学院,山东 潍坊 261053;3.潍坊医学院 药学院,山东 潍坊 261053)
药用真菌是很重要的中药来源之一,具有降血脂、抗肿瘤、改善机体免疫力等多种功效[1-2]。真菌能够在其生长过程中产生大量的生理活性物质,主要包含黄酮、多酚、多糖、有机酸、甾体、萜类与多肽等,具有很好的抗肿瘤、抗氧化等活性[3],且毒副作用较低[4-6]。Zhang等[7]研究发现,红平菇多糖能够通过增强抗氧化酶活性、清除肝脏中释放的自由基阻断氧化链反应来缓解由四氯化碳诱导的急性肝损伤,保护肝脏;Yu等[8]研究发现香菇菌丝体多糖可通过提高机体抗氧化能力来缓解由苯酚诱导的大鼠口腔溃疡,减轻其炎性反应。康洁等[9]研究发现,银耳多糖可通过降低血小板数目,减少黏附率,起到抗血栓的作用。灵芝三萜化合物[10]能够通过激活ERK和JNK促分裂原激活蛋白激酶,促使肝癌细胞HuH-7凋亡。血红密孔菌 (Pycnoporussanguineus)是担子菌纲、多孔菌科、密孔菌属的一种白腐真菌[11-12]。具有杀灭细菌、抑制肿瘤、消炎止血等作用[13-14]。Smnia等[15]研究发现血红密孔菌的次级代谢产物色素具有抑制革兰阳性菌的作用;骆守鹏[16]发现,当液态培养血红密孔菌色素质量浓度为4.32 μg/mL时,抑菌率高达 98%。密孔菌可作为食品应用于保健品的开发,也可用于治疗皮肤损伤。目前对血红密孔菌的研究多集中在木质纤维素类原料生物转化方面[17],而培养条件(光照和pH)对血红密孔菌生长及抗氧化活性影响的研究并不多见。 不同的培养条件尤其是光照和pH,对真菌生长,抗氧化能力都有较大影响。杨晓坡等[17]研究发现,连续两周的光照条件及pH 9时对真菌多酚含量的影响较大,抗氧化能力达到最高,约为其他条件的1.2倍和1.5倍。余海尤等[18]发现,24 h光照条件下,忍冬纤孔菌生物量较低,但DPPH自由基的清除能力相对较高,约为其他条件的0.6倍和1.2倍;在初始培养液pH分别为5及3条件下,菌丝体生物量和提取物活性均达到最高,最高可达其他条件的1.5倍和3倍;Zheng等[19]研究也发现,光照条件下桦褐孔菌生物量比黑暗中的低,而DPPH自由基清除活性则比黑暗条件下高。生物抗氧化能力主要是清除自由基[20],目前自由基清除能力分析的常用方法是DPPH法,该法也是评价物质体外抗氧化活性的重要方法[21-22]。本研究通过对血红密孔菌的培养,对不同光照和pH条件下血红密孔菌的生物量、DPPH自由基清除能力和总抗氧化能力进行分析,为进一步优化血红密孔菌培养条件提供参考,也支持了进一步探究其药理药效。
1 材料与方法
1.1 材料
1.1.1 菌种来源 血红密孔菌(Pycnoporussanguineus),购自中国农业微生物菌种保藏管理中心(ACCC 51180)。
1.1.2 培养基(g/L) ①固体PDA培养基:马铃薯200,葡萄糖20,KH2PO41.5,MgSO4·7H2O 1,琼脂20,水1 000 mL,pH自然。②液体PDA培养基:马铃薯200,葡萄糖20,KH2PO41.5,MgSO4·7H2O 1,水1 000 mL,pH根据实验需要调节。
1.1.3 主要试剂与仪器 DPPH(Sigma);T-AOC测定试剂盒(南京建成生物工程研究所);乙醇、硫酸、苯酚购自国药集团化学试剂有限公司且均为分析纯;ZWY-2012C恒温培养振荡器(上海智城分析仪器制造有限公司);HPX-9272MBE培养箱(上海博讯实业有限公司医疗设备厂);LYNX4000高速冷冻离心机(美国Thermo公司);UV-5500紫外分光光度计(上海元析仪器有限公司),PowerWave XS酶标仪(美国BioTek仪器有限公司)。
1.2 方法
1.2.1 菌种活化与培养 菌种接种于固体PDA培养基上,28 ℃培养7 d后转接到液体PDA培养基中摇床培养,28 ℃、150 r/min培养7 d,取出留作后续实验使用。
1.2.2 不同光照与pH条件培养 ①光照对血红密孔菌的影响:用灭菌后的匀浆器打碎活化后的菌体发酵液,经充分振荡后以2%的接种量接种到250 mL锥形瓶中(含有100 mL液体PDA培养基,pH自然),设置14 d黑暗(D)、14 d光照(L)和1 d黑暗、1 d光照(DL)交替3种光照条件,设3个平行,每2 d取样,于恒温摇床28 ℃、150 r/min培养。②pH对血红密孔菌的影响:用灭菌后的匀浆器打碎活化后的菌体液,经充分振荡后以2%的接种量接种到100 mL液体PDA培养基(已分别调节pH至3.0、5.0、7.0、9.0),28 ℃、150 r/min黑暗条件下培养14 d,设3个平行,每隔2 d取样检测。
1.2.3 菌体及上清收集 每2 d取样,8 000 r/min离心15 min;收集菌体60 ℃烘干至恒重,称量记录不同培养条件下菌体生物量,生物量(g/L)=菌丝体干重(g)/发酵液体积(L);收集上清液用于DPPH自由基清除能力检测、胞外T-AOC含量检测。
1.2.4 总抗氧化能力检测 采用南京建成生物工程研究所试剂盒测定,具体操作步骤按试剂盒说明书进行。待测样品分为测定管与对照管,测定管中依次加入相关试剂及待测样品;对照管中除不加入待测样品外,其余同测定管一致。37 ℃充分反应30 min后,各加入显色剂(对照管中另加入待测样品)分别充分混匀;于520 nm波长下,测定各管吸光度值。总抗氧化能力计算公式:
总抗氧化能力(U/mL)=
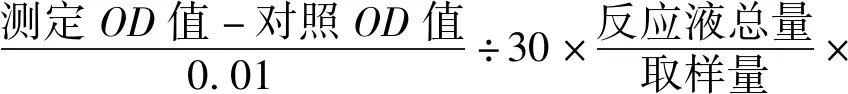
1.2.5 DPPH自由基清除能力检测 收集不同培养条件下的上清各100 μL于96孔板中,并向每孔中加入100 μL 2.0×10-4mol/L的DPPH溶液,混匀后室温避光放置30 min,于517 nm波长处检测各孔的吸光值,清除率计算公式:
清除率(%)=(1-(Ai-Aj)/A0)×100%
式中:Ai为DPPH溶液与样品混合后溶液的吸光值;Aj为样品溶液的吸光值;A0为DPPH溶液的吸光值。
1.2.6 统计学分析 所得的结果数值均以平均值及标准差表示,数据用 SPSS 18.0 软件进行单因素方差分析,P<0.05时为差异显著。
2 结果与分析
2.1 不同光照及pH条件对血红密孔菌生长过程中生物量变化的影响
2.1.1 光照 不同光照培养条件下,血红密孔菌生物量均基本呈上升趋势(图1)。14 d光照条件下,生物量先上升至第8天为2.68 g/L,于第10天有所下降,后又升至2.92 g/L(第12天),后于第14天略降至2.28 g/L;1 d光照1 d黑暗交替条件下,生物量于第2~12天略有升高,并在第14天最终达到2.94 g/L;14 d黑暗条件下,第2~10天血红密孔菌的生物量处于缓慢上升状态,并于第10天~12天生物量大幅上升,随后缓慢上升并于第14天达到最大值,为4.49 g/L。 综上所述,14 d黑暗条件更利于血红密孔菌的生长,于第10~14天生长过程中,其生物量均明显高于14 d光照组及14 d光照黑暗交替组且差异显著。
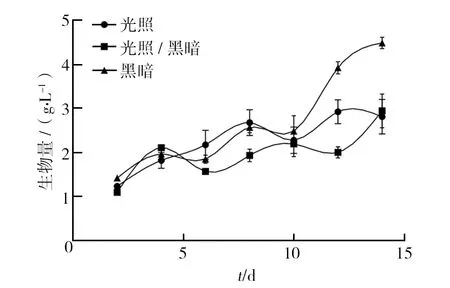
图1 不同光照条件对血红密孔菌生物量的影响Fig.1 Effects of different light conditions on the biomass of Pycnoporus sanguineus
2.1.2 pH值 在血红密孔菌的生长过程中,不同pH条件对其生物量的影响较大(图2)。当pH为3时,生物量于第4天达到最大值4.89 g/L,后续保持基本平稳状态;当pH为5时,生物量一直上升至第10天,达最大值7.12 g/L,随后略有下降,第14天下降至6.49 g/L;当pH为7时,生物量从第2~4天保持平稳,从第4~12天处于上升状态,于第12天达最大值5.70 g/L,随后有所下降,降至5.48 g/L;当pH为9时,生物量从第2~14天基本保持升高,并于第14天达最大值6.19 g/L。 综上所述,pH为5时,血红密孔菌的生物量增长最大且后期(第8~14 天)较其余3组增长明显。因此,pH 5更适于该菌的生长。
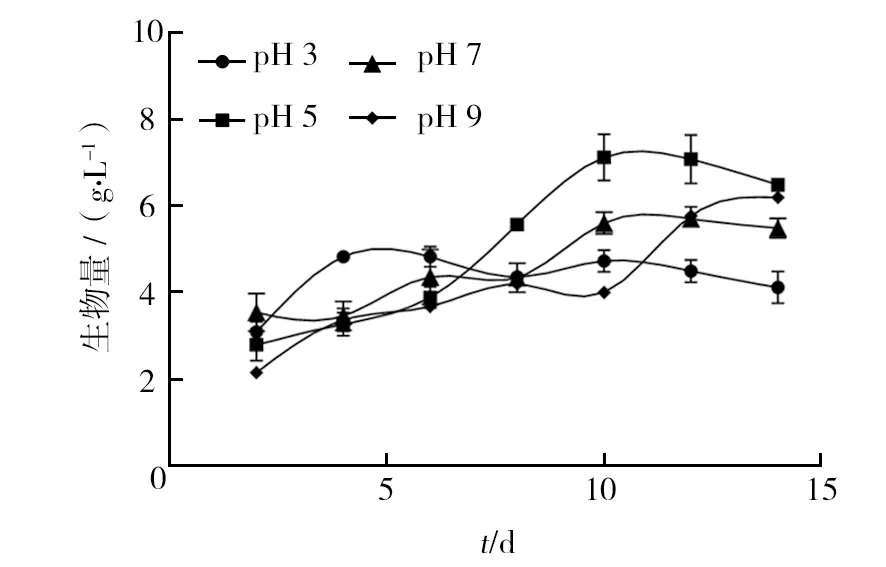
图2 不同pH条件对血红密孔菌培养过程中生物量的影响Fig.2 Effects of different pH conditions on the biomass of Pycnoporus sanguineus
2.2 不同光照及pH条件对血红密孔菌培养过程中DPPH自由基清除能力变化的影响
2.2.1 光照 不同光照下,血红密孔菌液体培养过程中DPPH自由基清除能力的变化趋势大致相同(图3)。14 d光照培养下,血红密孔菌对DPPH自由基清除能力从第2天迅速上升至第4天达到最大值60.73%,到第6天降为40.41%,直到第12天达到57.54%,第14天下降至50.99%;1 d光照、1 d黑暗交替条件下,DPPH自由基清除能力在第2天达到最大值71.28%,之后迅速下降,于第6天降至42.77%,接下来的4 d先上升至49.70%(第8天)后下降最低值41.09%(第10天),最后4 d出现增高,并于第14天达到64.58%;14 d黑暗培养下,DPPH自由基清除率的变化与1 d光照、1 d黑暗交替培养大致相同,于第4天达到最大值67.75 %,于第6天降至最低值32.22%,第6~14 天较平稳上升,并于第14天上升至62.23%。上述结果说明,相较于14 d光照和14 d黑暗条件,14 d光照、黑暗交替条件更利于血红密孔菌对DPPH自由基的清除,并于第2天达到峰值,为71.28%。
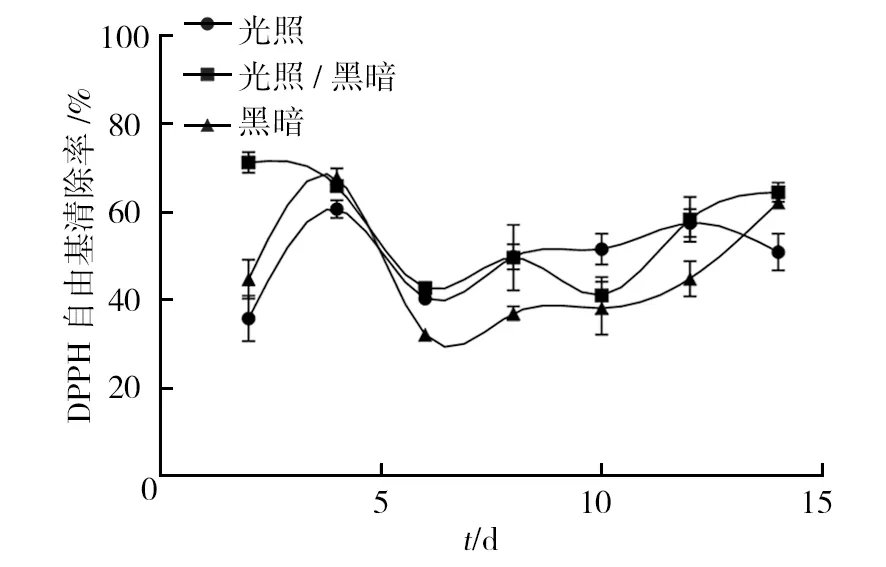
图3 不同光照条件对血红密孔菌DPPH自由基清除能力的影响Fig.3 Effects of different light conditions on the DPPH radicals scavenging activities of Pycnoporus sanguineus
2.2.2 pH值 在血红密孔菌生长过程中,不同pH值对其DPPH自由基清除率的变化影响较大(图4)。当pH为3时,DPPH自由基清除率从第2天缓慢上升至第12天,并达到最大值85.96%,于第14天下降至48.46%;当pH为5时,DPPH自由基清除率先波动后下降,总体处于较低水平,最终降至43.75%;当pH为7时,DPPH自由基清除率由第2天的86.83%下降至第4天 70.96%,随后缓慢上升并于第10天达最大值94.99%,随后下降,最终降至79.55%;当pH为9时,血红密孔菌对DPPH自由基的清除率一直处于波动状态,在第6天达最大值93.97%,随后处于下降趋势,最终于第14天降至69.73%。综上所述,pH为7时得到的DPPH自由基清除率峰值与其他3组相比最高,为94.99%,其次是pH 9。可见偏碱(pH 9和pH 7)条件下,血红密孔菌对DPPH自由基的清除能力较高。
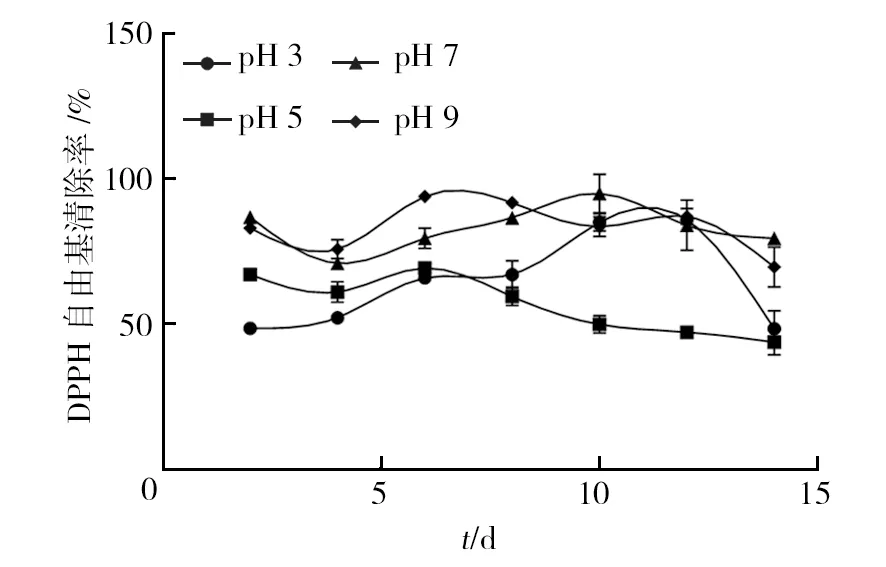
图4 不同pH条件对血红密孔菌DPPH自由基清除能力的影响Fig.4 Effects of different pH conditions on the DPPH radicals scavenging activities of Pycnoporus sanguineus
2.3 不同光照及pH条件对药用真菌培养过程中总抗氧化能力(T-AOC)变化的影响
2.3.1 光照 不同光照条件对血红密孔菌培养过程中总抗氧化能力变化的影响较大(图5)。14 d光照条件下,血红密孔菌T-AOC在前10 d的生长过程中缓慢升高,于第2天的4.77 U/mL上升至11.92 U/mL,随后的第12~14天 T-AOC含量波动较大,分别在第12天下降至7.34 U/mL,在第14天升高至12.52 U/mL;在1 d光照、1 d黑暗条件下,真菌总抗氧化能力的变化呈“W”型变化,于第2天 6.72 U/mL下降至第4天的 5.63 U/mL,然后平稳提高至第8天 13.01 U/mL,接下来的4 d培养过程中,T-AOC下降至9.00 U/mL,最后的2 d T-AOC增强,并于第14天达到最高值14.18 U/mL;14 d黑暗条件培养下,真菌T-AOC在前10 d呈较缓慢的上升趋势,由第2天的5.39 U/mL缓慢上升至第10天的13.40 U/mL,随后在第10~12天的培养过程中,T-AOC迅速上升至25.10 U/mL,到第14天出现较小程度的降低,此时真菌T-AOC为23.39 U/mL。 总体而言,3种光照培养条件下,T-AOC的最大值出现在14 d黑暗培养的第12天,为25.10 U/mL,较其他两组差异有统计学意义。因此,黑暗条件下有助于增强血红密孔菌的总抗氧化能力。
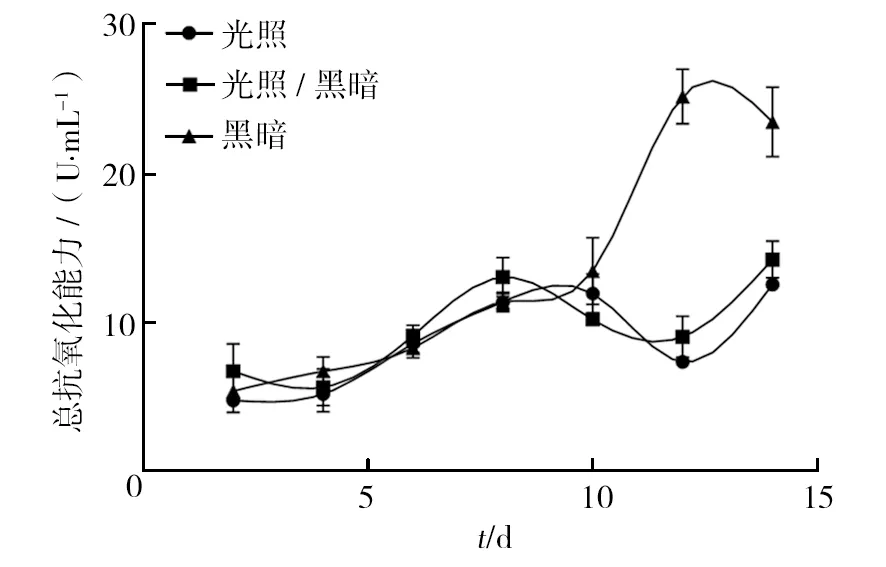
图5 不同光照条件对血红密孔菌总抗氧化能力的影响Fig.5 Effects of different light conditions on the total antioxidant capacities of Pycnoporus sanguineus
2.3.2 pH值 不同pH条件对血红密孔菌培养过程中总抗氧化能力变化的影响较大(图6)。当pH为3和5时,血红密孔菌总抗氧化能力变化趋势基本一致,始终维持在较低水平(10 U/mL以下);当pH为7时,总抗氧化能力从第4天开始迅速增加至第10天,并达最大值64.34 U/mL,随后逐步下降,在第14天降至47.69 U/mL;当pH为9时,总抗氧化能力从第6天快速上升,并于第8天上升至最大值62.49 U/mL,随后快速下降至25.9 U/mL(第12天),然后维持基本不变。综上所述,偏酸环境对血红密孔菌抗氧化能力基本没有影响,而中性及偏碱环境对其影响较大,且对比偏酸环境差异显著。因此,中性及偏碱性环境更能提高血红密孔菌的总抗氧化能力。
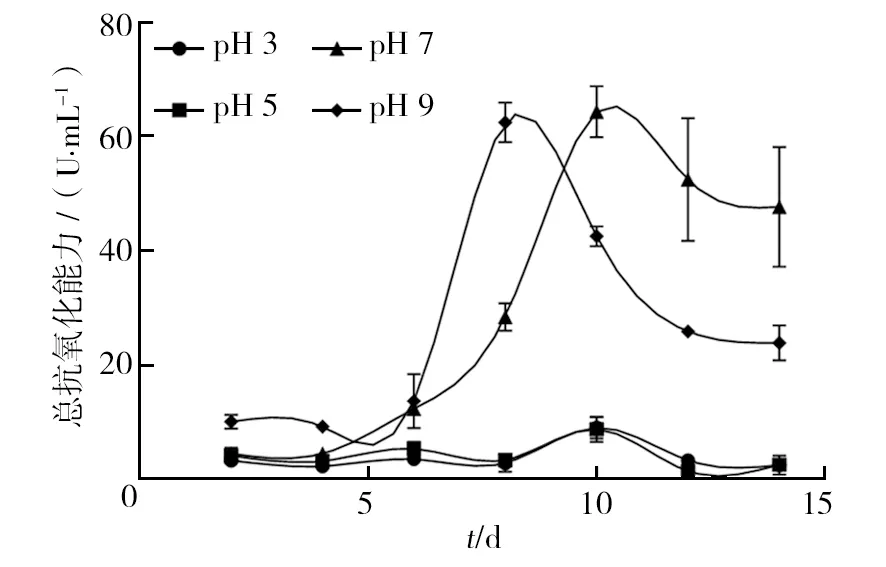
图6 不同pH条件对血红密孔菌总抗氧化能力的影响Fig.6 Effects of different pH conditions on the total antioxidant capacities of Pycnoporus sanguineus
3 讨 论
在不同的培养条件下,光照和pH值是真菌发酵过程中最重要的环境因素[23-24],对细胞的生长、产物的合成都有重要影响,进而影响其产量和抗氧化活性[25-26]。本研究通过测定血红密孔菌培养过程中的生物量、DPPH自由基清除能力、T-AOC,探索了光照和pH对血红密孔菌生长及抗氧化活性的影响,为进一步研究和利用血红密孔菌提供参考。
研究表明,不同光照和pH条件对血红密孔菌培养过程中生物量、DPPH自由基清除率、T-AOC和多糖含量都有差异,但其影响程度不同。总体而言,黑暗环境更利于血红密孔菌的生长以及抗氧化活性的增强,且二者的增长趋势比较一致。相对于14 d光照和1 d光照、1 d黑暗交替的光照条件,血红密孔菌在14 d黑暗环境中有最大生物量,为4.49 g/L,是其他光照条件的1.5倍,同时中间生长过程伴随有基质的大量消耗;T-AOC于第12天达到最高值25.10 U/mL。不同pH条件对血红密孔菌培养过程中各项指标影响有一定差异。偏酸环境更适于血红密孔菌的生长,但中性和偏碱环境抗氧化能力较高[27]。当pH为5时血红密孔菌在培养过程中产生的生物量在第10天达到最大值,为1.69 g/L。而DPPH自由基清除能力和T-AOC的最高值均出现在pH 7时,于第10天分别达到94.99 %和64.34 U/mL。本研究初步分析了光照和pH值对血红密孔菌的生长与抗氧化能力的影响,为相关研究的细致分析,以及为分离分析该菌的抗氧化生理活性物质等相关工作提供参考,以促进开发和利用该菌的药用价值。
