HPLC同时测定关节炎大鼠血清色氨酸和犬尿氨酸
2019-09-11杨雪枝赵英杰张冰洁李丝雨张斌斌
韩 萍,杨雪枝,赵英杰,张冰洁,李丝雨,张斌斌,常 艳,魏 伟
类风湿关节炎(rheumatoid arthritis, RA)是一种复杂的自身免疫病,特征是慢性滑膜炎症和关节破坏,发病机制尚不清楚[1]。色氨酸(L- tryptophan, Trp)是人体必需氨基酸,可以调节适应性免疫[2-3],多数Trp代谢是沿着犬尿氨酸(L- kynurenine, Kyn)途径代谢的,该途径产生Kyn及一系列代谢产物,参与炎症免疫反应[4]。大鼠佐剂性关节炎(adjuvant arthritis, AA)模型在病理机制等方面与人的RA相似,是研究RA较为理想的模型之一[5]。本实验通过建立AA模型,检测正常和模型大鼠血清中Trp和Kyn含量变化,目前主要采用高效液相色谱法(high performance liquid chromatography, HPLC)检测Trp和Kyn的含量[6-7],在制备标准曲线等时对使用的血清进行了透析,此法可在同时测定Trp和Kyn的条件下,减少干扰因素。
1 材料与方法
1.1 样本动物为健康雄性SD大鼠20只,合格证号:[SCXK(皖)2017-001],体质量(170±20)g,购自安徽医科大学实验动物中心。样本的收集AA大鼠成模后处死取血于15 ml离心管中,静置2 h后,2 000 r/min离心20 min,取上清液,并于-20 ℃保存。
1.2 仪器Agilent1200高效液相色谱仪(美国安捷伦公司);Sigma 3- 30K高速冷冻离心机(上海纳腾仪器有限公司);AA- 200DS电子分析天平(美国Denver仪器公司);Amicon Uitra- 0.5超滤离心机(美国Millipore公司)。
1.3 试剂L- Trp(WXBC4097V)、L- Kyn(BCBT1074)购自德国SIGMA- ALORICH,纯度≥98%;冰醋酸(20170106)、醋酸钠(20170320)、高氯酸(20170204)均为分析纯,购自中国医药集团化学试剂有限公司。
1.4 AA大鼠模型的制备将大鼠随机分为两组,即对照组和模型组,每组10只。将 BCG 80 ℃水浴灭活1 h,与经过高压灭菌的石蜡充分研磨,制成10 mg/ml完全弗氏佐剂(complete freund adjuvant,CFA),于大鼠右后足跖皮内注射CFA 0.1 ml致炎[8],正常组用生理盐水同法注射。
1.5 溶液的配制
1.5.1储备液配制 精密称取L- Trp对照品40.90 mg,L- Kyn对照品2.08 mg,用体积百分比为2.5%的高氯酸溶解,定容至10 ml容量瓶中,得浓度20 000 μmol/L、1 000 μmol/L对照品储备液,4 ℃保存,用时稀释。
1.5.2流动相溶液配制 精密称取醋酸钠4.922 8 g, 加纯水溶解于100 ml容量瓶中定容,制成600 mmol/L储备液。用时加纯水稀释得15 mmol/L溶液,冰醋酸调节pH至4,再用0.45 μm微孔滤膜过滤。
1.5.3血清透析 将透析袋在体积2% (w/v) NaHCO3和1 mmol/L EDTA(pH 8.0)中将透析袋煮沸10 min,再放在1 mmol/L EDTA(pH 8.0)中煮沸10 min,冷却后放于4 ℃。将需要透析的血清装入透析袋,放入KrebsRinger磷酸盐缓冲液[78.1% NaCl溶液,2.3% CaCl2-2H2O溶液,3.1% KCl溶液,0.8% MgSO4-7H2O,15.6%Na2HPO4-HCl缓冲液(pH 7.4)]中,血清:缓冲液(1 ∶25,v/v),于4 ℃透析36 h,缓冲液每8~10 h更换1次,至少更换3次。
1.5.4供试品溶液的配制 取透析血清100 μl于离心管中,加入100 μl 5%高氯酸,充分混匀,14 000 r/min离心10 min,取上清液用0.22 μm微孔滤膜过滤,取20 μl进样。
1.6 色谱条件色谱柱:Agilent TC- C18(250 mm×5 mm, 5 μm);流动相 ∶乙腈 ∶醋酸钠(体积百分比8 ∶92);流速1.0 ml/min;Trp紫外检测波长:280 nm;Kyn紫外检测波长:360 nm;柱温:30 ℃;进样量:20 μl。

2 结果
2.1 AA大鼠模型的建立模型组大鼠在免疫后第14天出现继发病变,出现足爪红肿,体质量减轻,全身评分、关节炎指数、关节肿胀数和足爪肿胀度明显增加,与正常组比较,差异有统计学意义(P<0.01)。见图1~6。

图1 肉眼观察大鼠足爪肿胀
2.2 HPLC方法学结果
2.2.1专属性实验 在1.6项色谱条件下分别对空白血清、空白血清加对照品溶液、供试品溶液进样分析,Trp保留时间9.0 min,Kyn保留时间5.6 min,峰形良好,样品中其他内源性物质不干扰测定,与杂质分离良好。结果见图7~9。

图2 大鼠全身评分

图3 大鼠关节炎指数

图4 大鼠关节肿胀数

图5 大鼠足爪肿胀度
2.2.2线性关系考察
2.2.2.1Trp标准曲线 取20 000 μmol/L Trp对照品储备液,加入空白血清中,使Trp浓度分别为25、50、100、250、500、1 000 μmol/L,并按1.5.4中供试品溶液处理后进行HPLC分析。以加入对照品溶液样品峰面积(Y)对浓度(X)进行线性回归,得标准曲线方程,Trp:Y=2.387 8X-6.893 5,R2=0.999 8, Trp在25~1 000 μmol/L范围内线性关系良好。见表1。
2.2.2.2Kyn标准曲线 取1 000 μmol/L Kyn对照品储备液,加入空白血清中,使Kyn浓度分别为0.5、1、2、5、10、20 μmol/L,并按1.5.4中供试品溶液处理后进行HPLC分析。得标准曲线方程,Kyn:Y=2.753 8X-1.156 6,R2=0.999 3, Kyn在0.5~20 μmol/L范围内线性关系良好。见表2。

图6 大鼠体质量变化
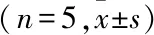
表1 Trp标准曲线
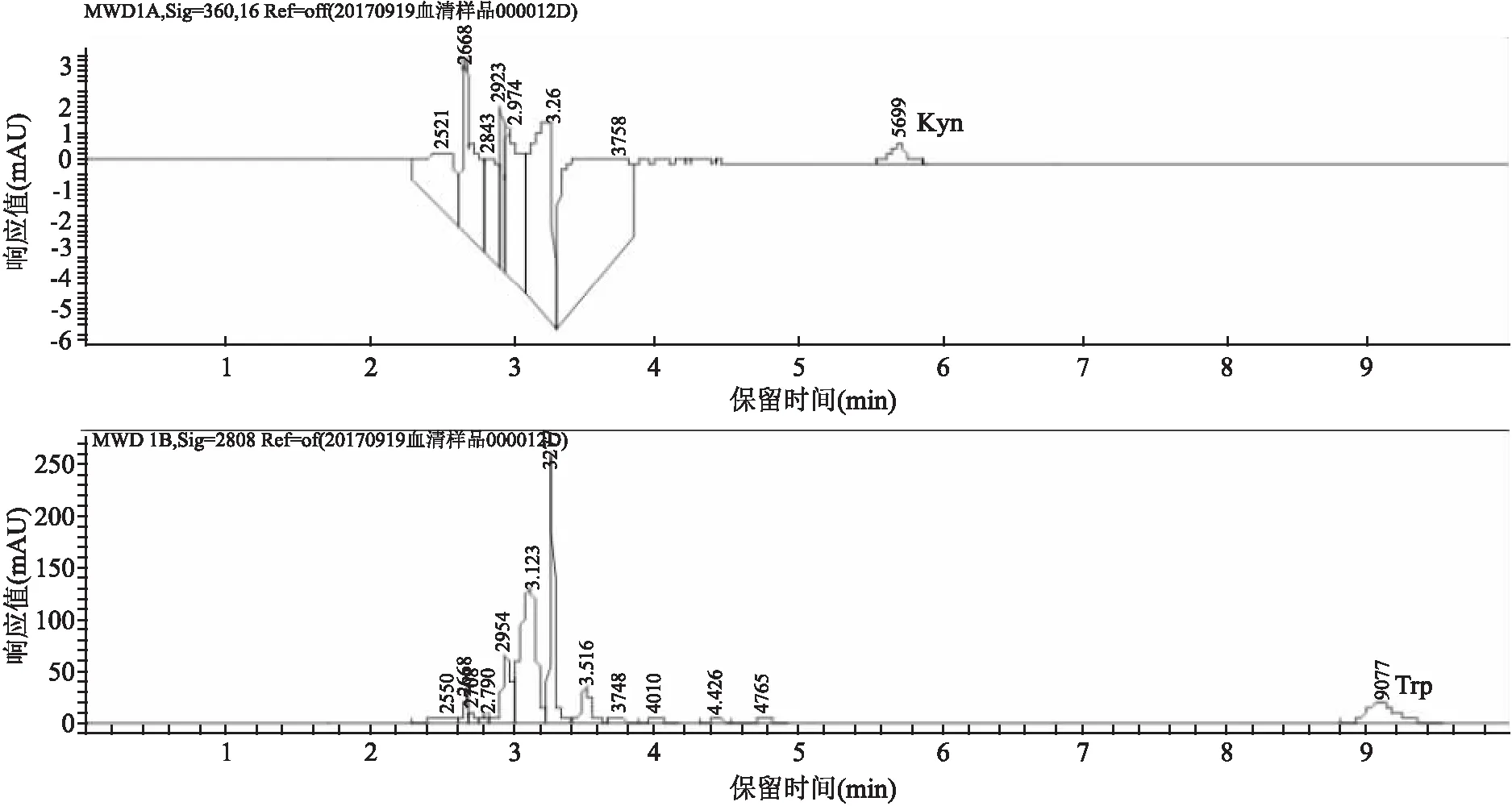
图7 空白血清Kyn和Trp色谱图

编号123456浓度(μmol/L)0.51251020峰面积0.96±0.271.68±0.424.94±0.1512.80±0.7025.88±1.7154.20±2.33

图8 空白血清外加对照品色谱图
2.2.3检测限和定量限 在血清中加入一定量的对照品溶液,按1.5.4项中样品处理方法进行HPLC分析并做3次平行实验。按信噪比(S/N)为3计检测限,Trp、Kyn检测限分别为0.27 μmol/L、0.07 μmol/L;按S/N为10计定量限,Trp、Kyn定量限分别为0.83 μmol/L、0.56 μmol/L。
2.2.4回收率(准确度)试验 取Trp和Kyn对照品溶液加入到空白血清中制成低、中、高3个浓度的标准血样,处理后进行HPLC分析,每个浓度1 d内平行配制3个样品,测定回收率,Trp回收率为96.71%~112.58%,Kyn回收率为92.60%~117.82%。见表3。
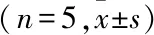
表3 Trp和 Kyn回收率

图9 实际样品Trp和Kyn色谱图

活性物质浓度(μmol/L)日内精密度实际样品浓度(μmol/L)RSD(%)日间精密度实际样品浓度(μmol/L)RSD(%)Trp5054.13±2.684.9553.65±2.414.49250242.39±3.451.43244.57±4.021.65500812.96±29.763.67816.58±26.733.27Kyn11.090±0.0978.901.100±0.0837.5555.756±0.1462.545.690±0.1332.341012.009±0.2812.3411.893±0.3723.13
2.2.5精密度试验 取Trp和Kyn对照品溶液加入空白血清中制成低、中、高3个浓度标准血样,每个浓度水平1 d内平行配制3个样品,测定日内精密度,每个浓度水平3 d内测定3次,计算日间精密度。Trp和Kyn相对标准偏差(RSD)均小于15%,符合样品分析要求。见表4。
2.2.6稳定性试验 取Trp和Kyn对照品溶液加入血清中,供试品分别在4 ℃、25 ℃下放置。将供试品分别在0、4、8、12、16、20、24 h测定Trp和Kyn含量考察其稳定性,结果表明样品在4 ℃和25 ℃均可稳定放置24 h,稳定性较好,符合生物样品稳定性测定的要求。
2.3 实际样品中Trp和Kyn测定用上述建立的方法测定了正常组和模型组大鼠血清中Trp和Kyn浓度。经分析,模型组和正常组的差异有统计学意义(P<0.01),与正常组比较,Trp的浓度降低,Kyn的浓度升高,Kyn/Trp比值升高。见表5。
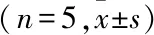
表5 实际样品测定结果
与正常组比较:**P<0.01
3 讨论
由于Kyn代谢与炎症免疫之间有着密切的关系,Kyn已成为RA等多种疾病的参与者[9]。在正常机体中,Trp和Kyn维持着一个动态平衡,但当体内的Trp和Kyn含量变化时,机体会诱发各种疾病,例如自身免疫病或恶性肿瘤等[4,10]。吲哚胺2,3双加氧酶(indoleamine2,3- dioxygenase,IDO1) 是此代谢通路的限速酶之一,目前大多数的研究是采用测定Kyn和Trp比值来评价IDO1的活性[11],定量测定体内Trp和Kyn浓度为诊断相关疾病提供了重要的依据。
大鼠体内的Trp和Kyn均为内源性物质,建立方法学时需采用不含待测物的空白血清,排除血清自身Trp和Kyn对定量测定的干扰,本实验采用Krebs- Ringer磷酸盐缓冲液进行血清透析,可获得不含或含极少量内源性物质的空白血清样本。为了更进一步提高测定的准确性,还采用了标准加入法对Trp和Kyn进行检测[12]。用HPLC测定血清中Trp、Kyn时需去除血清中的蛋白,本实验采用高氯酸蛋白沉淀法,无需衍生化处理与梯度洗脱,并与之前文献[13]报道相比保留时间缩短,节约时间。本实验流动相中乙腈的比例调到8%,相对于乙腈比例为3%或4%峰面积响应值增大,保留时间缩短。流速太小,峰面积响应值小,出峰时间较长,但流速太大,柱压较大,最终采用1.0 ml/min的流速。
随着对Trp、Kyn及其他代谢产物的的深入研究发现,Kyn是此代谢通路上极为重要的中间代谢物,在多种疾病中有重要作用,与疾病发展密切相关[14],检测Trp和Kyn浓度变得极为重要。结果表明,与对照组比较,AA大鼠Trp和Kyn及其比值都有显著变化,Trp浓度降低,Kyn浓度升高,Kyn/Trp升高,提示Trp- IDO1- Kyn代谢通路异常可能参与RA的发生发展。HPLC有准确、灵敏度高等特点,是现阶段检测Trp和Kyn含量的主要方法。经过本实验实际应用,只需将血清去除蛋白,无需柱前衍生化即可进行测定,且专属性、线性范围、检测限、定量限、准确度、精密度、稳定性等方法学指标均符合测定要求,适用于大鼠体内Trp和Kyn含量测定。
