氯喹抑制阿司匹林诱导的自噬增强其体外抗肝细胞癌作用
2019-09-11王梦琳
王梦琳, 杨 慧, 金 娟
肝癌是常见的恶性肿瘤之一,我国肝癌发病率及死亡率高于同期世界平均水平[1]。阿司匹林(aspirin,ASP)是传统的非甾体抗炎药,2016年作为直结肠癌一级预防药列入指南[2],长期服用ASP可以降低发生结肠癌的风险、抑制肿瘤的转移及改善直结肠癌患者术后生存率,对于其他癌症如乳腺癌、胃癌、肝癌等的生长转移也有一定抑制作用[3]。自噬是真核细胞中广泛存在的现象,具有高度的保守性,涉及一系列连续事件,包括双层膜的形成、伸长、囊泡的成熟及将包裹的细胞质中受损的蛋白及受损的细胞器运输至溶酶体降解,在营养不足、生长因子缺乏、缺氧等应激状态下,细胞内的自噬启动,对维持细胞内环境的稳态及细胞正常生长增殖有重要作用[4]。肝癌发生发展中自噬具有双重作用,在肝细胞癌(hepatocellular carcinoma,HCC)的初始阶段抑制肿瘤的形成,在随后的发展阶段则促进肿瘤形成,并且自噬和肝癌细胞药物抵抗有关[5]。该实验旨在探究ASP对肝癌HepG2、SMMC- 7721细胞生长增殖作用及ASP对肝癌HepG2、SMMC- 7721细胞作用与自噬的关系。
1 材料与方法
1.1 实验材料人肝癌HepG2、SMMC- 7721细胞购于中国科学院上海细胞库;胎牛血清购自浙江天杭生物科技股份有限公司;高糖DMEM培养基购自美国Hyclone公司;ASP购自上海阿拉丁生化科技股份有限公司;氯喹(chloroquine,CQ)、二甲基亚砜(DMSO)及MTT购自美国Sigma公司;兔抗LC3单克隆抗体及兔抗mTOR单克隆抗体购自美国Abcam公司;兔抗C9orf72多克隆抗体购自北京博奥森生物技术有限公司;兔抗AMPK单克隆抗体购自苏州百奇生物科技有限公司;小鼠抗β- actin、辣根酶标记山羊抗小鼠IgG及辣根酶标记山羊抗兔IgG购自北京中杉金桥生物技术有限公司。
1.2 实验仪器超纯水仪(型号:NW 1 CUF)、三气培养箱(型号:HF 100)购自上海力康生物医疗科技控股有限公司;超净工作台(型号:SW- CI- 2F)购自中日合资苏州安泰空气技术有限公司;Counter Star全自动细胞计数仪(型号:IC 1 000)购自上海睿钰生物科技有限公司;Muliskan GO酶标仪(型号:1510)购自美国Thermo Fisher科技公司;电泳仪(型号:PowerPacTMBasic)购自美国Bio- Rad公司;显影仪(型号:4 600 Mini)购自上海欧翔科学仪器有限公司。
1.3 实验方法
1.3.1细胞培养 HepG2、SMMC- 7721细胞培养于含10%胎牛血清、100 U/ml青霉素、100 U/ml链霉素的高糖DMEM培养基中,置于37 ℃、5% CO2细胞培养箱中培养。每2 d换液1次,细胞汇合度达80%~90%时用0.25%胰酶进行消化与传代,取对数生长期细胞进行实验。
1.3.2MTT法检测细胞增殖活性 取对数生长期细胞,常规消化离心收集细胞,接种于96孔板,每孔5 000个,置于37 ℃培养箱中培养过夜,弃去原有培养液,PBS轻洗2遍,加入ASP(0、1.25、2.5、5、10、20 mmol/L)、40 μmol/L CQ及含有CQ的不同浓度ASP(1.25、2.5、5 mmol/L)的DMEM溶液,每孔200 μl,每组设5个复孔,37 ℃培养箱孵育24 h后,避光条件下每孔加入20 μl MTT(5 mg/ml) 溶液,继续孵育4 h后,弃去原有培养液,每孔加入DMSO 150 μl,室温下摇床上振动15 min溶解结晶,490 nm波长检测吸光度(OD)值。细胞增殖率(%)=实验组OD490/对照组OD490×100%。
1.3.3细胞克隆形成实验 取对数生长期细胞,常规消化收集细胞,接种于6孔板中,每孔1 000个,37 ℃培养箱培养过夜,贴壁后,更换联合或不联合CQ的含不同浓度ASP(1.25、2.5、5 mmol/L)的DMEM继续培养,同时设不含药物的DMEM对照组,48 h后弃去含药培养液,更换成正常培养基继续培养10 d。弃上清液,PBS漂洗2次,用含有0.1%结晶紫的4%多聚甲醛溶液固定染色30 min,缓慢流水轻轻冲洗洗去染液,倒置室温干燥。拍照,计数肉眼可见克隆数。克隆形成率=实验组克隆数/对照组克隆数×100%。
1.3.4Western blot法测定蛋白表达 收集对数生长期细胞,接种于6孔板中,分组同1.3.3,细胞汇合度达70%~80%时,更换不同含药DMEM培养液,8 h后冰上裂解细胞提取细胞蛋白,BCA蛋白定量,变性后蛋白经SDS- PAGE电泳、湿转至PVDF膜后用含5%脱脂奶粉的TBST封闭1 h,一抗(1 ∶1 000)4 ℃孵育过夜,二抗(1 ∶10 000)室温孵育2 h,TBST漂洗后,化学发光法显影,Image J分析条带灰度值。

2 结果
2.1 ASP及联合CQ对HepG2、SMMC- 7721细胞增殖的影响MTT结果显示,不同浓度ASP处理细胞后,与对照组相比ASP 1.25、2.5 mmol/L组对细胞增殖无抑制作用,但随着ASP浓度增加其抑制作用增强,细胞增殖活性显著降低(P<0.001,FHepG2=93.52,FSMMC- 7721=188.1)。ASP联合自噬抑制剂CQ后,与单独使用ASP(1.25、2.5、5 mmol/L)比较,细胞增殖活性显著降低(P<0.001,FHepG2=83.59,FSMMC- 7721=102.0)。见图1。

图1 ASP及联合自噬抑制剂CQ后对肝癌细胞增殖的影响
A:HepG2;B:SMMC- 7721;与对照组比较:***P<0.001;与ASP 1.25 mmol/L组比较:###P<0.001;与ASP 2.5 mmol/L组比较:△△△P<0.001;与ASP 5 mmol/L组比较:▽▽▽P<0.001
2.2 ASP降低HepG2、SMMC- 7721细胞克隆形成细胞克隆形成实验结果显示,与对照组相比,ASP(1.25、2.5、5 mmol/L)抑制细胞克隆形成(PHepG2<0.01,PSMMC- 7721<0.001,FHepG2=9.242,FSMMC- 7721=94.10),ASP联合自噬抑制剂CQ后两种细胞克隆形成率与单独使用ASP(1.25、2.5、5 mmol/L)组相比进一步降低(P<0.001,FHepG2=64.56,FSMMC- 7721=158.00)。见图2。
2.3 ASP及联合CQ后对细胞AMPK、mTOR、LC3、C9orf72表达的影响ASP(1.25、2.5、5 mmol/L)处理两种肝癌细胞后同对照组相比,AMPK表达增加(PHepG2<0.01,PSMMC- 7721<0.5,FHepG2=13.27,FSMMC- 7721=5.112),mTOR表达降低(PHepG2<0.001,PSMMC- 7721<0.001,FHepG2=31.52,FSMMC- 7721=45.81),C9orf72表达增加(PHepG2<0.001,PSMMC- 7721<0.001,FHepG2=34.44,FSMMC- 7721=22.01),HepG2细胞中LC3 Ⅱ/Ⅰ比值增加(P<0.01,F=8.328),SMMC- 7721细胞中LC3 Ⅱ/Ⅰ比值增加不明显。联合自噬抑制剂CQ后同单独使用对应ASP 1.25、2.5、5 mmol/L组相比,LC3 Ⅱ表达、LC3 Ⅱ/Ⅰ比值增加(PHepG2<0.001、0.001、0.01,FHepG2=28.65;PSMMC- 7721<0.01、0.05、0.01,FSMMC- 7721=11.12),SMMC- 7721细胞中AMPK表达降低(P<0.001、0.001、0.01,F=23.64),HepG2细胞中联合CQ的ASP 2.5、5 mmol/L组AMPK表达降低(P<0.01,F=12.77),ASP联合自噬抑制剂CQ处理后的HepG2细胞中C9orf72表达增加(P<0.05、0.01、0.001,F=60.44)。见图3、表1、2。
3 讨论
肝癌是常见的恶性肿瘤之一,2010年全国肝癌发病率占全国癌症发病率第三位,显著高于同期全球、亚洲及发达地区;2012年我国肝癌患者死亡人数达38万,占全球肝癌死亡人数的51%,占同期全国癌症死亡总数的17.4%[1]。肝细胞癌是肝癌中最常见的一种,在HCC发生发展中自噬起着双重作用,在损伤阶段,酒精、病毒感染等因素可激活肝细胞中的自噬,敲除自噬相关基因(ATG)后,自噬发生受抑制,肝损伤增加,肝细胞在丙型肝炎病毒(HCV)的作用下更容易发生恶变[5];而肿瘤形成后,自噬可以使肝癌细胞在缺血、缺氧环境中得以生存[6]。自噬的发生与肝癌细胞药物抵抗有关,抑制自噬,肝癌细胞对抗癌药物的敏感性增加,目前已有自噬抑制剂CQ、羟氯喹与抗癌药物联用进行的临床试验[5]。CQ是一种常见的自噬抑制剂,通过抑制自噬体与溶酶.体融合及融合后物质降解抑制自噬[7]。
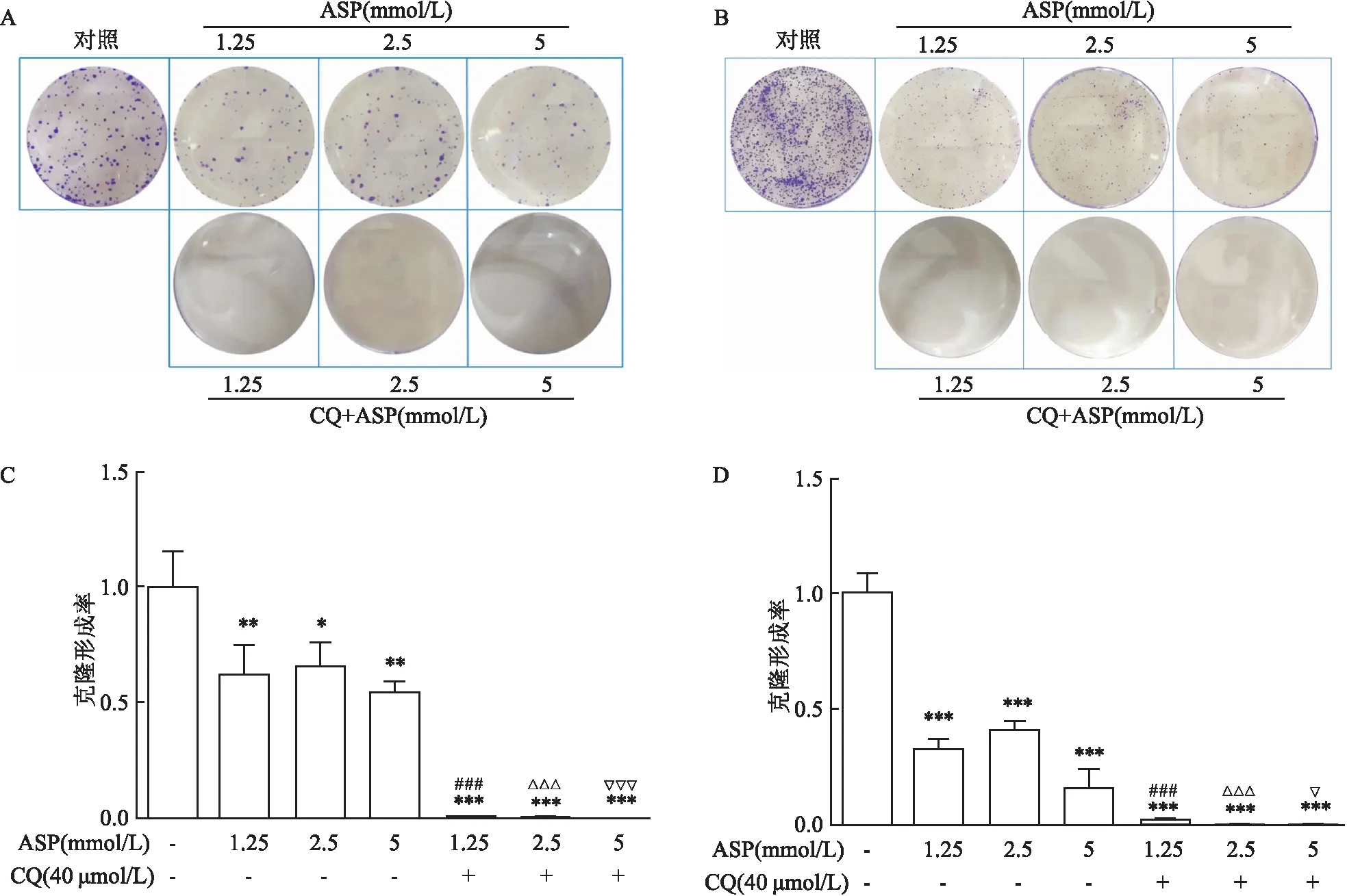
图2 ASP及联合自噬抑制剂CQ后对肝癌细胞增殖的影响及统计分析
A:HepG2;B:SMMC- 7721;C:HepG2细胞克隆形成率;D:SMMC- 7721 细胞克隆形成率;与对照组比较:*P<0.01,**P<0.01,***P<0.001;与ASP 1.25 mmol/L组比较:###P<0.001;与ASP 2.5 mmol/L组比较:△△△P<0.001;与ASP 5 mmol/L组比较:▽P<0.05,▽▽▽P<0.001)

图3 ASP及联合自噬抑制剂CQ后肝癌HepG2(A)、SMMC- 7721(B)细胞内AMPK、mTOR、C9orf72、 LC3蛋白的表达

组别AMPKmTORC9orf72LC3Ⅱ/Ⅰ对照1.000±0.2001.000±0.0831.000±0.0431.508±0.172ASP 1.25 mmol/L1.804±0.3100.503±0.083∗∗∗1.345±0.052∗∗∗2.649±0.594∗ASP 2.5 mmol/L3.551±0.824∗∗0.767±0.097∗1.333±0.063∗∗2.587±0.300∗ASP 5 mmol/L2.735±0.544∗∗0.430±0.050∗∗∗0.950±0.0833.110±0.437∗∗∗CQ+ASP 1.25 mmol/L2.875±0.591∗∗#0.677±0.082∗∗#1.581±0.073∗∗∗##5.187±0.358∗∗∗###CQ+ASP 2.5 mmol/L1.274±0.076△△0.864±0.0491.546±0.107∗∗∗△5.073±0.798∗∗∗△△△CQ+ASP 5 mmol/L1.476±0.186▽▽0.216±0.050∗∗∗▽▽2.232±0.179∗∗∗▽▽▽4.460±0.165∗∗∗▽▽
与对照组比较:*P<0.05,**P<0.01,***P<0.001;与ASP 1.25 mmol/L组比较:#P<0.05,##P<0.01,###P<0.001;与ASP 2.5 mmol/L组比较:△P<0.05,△△P<0.01,△△△P<0.001;与ASP 5 mmol/L组比较:▽▽P<0.01,▽▽▽P<0.001

表2 各组SMMC- 7721细胞中AMPK、mTOR、C9orf72蛋白的表达及LC3 Ⅱ/Ⅰ比值
与对照组比较:*P<0.05,**P<0.01,***P<0.001;与ASP 1.25 mmol/L组比较:#P<0.05,##P<0.01,###P<0.001;与ASP 2.5 mmol/L组比较:△P<0.05,△△△P<0.001;与ASP 5 mmol/L组比较:▽▽P<0.01
mTOR是真核细胞启动自噬中一个关键的抑制性调节因子,受多条通路调节,激活mTOR的通路如Akt和MAPK信号通路,负调控mTOR的通路如AMPK和p53信号通路。mTOR抑制剂雷帕霉素作为常用自噬诱导剂显示出了抗肿瘤作用[8]。人9号染色体72号开放阅读框(Chromosome 9 open reading frame 72,C9orf72)基因非编码区中GGGGCC序列病理性重复性扩增是额颞叶痴呆(FTD)和肌萎缩性脊髓硬化症(ALS)的主要遗传原因[9],其编码的C9orf72蛋白功能尚不明确。目前研究发现C9orf72与Rab1a和 ULK1复合物相互作用参与调节自噬起始[10],与SMCR8和WDR41结合调节自噬溶酶体途径,在C9orf72-/-小鼠中自噬受损[11]。但Ugolino et al[12]研究认为,敲低C9orf72后通过下调mTOR、活化TFEB信号,增强自噬活性。以上提示了C9orf72在自噬发生过程中发挥多重作用。
ASP抗HCC作用被广泛研究,小剂量服用ASP可以降低患HCC的风险,乙型肝炎病毒相关HCC患者行肝切除术,术后使用ASP可有效改善患者预后[13],小剂量ASP诱导HepG2细胞自噬,降低抗HCC作用[14]。本研究显示,ASP(1.25、2.5、5 mmol/L)抗肝癌HepG2及SMMC- 7721细胞作用不明显,联合自噬抑制剂CQ后抑制作用增加。ASP处理两种细胞后,细胞中C9orf72、AMPK表达增加, mTOR表达降低,LC3 Ⅱ/Ⅰ比值增加,提示ASP(1.25、2.5、10 mmol/L)可能通过AMPK/mTOR通路激活自噬,C9orf72也可能参与其中;联合自噬抑制剂后,CQ破坏自噬体和溶酶体融合及随后内容物的降解使自噬体细胞内堆积,LC3 Ⅱ表达增加。综上所述,CQ可以通过抑制自噬,增加ASP体外抗肝癌细胞的作用,但其机制还需进一步研究。
