体外siRNA- Nav1.5干扰口腔鳞癌HSC- 3细胞生物学行为研究
2019-09-11戴永铮钱成炜徐小立
戴永铮,钱成炜,徐小立,蒋 勇
口腔鳞状细胞癌复发率高、生存周期短,手术治疗的局限性造成治疗效果差,因而新的治疗方法对提高患者生存率具有重要意义。电压门控钠离子通道(voltage- gated sodium channel,VGSC)是一种跨膜糖蛋白,由一个α亚基和多个β亚基组成。根据α亚基的不同可将其分为9种,即Nav1.1- Nav1.9[1]。近年来一些研究发现, Nav1.5在包括前列腺癌[2]、乳腺癌[3]、卵巢癌[4]、宫颈癌[5]和非小细胞肺癌[6]等多种肿瘤中高表达,对肿瘤的增殖、侵袭等生物学过程具有明显的调节作用。在口腔鳞癌中,研究[7]显示Nav1.5在癌组织中的表达相比正常组织明显升高,但其在口腔鳞癌中的表达调控机制研究甚少。该研究通过检测Nav1.5的表达水平变化以及在增殖和侵袭中具有重要作用的相关蛋白检测,来分析其对口腔鳞癌细胞增殖和侵袭的作用,为口腔鳞癌的靶向治疗寻求新的思路。
1 材料与方法
1.1 主要材料和仪器DMEM培养基购自美国Hyclone公司;胎牛血清购自以色列Biolnd公司;胰酶消化液、细胞增殖核抗原(proliferating cell nuclear antigen,PCNA)、 RIPA 裂解液、蛋白酶抑制剂、磷酸酶抑制剂、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;Nav1.5多克隆抗体购自美国Abcam公司;基质金属蛋白酶2(matrix metalloproteinase 2,MMP- 2)、 MMP- 9多克隆抗体购自美国santa cruz公司;山羊抗鼠、抗兔IG抗体购自北京中杉金桥公司;CCK8试剂盒购自日本同仁公司;PCR引物购自上海生物工程股份有限公司;逆转录试剂盒、 实时荧光定量PCR(Real Time- PCR,RT- PCR)试剂盒购自日本Takara公司; PVDF 膜购自美国Invitrogen公司;Matrigel胶、Transwell小室购自美国Corning公司;siRNA- Nav1.5购自上海吉玛公司;lipo2000、CO2恒温孵箱购自美国Thermo Fisher公司;RT- PCR仪购自美国Stratagene公司;酶标仪购自美国Bio- tek公司。收集安徽医科大学第一附属医院口腔颌面外科口腔鳞癌组织(2例)和正常口腔黏膜组织(牙龈2例),标本取下直接保存于-80 ℃备用。
1.2 实验方法
1.2.1组织免疫组化 4%甲醛固定组织6 h,石蜡包埋,4 μm厚切片,60 ℃烤片4 h,脱蜡至水,抗原修复,3% H2O2室温孵育10 min,1 ∶200稀释Nav1.5一抗4 ℃孵育过夜(16 h左右),HRP二抗37 ℃、 30 min,DAB显色,苏木精复染,封片,镜下观察。
1.2.2细胞培养 HSC- 3细胞在含10% FBS、100 U/ml青霉素和100 U/ml链霉素DMEM培养基中,放入37 ℃、5% CO2培养箱培养。每3 d传代一次。
1.2.3免疫荧光实验 将细胞以5×105个/ml的密度接种于共聚焦小皿,孵箱过夜。4%多聚甲醛室温下固定30 min,0.5% Trixton X- 100室温下穿通20 min,1% BSA封闭细胞30 min, 加入Nav1.5的一抗(6 μg/ ml)冰箱孵育24 h,次日室温孵育1 h。 加入罗丹明标记的二抗(1 ∶50)避光孵育2 h,DAPI(1 ∶2 000)避光孵育8 min。在Zeiss LSM510共聚焦成像系统下观察细胞。
1.2.4siRNA转染实验 美国国立生物技术信息中心(national center for biotechnology information,NCBI)上查找Nav1.5的序列,根据目的基因序列设计合成3条Nav1.5的小干扰RNA(small interfering RNA,siRNA)组,以及一条阴性对照(negative control,NC)组,同时设置空白对照(control,CON)组,序列见表1。转染前1 d,将2×105个/ml细胞接种于培养板中,每孔中加入约500 μl无抗生素的培养基。取1 μl/孔lipo2000,用50 μl opti- MEM无血清培养基稀释,并室温孵育5 min。取2 μl siRNA,以50 μl opti- MEM无血清培养基稀释,混匀。2种液体轻轻混匀,室温静置20 min。加入含有细胞及培养液的孔中,混匀。转染6 h后,换为含血清的完全培养基。见表1。
1.2.5RT- PCR检测 按TRIzol试剂盒说明书提取各组细胞总RNA,使用PrimeScriptTM- PCR kit逆转录试剂盒逆转录成cDNA,然后以此为模板,用目标基因的引物进行扩增和检测。反应条件:95 ℃、1 min,60 ℃、30 s,72 ℃、30 s。每个样品设置3个复孔,PCR的所有引物均由上海生物工程公司进行设计合成,序列见表2。

表2 引物序列
1.2.6Western blot 检测 用RIPA细胞裂解液提取各组细胞总蛋白。BCA试剂盒测定各组蛋白浓度,调整各组浓度一致后,99 ℃、10 min使蛋白变性,SDS- PAGE凝胶电泳,然后转移至0.45 μm的PVDF膜上,5% BSA封闭,一抗、二抗孵育,经ECL曝光成像。
1.2.7Transwell实验 Matrigel胶与DMEM培养基按1 ∶9混匀制成稀释液。小室滤膜均匀涂抹50 μl稀释液,37 ℃、5% CO2恒温箱滞留2 h。取3组培养24 h细胞,0.25%胰酶消化,1 000 r/min离心5 min,弃上清液得下层细胞,DMEM重悬计数,细胞密度调为1×106个/ml。上室加细胞悬液各100 μl,下室加600 μl 20% FBS的DMEM培养液,37 ℃、5% CO2恒温箱孵育24 h,每组细胞设3个复孔。取出小室,吸出上室培养液,擦净上室表面Matrigel胶,4%多聚甲醛固定20 min,结晶紫染色20 min,晾干,拍照,200倍显微镜下计算穿膜细胞数。
1.2.8CCK8检测细胞增殖活性 待检测细胞计数,并铺于96孔板。确定细胞贴壁后,继续培养2~4 h使其贴壁紧密。96孔板每个孔加10 μl CCK8溶液,在培养箱孵育1 h,显色反应后,酶标仪测定450 nm处吸光度值(optical density,OD),每组设5个复孔。根据OD450值绘制12 、24 、48 、72 h柱状图。

2 结果
2.1 组织和细胞中Nav1.5的表达临床收集的正常口腔黏膜组织和口腔鳞癌组织做免疫组化,光镜下观察组织中Nav1.5蛋白表达情况,癌组织中于细胞的胞膜和胞质中出现不同程度的棕黄深染,即Nav1.5蛋白呈阳性表达,在正常口腔黏膜组织中几乎看不到棕黄色,见图1。HSC- 3细胞中免疫荧光染色激光共聚焦镜下观察,在胞质和胞膜上可见荧光标记的Nav1.5呈红色,胞核呈蓝色,Nav1.5在HSC- 3细胞中阳性表达,见图2。

图1 免疫组化法检测Nav1.5蛋白的表达 ×100A:正常组织染色阴性;B:癌组织染色阳性

图2 免疫荧光法检测HSC- 3细胞中Nav1.5的表达 ×200
A:细胞核的染色呈蓝色;B:Nav1.5蛋白的染色呈红色; C:A和B的合成图
2.2 HSC- 3细胞Nav1.5的沉默效率FAM标记的siRNA转染HSC- 3细胞,镜下观察细胞,与明场视野下对比,转染效率较高。RT- PCR和Western blot 结果显示与CON组比较,S1、S2和S3组Nav1.5的mRNA表达均有所下调,S2和S3组下调较多,差异有统计学意义(P<0.01)。CON组和NC组之间差异无统计学意义,见图3。因此以下实验均采用S3转染。
2.3 Nav1.5对HSC- 3细胞增殖和侵袭的影响CCK8检测干扰后的细胞在450 nm处OD值,测量结果显示,在转染48 h后siRNA组(1.31±0.21)与CON组(1.06±0.22)和NC组(0.67±0.09)比较差异有统计学意义(F=9.006,P<0.01),CON组和NC组之间差异无统计学意义,见图4。Transwell侵袭实验结果表明,siRNA组(7.33±1.55)与CON组(55.0±3.00)和NC组(47.0±4.00)比较,穿过小室细胞数明显减少,差异有统计学意义(F=222.7,P<0.001),CON组和NC之间差异无统计学意义,见图5。

图3 经siRNA转染后Nav1.5沉默效率
A:转染FAM标记siRNA明场视野下;B:同一视野下荧光观察×200;C:转染后各组Nav1.5 mRNA相对表达水平;与CON组比较:**P<0.01;D:转然后各组Nav1.5蛋白表达水平;S1、S2和S3分别代表转染不同序列siRNA- Nav1.5

图4 经siRNA干扰后HSC- 3细胞OD450值比较
2.4 RT- PCR和Western blot检测转染siRNA- Nav1.5对相关蛋白表达的影响经siRNA- Nav1.5转染后的HSC- 3细胞内PCNA、MMP- 2和MMP- 9基因水平表达和蛋白水平表达均有所下降,差异有统计学意义(F=15.12、22.89、11.72,P<0.05),见表3和图6、7。
3 讨论
口腔鳞状细胞癌作为颌面部最常见的恶性肿瘤,常常发生区域淋巴结转移,晚期可发生远处转移,严重威胁着人类的健康。为了克服传统手术加放化疗治疗方法的弊端,分子靶向治疗越来越重要。为了寻找更为有效的治疗靶点,在本课题组的早期研究中,刘伟佳 等[7]发现在口腔鳞状细胞癌中,Nav1.5的表达与正常组织相比显著提高,本研究免疫组化结果也得到证实。此外,Nav1.5的表达与组织分化程度和淋巴结转移有关,这提示着Nav1.5有望成为口腔鳞癌治疗的新靶点。

图5 经siRNA转染后HSC- 3细胞侵袭性比较 ×200
A:CON组;B:NC组;C:siRNA组; 与CON组比较:***P<0.001;与NC组比较:###P<0.001
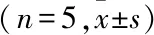
表3 转染siRNA及空白组相关蛋白mRNA表达量
与CON组比较:*P<0.05,**P<0.01,***P<0.001; 与NC组比较:#P<0.05,##P<0.01
近年来,越来越多的研究[8-11]发现Nav1.5与癌症密切相关,并表明Nav1.5在癌症增殖转移中发挥着重要作用。Mohammed et al[8]研究显示Nav1.5在高侵袭性乳腺癌细胞的胞质和核周区域以及板状伪足中表达。本研究免疫荧光共焦显微镜的结果显示HSC- 3细胞中也有着相同分布。为探讨Nav1.5对HSC- 3细胞增殖和侵袭能力的影响,本研究对HSC- 3细胞进行siRNA- Nav1.5干扰实验,RT- PCR和Western blot检测干扰后HSC- 3细胞中Nav1.5出现明显下调后再分别进行Transwell侵袭实验和CCK8检测干扰后细胞增殖OD值,实验结果显示经siRNA- Nav1.5干扰后的HSC- 3细胞的增殖和侵袭能力显著下降。说明Nav1.5在口腔鳞癌细胞生物学特性方面具有重要的调节作用。在乳腺癌的研究[9]中也有着相似的结果,沉默Nav1.5基因后,MDA- MB- 231细胞的侵袭能力显著降低。在结肠癌中,研究[10]表明Nav1.5基因涉及广泛的信号调节并参与肿瘤细胞侵袭的调节,是癌细胞侵袭的关键驱动因子。在动物体内研究[11]中,发现敲低Nav1.5显著抑制了肿瘤的生长和体内局部侵袭。尽管证明了Nav1.5在口腔鳞状细胞癌的生长和转移中起重要作用,但其具体机制尚不清楚。
PCNA与细胞的DNA合成密切相关,在细胞的增殖中起关键作用,也是细胞异常增殖的关键蛋白,有研究[12]表明,相比正常口腔组织在口腔鳞状细胞癌中PCNA过表达,提示其与口腔鳞癌的发生发展过程有关。在本实验中,RT- PCR和Western blot结果显示经siRNA- Nav1.5转染的HSC- 3细胞内PCNA表达下降。对肿瘤侵袭和转移机制的研究发现:细胞外基质(extracellular matrix,ECM)的降解是肿瘤侵蚀正常组织并引发转移的重要途径。基质金属蛋白酶(matrix metalloproteinase ,MMPs)是最重要的,可以降解ECM的所有成分,近年来已成为肿瘤侵袭和转移研究的热点,其中又以MMP- 2和MMP- 9最为重要。Chandolia et al[13]研究发现:相比正常口腔黏膜上皮,口腔鳞癌中MMP- 9表达水平显著提高。在本实验中,转染siRNA- Nav1.5 48 h后HSC- 3细胞内MMP- 2和MMP- 9表达均下调。以上结果说明口腔鳞癌中Nav1.5可能通过直接或间接地调控PCNA、MMP- 2和MMP- 9的表达进而影响着细胞生物学行为的改变。

图6 RT- PCR检测MMP- 2、MMP- 9和PCNA mRNA表达
A:MMP- 2 mRNA相对表达量; B:MMP- 9 mRNA相对表达量; C:PCNA mRNA相对表达量;与CON组比较:*P<0.05,**P<0.01,***P<0.001; 与NC组比较:#P<0.05,##P<0.01

图7 Western blot检测干扰后HSC- 3细胞PCNA、MMP- 2和MMP- 9蛋白的表达变化
与CON组比较:*P<0.05; 与NC组比较:#P<0.05
为了进一步研究证明动物体内Nav1.5的生物学作用,下一步将进行裸鼠皮下造瘤后的进一步动物实验,从而推进Nav1.5作为临床口腔鳞癌治疗靶点的应用。
