mTOR抑制剂通过mTOR通路介导胰腺癌顺铂耐药的机制研究
2019-09-11朱小长陶连元杜瀛瀛
朱小长,陶连元,杜瀛瀛,时 云
胰腺癌(pancreatic carcer,PC)是一种常见的消化道肿瘤,其恶化程度高、病程短,具有早期不易确诊、手术治愈率低、5年生存率不足1%的特点,是预后效果最差的恶性肿瘤之一[1]。目前PC的化疗方案主要以铂类药物为基础,顺铂(cis- dichlorodiamine platinum,DDP)是代表药物之一。DDP属于细胞周期非特异性抗肿瘤药物,与PC肿瘤细胞的DNA结合并抑制其复制转录,促进肿瘤细胞凋亡[2]。大量研究[3]表明PC细胞已经对DDP产生耐药性,雷帕霉素哺乳动物靶点(mammalian target of rapamycin,mTOR)信号通路改变是原因之一。雷帕霉素(rapamycin,RAPA)是一种新型高效低毒的大环内酯类免疫抑制剂,能抑制mTOR信号通路,减缓肿瘤细胞对DDP的耐药性[4]。该研究选取3种PC细胞株,旨在进一步研究RAPA通过mTOR信号通路抑制PC肿瘤细胞作用机制。
1 材料与方法
1.1 细胞系及主要试剂PANC- 1细胞、BxPC- 3细胞、SW1990细胞购自中国北京细胞系资源库;RAPA购自海门市碧云天生物技术研究所;DDP、四甲基偶氮唑盐(methylthio tetrazole,MTT)、二甲基亚砜(DMSO)购自美国Sigma公司;迁移(Transwell)小室、抗磷脂酰肌醇3- 激酶(phosphatidylinositol 3- kinase,PI3K)、磷酸化磷酯酰肌醇- 3激酶(phosphorylated phosphatidylinositol- 3- kinase,p- PI3K)、蛋白激酶B(protein kinase B,AKT)、磷酸化蛋白激酶B(phosphorylated protein kinase B,p- AKT)、mTOR、磷酸化雷帕霉素哺乳动物靶点(phosphorylated mammalian target of rapamycin,p- mTOR)、β- actin、羊抗兔Ig二抗等抗体、胰蛋白酶、青霉素链霉素双抗均购自美国赛默飞世尔科技公司;RPMI- 1640、胎牛血清(FBS)购自美国Gibco公司。
1.2 实验方法用含10%的胎牛血清的达尔伯克必需培养基(dulbecco minimum essential medium,DMEM)(PANC- 1)或RPMI- 1640(BxPC- 3、SW1990)于37 ℃、5% CO2培养箱中培养,取对数期细胞进行实验。
1.2.1划痕修复方法 3种细胞接种于6孔板,待细胞融合度80%,划痕、拍照,去除培养基,加2.5%血清培养基,用含20 mg/L DDP或20 mg/L DDP+10 μmol/L RAPA的血清培养基,培养24 h拍照。划痕修复率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.2.2Transwell方法 用胰蛋白酶消化细胞,去除培养液,磷酸盐缓冲液清洗2次,加无血清培养基调整细胞密度至15×104个/ml,上室接种200 μl细胞液,下室加600 μl 10%的胎牛血清,用20 mg/L DDP或20 mg/L DDP+10 μmol/L RAPA处理细胞12 h,甲醇固定,结晶紫染色,显微镜下观察并计算穿膜细胞数。
1.2.3MTT方法 胰蛋白酶消化细胞,接种于96孔板,每孔5×103个细胞,孵育12 h,细胞贴壁后吸去培养基,加入DDP及0、5、10、20 μmol/L RAPA血清培养基200 μl,每24 h换液1次,48 h后加入MTT 20 μl,培养4 h,去除培养基加入DMSO 150 μl,避光摇10 min,取100 μl,490 nm检测光密度(optical density,OD)值,计算DDP对细胞株的半抑制浓度(50% inhibiting concentration,IC50)。每组6孔,重复3次,取平均值。
1.2.4Western blot方法 取总蛋白,上样10 μg,SDS- PAGE分离蛋白,转印PVDF,牛血清白蛋白封闭1 h,加一抗,4 ℃过夜,TBST洗涤3次,加二抗孵育2 h,加ECL发光液,拍照,分析条带灰度。

2 结果
2.1 RAPA抑制胰腺癌细胞株迁移能力划痕实验显示,单用DDP 时,PANC- 1、BxPC- 3、SW1990三种耐DDP细胞株均具有较强的迁移能力,PANC- 1的迁移能力最强,其次为SW1990、BxPC- 3。联合RAPA,3株耐药株的迁移能力均显著低于未加RAPA(P<0.01),见表1、图1。

表1 RAPA抑制胰腺癌细胞株迁移能力
2.2 RAPA抑制胰腺癌细胞株侵袭能力Transwell实验显示:单用DDP,PANC- 1、BxPC- 3、SW1990三种耐DDP细胞株均具有较强的侵袭能力,联合RAPA,3株耐药株的侵袭能力显著降低(P<0.01),见表2、图2。

表2 RAPA抑制胰腺癌细胞株侵袭能力
2.3 RAPA降低胰腺癌细胞株IC50划痕修复实验及Transwell实验显示:10 μmol/L RAPA能抑制PANC- 1、BxPC- 3、SW1990耐药株的迁移能力和侵袭能力,故进一步设计DDP联合不同浓度梯度的RAPA,考察DDP对3种细胞株的IC50的变化。结果显示:未加RAPA时,3株细胞株的IC50较高,加入5、10、20 μmol/L RAPA,3株细胞株的IC50显著降低(P<0.01),见表3。
2.4 RAPA抑制PANC- 1细胞株PI3K/AKT/mTOR通路的蛋白表达Western blot实验显示:单用DDP时,PANC- 1耐药株的PI3K、p- PI3K、AKT、p- AKT、mTOR、p- mTOR蛋白表达量较高,联合加入5、10、20 μmol/L RAPA后,PANC- 1耐药株的PI3K、p- PI3K、AKT、p- AKT、mTOR、p- mTOR蛋白表达量显著降低(P<0.01),见图3。
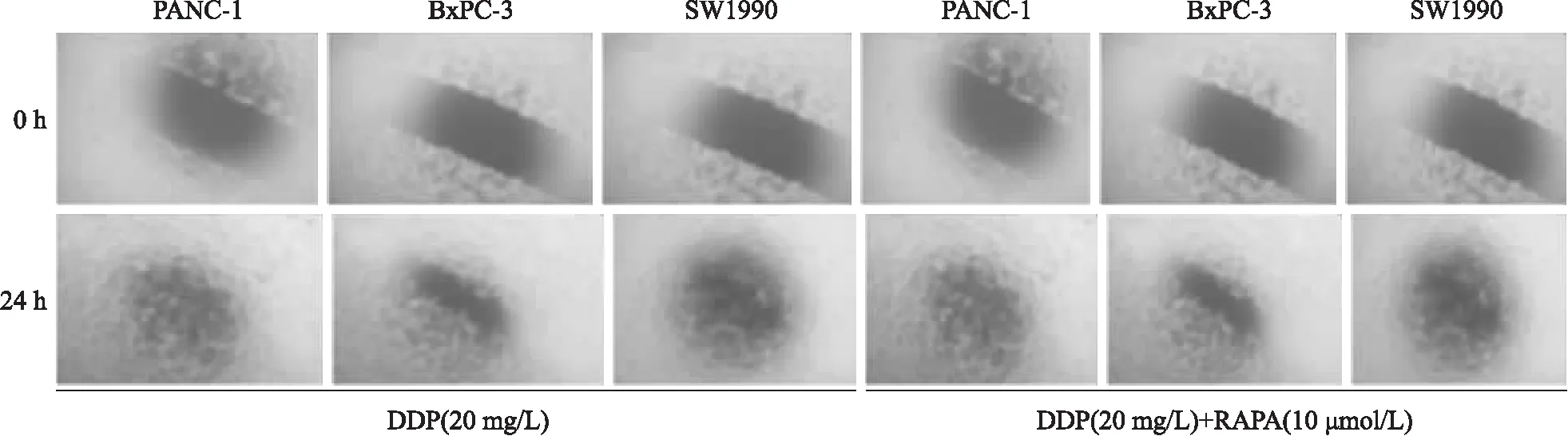
图1 划痕修复实验结果 ×40

图2 Transwell实验结果 ×100

组别DDPDDP+RAPA(5 μmol/L)DDP+RAPA(10 μmol/L)DDP+RAPA(20 μmol/L)t值P值PANC-142.31±4.6834.59±4.22∗∗23.38±4.24∗∗##13.78±3.11∗∗##ΔΔ55.90<0.01BxPC-337.58±4.2430.24±3.52∗∗18.34±4.01∗∗##10.36±3.24∗∗##ΔΔ62.01<0.01SW199033.69±3.5727.21±3.28∗∗18.34±3.21∗∗##12.24±3.14∗∗##ΔΔ49.36<0.01
与对照组比较:**P<0.01;与低剂量组比较:##P<0.01;与中剂量组比较:ΔΔP<0.01

图3 RAPA对 PANC- 1 细胞蛋白表达的影响
A:DDP;B:DDP+RAPA(5 μmol/L);C:DDP+RAPA(10 μmol/L);D:DDP+RAPA(20 μmol/L);与DDP组比较:**P<0.01;与DDP+RAPA (5 μmol/L)组比较:##P<0.01;与DDP+RAPA(10 μmol/L)组比较:ΔΔP<0.01
2.5 RAPA抑制BxPC- 3细胞株PI3K/AKT/mTOR通路的蛋白表达Western blot实验结果显示:仅加入20 mg/L DDP 时,BxPC- 3耐药株的PI3K、p- PI3K、AKT、p- AKT、mTOR、p- mTOR蛋白表达量较高,联合加入5、10、20 μmol/LRAPA后,BxPC- 3耐药株的PI3K、p- PI3K、AKT、p- AKT、mTOR、p- mTOR蛋白表达量显著降低(P<0.01),见图4。
2.6 RAPA抑制SW1990细胞株PI3K/AKT/mTOR通路的蛋白表达Western blot实验显示:仅加入20 mg/L DDP 时,SW1990耐药株的PI3K、p- PI3K、AKT、p- AKT、mTOR、p- mTOR蛋白表达量较高,联合加入5、10、20 μmol/L RAPA,SW1990耐药株的mTOR蛋白表达量降低,三组间差异无统计学意义(P>0.05);SW1990耐药株的PI3K、p- PI3K、AKT、p- AKT、p- mTOR蛋白表达量显著降低(P<0.01),见图5。
3 讨论
研究[5]表明,肿瘤细胞的化药耐药是导致化疗失败的重要原因,根据耐药性产生的机制,可分为原发性耐药(primary drug resistance,PDR)和多药耐药(multidrug resistance,MDR),PDR 仅对诱导药物产生耐药,MDR不仅对诱导药物产生耐药,还对结构不同、作用机制不同的药物产生耐药,是肿瘤化疗失败的首要原因,抑制多药耐药蛋白,能增加DDP 对耐药基因DNA的损伤。细胞产生耐药性的机制最主要有:① 细胞内药物浓度下降:肿瘤细胞膜改变使药物不易进入细胞内,或肿瘤细胞增加药物外排,最终使细胞内药物浓度下降,不能达到最低有效浓度[6];② 肿瘤细胞凋亡程序改变,例如,肿瘤细胞损伤激活细胞PI3K/AKT/mTOR信号通路,增强肿瘤细胞DNA损伤修复机制,改变信号通路相关基因活性[7-8]。
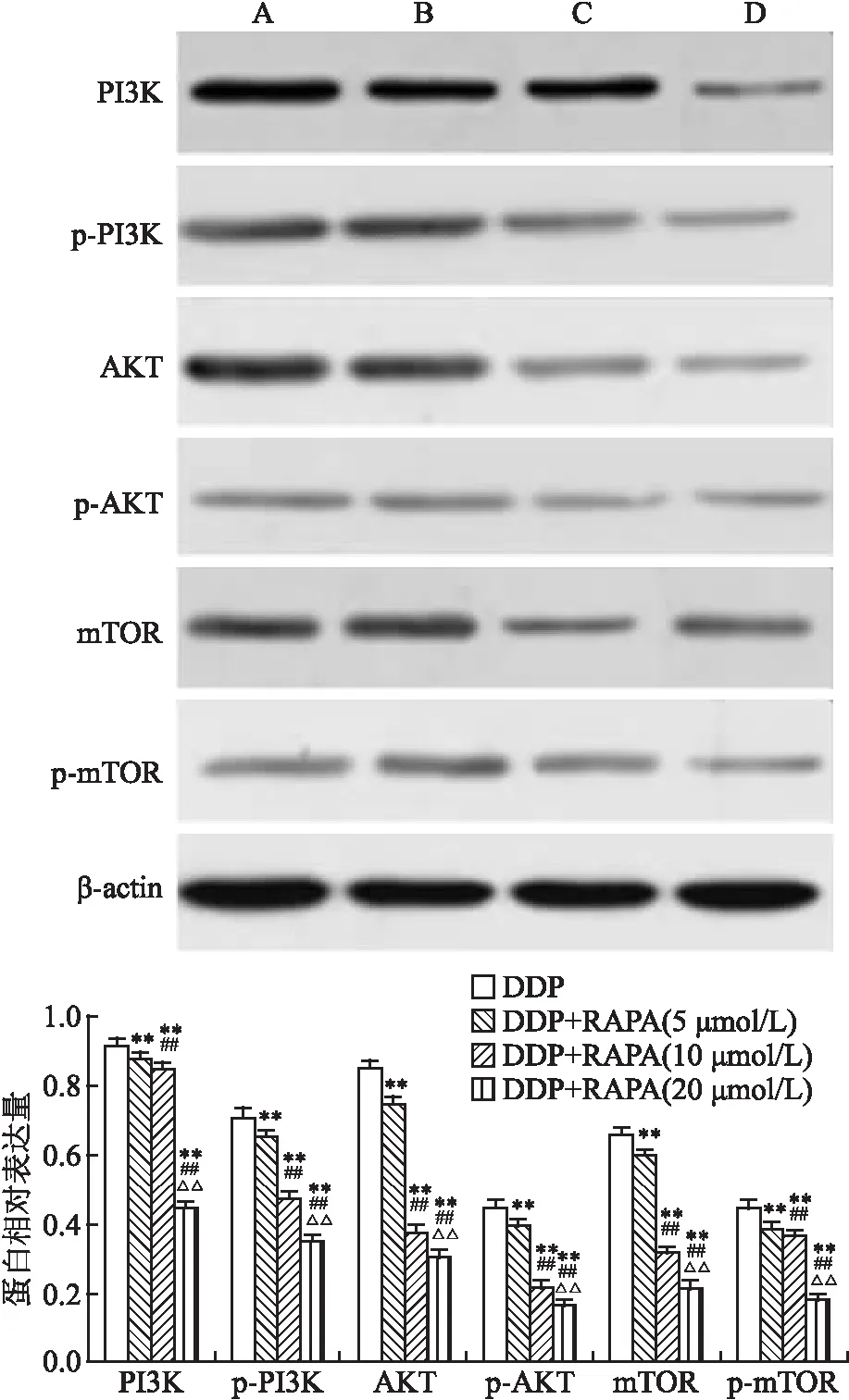
图4 RAPA对 BxPC- 3 细胞蛋白表达的影响
A:DDP组;B:DDP+RAPA (5 μmol/L);C:DDP+RAPA(10 μmol/L);D:DDP+RAPA (20 μmol/L);与DDP组比较:**P<0.01;与DDP+RAPA (5 μmol/L)组比较:##P<0.01;与DDP+RAPA(10 μmol/L)组比较:ΔΔP<0.01
mTOR信号通路主要由PI3K、AKT、mTOR等组成,影响细胞增殖、凋亡、代谢等生理活动。胰岛素样生长因子作用,激活PI3K,使磷脂酰肌醇4,5- 二磷酸(phosphatidylinositol 4,5- diphosphate,PIP2)磷酸化生成PIP3,PIP3促使AKT在细胞膜表面被脯氨酸依赖性激酶磷酸化形成p- AKT,使处于抑制状态的mTOR被激活。磷酸化的p- mTOR激活下游相关分子,促进细胞翻译、合成,调节细胞代谢等生理功能[9]。有研究[10]证实mTOR信号通路可以影响肿瘤细胞的生长代谢、促进细胞增殖、抑制细胞凋亡、增强细胞的侵袭能力。有学者从DDP 耐药肺癌细胞株A549/顺二氨基二氯铂中发现AKT1呈高表达,抑制AKT1表达可以逆转肺癌细胞对DDP 的耐药[11]。Wang et al[12]和Zhang et al[13]研究表明,CA916798基因编码的蛋白存在于mTOR信号通路的3个磷酸化位点,mTOR通路可在转录水平上调控该基因的表达,诱导DDP耐药。

图5 RAPA对SW1990细胞蛋白表达的影响
A:DDP组;B:DDP+RAPA (5 μmol/L);C:DDP+RAPA(10 μmol/L);D:DDP+RAPA (20 μmol/L);与DDP组比较:**P<0.01;与DDP+RAPA (5 μmol/L)组比较:##P<0.01;与DDP+RAPA(10 μmol/L)组比较:ΔΔP<0.01
本研究显示:PANC- 1、BxPC- 3、SW1990 3种PC细胞株均对DDP耐药,单用DDP时,3种细胞株均具有很强的细胞迁移能力和侵袭能力,IC50较高;联用RAPA后,3种细胞株的迁移能力和侵袭能力显著下降(P<0.01),这与朱方 等[14]的研究结果一致。当加入不同浓度的RAPA后,3种细胞株的生存率均明显降低,其IC50显著下降(P<0.01),这提示RAPA可以增强耐药株对DDP的敏感性。进一步的Western blot 实验检测显示:RAPA可下调PANC- 1及BxPC- 3细胞中PI3K、AKT、mTOR蛋白的表达,抑制PI3K、AKT、mTOR磷酸化,虽然对SW1990的mTOR表达的影响较弱,但仍可显著抑制相关蛋白磷酸化,表明RAPA可能是通过抑制mTOR通路逆转PC细胞株DDP 耐药机制。mTOR有mTORC1和mTORC2两种复合体,均对肿瘤细胞的增殖、分化、生长、转移等有不同的效应。蔡鹏涛 等[15]研究表明,mTORC2在耐药细胞中的表达明显高于敏感株,mTORC1在敏感细胞中的活性更高,但是在两种细胞中,mTOR信号通路均处于高度活化状态,提示mTORC1和mTORC2之间可能存在动态平衡,当上游信号发生改变时,将使mTORC1向mTORC2转化,产生耐药性,这也可能是本研究中RAPA对SW1990耐药株的mTOR蛋白抑制不明显的原因,表明可能还存在其他通路影响mTOR蛋白的表达,其对DDP 产生耐药的具体机制还值得进一步研究。
