雌激素抑制淋巴细胞IL- 1β和IL- 6释放并下调Cx40及Cx43水平
2019-09-11张莹莹于秀石单莉娅马克涛
王 璐,王 爱,杨 瑞,张莹莹,倪 欣,于秀石,单莉娅,马克涛
炎症反应是常见的一个病理过程,当机体免疫反应状态异常时,可有大量淋巴细胞浸润,造成组织和细胞损伤而导致炎症,淋巴细胞作为反映机体细胞免疫功能的重要指标在其中发挥着必不可少的作用[1]。课题组前期研究[2-3]表明,应用缝隙连接阻断剂(gap junction inhibitory peptide,Gap27)后炎症因子的释放被显著抑制,提示由连接蛋白(connexin,Cx)构成的缝隙连接通道在淋巴细胞介导的炎症反应中发挥了重要作用。有研究[4-5]表明,缝隙连接通道介导免疫细胞间的电和化学信号交流,参与细胞因子的释放以及炎症反应过程。近年研究[6-7]显示,雌激素(estrogen,E)除了可以促进和维持女性生殖器官和第二性征的发育以外,也通过调节免疫系统功能,进而抑制炎症反应。因此,该研究假设 E抑制炎症反应可能与淋巴细胞间连接蛋白的表达以及炎症因子的释放有关。
1 材料与方法
1.1 主要试剂及仪器
1.1.1试剂 ConA和E购自美国Sigma公司;APC anti- rat CD4和Per- cp anti- rat CD8a购自美国Biolegend公司;Anti- Connexin 40购自美国Santa Cruz Biotechnology公司;Anti- Connexin 43 抗体购自美国Abcam公司;Cx 40 FITC标记二抗和Cx 43 FITC标记二抗购自北京中杉金桥生物公司;KBM581培养基购自美国Corning公司;大鼠白细胞介素1β(interleukin 1β,IL- 1β)、IL- 6 ELISA检测试剂盒购自杭州联科生物技术有限公司;淋巴细胞分离液购自天津灏洋科技有限责任公司。
1.1.2仪器 CO2恒温培养箱购自上海力申科学仪器有限公司;流式细胞仪购自美国BD公司;LSM510激光共聚焦显微镜购自德国CarlZeiss公司。
1.2 实验动物实验动物选取12周龄清洁级WKY雄鼠6只,体质量150~300 g,饲养环境的室温控制在22~25 ℃、湿度50%~60%,购自北京维通利华实验动物有限责任公司,动物合格证号:SCXK(京)2012- 0001。
1.3 方法
1.3.1细胞培养与分组 大鼠称重,麻醉,采集腹主动脉血,3 500 r/min离心10 min,弃上清液,剩余血细胞根据密度梯度离心法分离淋巴细胞,于细胞间超净台无菌操作将分离的白色云雾状淋巴细胞层吸出,细胞洗涤液洗涤2次,红细胞裂解液裂解1次,1 800 r/min离心6 min,弃上清液,沉淀加入10%胎牛血清的KBM581进行培养。分为三组:空白组(Ctrl)、ConA组(10 μg/ml ConA干预48 h)和ConA+E组(1 μg/ml E预孵育24 h后加入10 μg/ml ConA共孵育48 h)。
1.3.2ELISA检测培养基中IL- 1β和IL- 6水平 取出已干预好的细胞,1 800 r/min离心6 min,取上清液,应用ELISA技术检测IL- 1β和IL- 6水平,操作步骤按照试剂盒说明书。
1.3.3流式细胞术检测淋巴细胞上Cx40和Cx43的表达水平 取出已干预好的细胞,1 800 r/min离心6 min,弃上清液,PBS重悬细胞,设置阴性对照管和同型对照管,按照说明书分别加入相应流式表面抗体APC- CD4和 percp- CD8a,充分混匀后室温避光孵育 30 min,洗涤后1 800 r/min离心6 min,弃上清液;固定破膜后分别孵育Cx40和Cx43一抗及二抗,37 ℃孵育30 min;洗涤后加入PBS重悬细胞,上机进行流式检测。
1.3.4免疫荧光技术检测淋巴细胞上Cx40和Cx43的表达及分布情况 取出已干预好的细胞,1 800 r/min离心6 min,弃上清液,PBS漂洗3次,固定,破膜,BSA 37 ℃封闭30 min,一抗于湿盒内37 ℃孵育2 h,PBS漂洗3次,二抗于湿盒内37 ℃孵育1 h,PBS漂洗3次,滴加PI,湿盒内室温避光染色20 s,PBS漂洗3次,封片。激光扫描共聚焦显微镜观察。
1.3.5Western blot检测淋巴细胞上Cx40和Cx43的蛋白表达 取出已干预好的细胞,1 800 r/min离心6 min,沉淀采用BCA法测定蛋白浓度后,取蛋白样品加入适量的上样缓冲液,置于沸水中使蛋白变性,于SDS聚丙烯酰胺凝胶进行电泳分离,电泳完毕后将凝胶上的蛋白转移至PVDF膜上,置于含5%脱脂奶粉的TBST中室温封闭2 h,分别加入Cx40、Cx43及NADPH一抗4 ℃过夜,洗膜后再加入二抗室温孵育2 h,再次洗膜后与发光试剂反应,置于X线胶片暗盒中曝光、显影。应用ImageJ2x分析软件检测并分析条带的灰度值。

2 结果
2.1 培养基中IL- 1β及IL- 6的水平ELISA检测结果显示,ConA组与Ctrl组相比,培养基中IL- 1β 和IL- 6水平明显升高,差异有统计学意义(P<0.01);ConA+E组与ConA组相比,培养基中IL- 1β和IL- 6水平明显降低,差异有统计学意义(P<0.01,P<0.05,n=6),见表1。

表1 培养基中IL- 1β及IL- 6的水平
与Ctrl组比较:**P<0.01;与ConA组比较:#P<0.05,##P<0.01
2.2 淋巴细胞上Cx40和Cx43的表达及分布差异采用FITC染料标记二抗和PI标记细胞核的双重免疫荧光来显示Cx40和Cx43在淋巴细胞上的表达和分布情况。绿色荧光代表Cx40和Cx43在淋巴细胞上的表达和分布情况,而红色荧光则对应为染色的细胞核。结果表明,Cx40主要表达在细胞质及细胞核,而Cx43主要表达在细胞膜,与Ctrl组相比,ConA组Cx40和Cx43在淋巴细胞上表达增强,差异有统计学意义(P<0.01),给予E干预后Cx40和Cx43的表达降低,差异有统计学意义(P<0.01)。见图1。
2.3 淋巴细胞上Cx40和Cx43表达水平的变化流式细胞术检测结果显示,ConA组淋巴细胞Cx40和Cx43阳性表达率高于Ctrl组大鼠,差异有统计学意义(P<0.01,P<0.05);ConA+E组淋巴细胞Cx40和Cx43阳性表达率低于ConA组大鼠,差异有统计学意义(P<0.05,n=3),见图2。
2.4 淋巴细胞上Cx40和Cx43的蛋白表达Western blot检测结果显示,ConA组淋巴细胞上Cx40蛋白表达水平高于Ctrl组,差异有统计学意义(P<0.01);ConA+E组淋巴细胞上Cx40蛋白表达水平低于ConA组,差异有统计学意义(P<0.01)。
ConA组淋巴细胞上Cx43蛋白表达水平明显高于Ctrl组,差异有统计学意义(P<0.01);ConA+E组淋巴细胞上Cx43蛋白表达水平明显低于ConA组,差异有统计学意义(P<0.01)。见图3。
3 讨论
炎症反应是机体活组织对各种致炎因素的一种正常防御反应,同时伴有大量淋巴细胞浸润,这方面变化产生的实质是机体与炎症因子进行抗争的反映[8]。炎症因子主要由免疫细胞释放,在炎症反应的发生和发展过程中起关键作用[9]。其中, IL- 1β和IL- 6能够促进淋巴细胞的增殖与分化,促进免疫炎症反应。同时,淋巴细胞在免疫反应中也发挥核心作用,其活化、增殖及炎症因子的释放等细胞行为是免疫反应的基础和关键事件[10]。另外,ConA具有强力的促有丝分裂作用,能够较好的促进淋巴细胞转化,刺激淋巴细胞分泌炎症因子[11]。本研究结果表明,通过ELISA检测炎症因子表达水平,使用ConA激活淋巴细胞后,淋巴细胞释放IL- 1β 和IL- 6增多,给予雌激素干预后,IL- 1β和IL- 6的浓度明显降低,提示体外炎症模型制备成功,并且E能够减少ConA刺激下炎症因子的分泌。

图1 淋巴细胞上Cx40和Cx43的表达及定位 ×630

图2 淋巴细胞上Cx40和Cx43的表达水平
A:淋巴细胞上Cx40阳性表达及统计结果;B:淋巴细胞上Cx43阳性表达及统计结果;与Ctrl组比较:*P<0.05,**P<0.01;与ConA组比较:#P<0.05
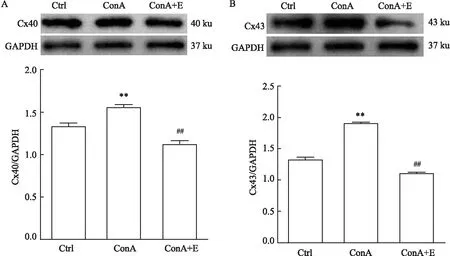
图3 淋巴细胞上Cx40和Cx43的蛋白表达
由Cx构成的缝隙连接通道作为细胞间进行物质交换和信息通讯的一种特殊膜通道结构,直接介导细胞间的电和化学信号交流,在细胞增殖分化以及机体新陈代谢中发挥重要作用。Vliagoftis et al[5]发现Cx43在外周血嗜酸性粒细胞上表达,不仅定位于细胞质内,而且存在于质膜上。本研究结果证实了淋巴细胞上表达有Cx40和Cx43,且Cx40主要表达在细胞质及细胞核,而Cx43主要表达在细胞膜。此外,研究[12]显示由Cx40和Cx43构成的缝隙连接通道参与免疫系统细胞间细胞通讯及免疫炎症应答。当免疫细胞受到炎症因子的刺激时,淋巴细胞上Cx40和Cx43表达可显著上调。本研究结果中也表明由ConA激活的淋巴细胞上Cx40和Cx43的表达升高,提示Cx40和Cx43可能参与了炎症反应。近年来研究[13]显示,E可以抑制炎症反应,对多种脏器具有一定的保护作用。已有研究[14]表明,E对多种组织细胞中Cx43的表达、分布、空间构象及功能状态等具有调节作用,且具有调节缝隙连接的功能。本研究结果显示,在ConA刺激下淋巴细胞上Cx40和Cx43的表达上调,给予E干预后,淋巴细胞上Cx40和Cx43的表达下降,提示E的抗炎作用可能与下调淋巴细胞上的连接蛋白有关,但它是如何通过下调淋巴细胞上Cx40和Cx43从而发挥抗炎作用的机制仍不十分清楚,后续需要进一步探讨。
综上所述,本研究结果证实淋巴细胞上Cx40和Cx43的表达在ConA刺激下显著上调,炎症因子水平升高,给予E进行干预后,Cx40和Cx43的表达下降,炎症因子水平降低,表明E能够抑制促炎因子IL- 1β 和IL- 6的释放,同时下调淋巴细胞上Cx40和Cx43的表达,从而改善炎症反应。这一研究对了解Cx参与淋巴细胞炎症反应具有一定的意义,也为阐明E的抗炎机制及其临床治疗提供更多依据。
