基于Cyt b基因的PCR技术对牛鞭药材的鉴定方法研究
2019-09-10徐岩段思琪翟英南李明成高丽君孙丽媛
徐岩 段思琪 翟英南 李明成 高丽君 孙丽媛



摘 要 目的:建立对牛鞭药材的聚合酶链式反应(PCR)鉴定方法,从分子水平上对牛鞭药材的真伪进行鉴定。方法:提取牛鞭及其伪品(驴鞭、猪鞭、羊鞭)的基因组DNA,并对其完整性、纯度和浓度进行检测。利用GenBank相关信息,以牛鞭的线粒体细胞色素b基因(Cyt b)为靶基因,应用Primer-BLAST在线软件设计特异性引物,并对不同物种鞭类样品进行PCR扩增,对产物进行电泳分析;对获得的牛鞭样本PCR产物进行克隆和DNA测序验证。对所建立的PCR鉴定方法进行特异性和重复性考察验证。结果:提取所得的牛鞭及其伪品DNA的纯度较高,无蛋白质或RNA污染;1.5%琼脂糖凝胶电泳结果显示,牛鞭样本在200~300 bp之间均出现明显的目的基因条带,而其他伪品未见相应条带出现。DNA测序结果证实,所获牛鞭样本基因片段的核苷酸序列与GeneBank中牛鞭物种相似性均为100%。方法学验证结果显示所建方法特异性、重复性均良好。结论:本研究所建基于Cyt b基因的PCR鉴定方法简单、快速,准确性、特异性、重复性均良好,可满足牛鞭及其伪品的分析鉴定需求。
关键词 牛鞭;鉴定;Cyt b基因;PCR;DNA指纹
ABSTRACT OBJECTIVE: To establish the method for PCR identification of bullwhip, and to identify the authenticity of bullwhip at the molecular level. METHODS: DNA samples of bullwhip and its counterfeits (donkey whip, pig whip, sheep whip) were extracted and their integrity, purity and concentration were detected. Using GenBank related information, using mitochondrial cytochrome b (Cyt b) gene of bullwhip as target gene, Primer-BLAST online software was used to design specific primer. PCR amplification was performed for whips of different species, and electrophoretic analysis was conducted for the product. PCR products of bullwhip samples were cloned and confirmed by DNA sequencing. The specificity and repeatability of the established PCR method were verified. RESULTS: DNA purity of the bullwhip and its counterfeits was high, and there was no protein or RNA pollution. 1.5% agarose gel electrophoresis showed that there were obvious target gene bands of bullwhip samples at 200-300 bp, while no corresponding bands appeared in other counterfeit products. The results of DNA sequencing showed that the nucleotide sequence of the gene fragment of bullwhip was 100% similar to that of the bullwhip in GeneBank. Results of methodological validation showed that established method was specific and reproducible. CONCLUSIONS: The established PCR identification method based on Cyt b gene in the study is simple, rapid, accurate, specific and reproducible, and can meet the requirements of analysis and identification of bullwhip and its counterfeits.
KEYWORDS Bullwhip; Identification; Cyt b gene; PCR; DNA fingerprint
自古以来,牛鞭因其明确的“以形补形”药效,已成为中医临床上备受关注的常用药物,《本草纲目》也曾记载牛鞭主治男性阳痿、早泄,有补肾壮阳、固本培元的功效。牛鞭富含雄激素、蛋白质、脂肪等成分,不仅可作为广大男性补肾壮阳的补药,也可作为女性滋阴补阳、美容抗衰的佳品[1]。近年来,市面上以鞭类药材为主药的复方滋补方药日渐增多,如至宝三鞭丸、海狗丸、三肾丸等;而以鞭类药材为主药的药粥、药膳、药酒等也日益盛行[2]。但由于鞭类药材货源紧俏、种类繁多、价格昂贵且加工程序复杂,加之对此类药材进行真伪鉴别及质量评定过程中所采用的检验方法可靠性不足,致使市場上各种伪劣产品层出不穷。
由于牛鞭成分复杂,目前暂未明确其功效成分,加之目前我国中药现行质量标准中检验方法的局限性,故很难对牛鞭及其伪品作出准确判断,也无可供参考的法定质量标准对其质量进行评价和控制。目前,对鞭类药材的品种及真伪的鉴定主要是依靠检验者主观判断其性状、显微鉴定其残留毛干及肌肉组织或是化学分析其特征图谱等鉴别方法,而利用聚合酶链式反应(PCR)等基因技术对鞭类药材的系统鉴定研究尚不多见。基于此,本研究拟采用PCR技术对牛鞭及驴鞭、猪鞭、羊鞭等伪品进行系统鉴定及分析,以期找出其特异性DNA指纹特征[3],为该药材的质量控制提供科学依据的同时,也为该品种的开发利用提供可靠的技术支持。
1 材料
1.1 仪器
GL-20G-Ⅱ型变速冷冻离心机(上海安亭科学仪器厂);核酸蛋白分析仪(岛津国际贸易上海有限公司);9700型PCR扩增仪(美国ABI公司);JY-600C型双稳定时电泳仪(北京市君意东方电泳设备有限公司);UVWHITE-2020D型紫外凝胶成像自动分析仪(美国Cold Spring公司);JD100-3B型电子天平(沈阳龙腾电子有限公司);OSE-Y50型第三代变速组织研磨器(北京天根生化科技有限公司);MX-S型可调式漩涡混合仪(美国Scilogex公司)。
1.2 试剂
血液/细胞/组织基因组DNA提取试剂盒(货号:S7315)、琼脂糖凝胶DNA回收试剂盒(货号:R6628)、T载体连接试剂盒(货号:S7508)、质粒小提试剂盒(货号:S7605)、2×Taq PCR Master Mix、 λHindⅢMarker、100bp Ladder Marker等购自北京天根生化科技有限公司;琼脂糖粉购自西班牙Agrose公司;感受态细胞购自北京鼎国昌盛生物技术有限责任公司;其他化学试剂均为国产分析纯,购自吉林市华强试剂公司;实验用水等级为三级。
1.3 牛鞭药材及其伪品
牛鞭样品分别来自延边、科尔沁、吉兴、长春、珲春等5个地区,批次编号为:延边黄牛鞭1、延边黄牛鞭2,科尔沁牛鞭1、科尔沁牛鞭2,吉兴牛鞭1、吉兴牛鞭2,长春牛鞭1、长春牛鞭2,珲春牛鞭1、珲春牛鞭2。伪品样品(驴鞭、猪鞭、羊鞭)均为吉林市市区农產品市场市售产品,批次编号为:驴鞭1、驴鞭2,猪鞭1、猪鞭2,羊鞭1、羊鞭2。每种鞭类样品均采集了2个批次,每批次均采集3份样本。所有样品经吉林市药检所金英兰副主任药师鉴别,分别为牛鞭药材及驴鞭、猪鞭、羊鞭等伪品。
2 方法
2.1 样品DNA提取
采用血液/细胞/组织基因组DNA提取试剂盒提取样本DNA。分别称取新鲜或解冻后的牛鞭、驴鞭、猪鞭、羊鞭样本约0.05 g,置于无菌的1.5 mL EP管中,加入无菌生理盐水浸泡、冲洗,弃去血水,剪碎组织;加入无菌生理盐水150 µL,于室温下研磨至肉糜状,以10 000 r/min离心1 min,弃去上清;加入GA缓冲液 400 µL,置于涡旋振荡器上充分混匀;加入蛋白酶K溶液40 µL,于56 ℃水浴1 h;加入GB缓冲液400 µL,充分颠倒混匀后,于70 ℃水浴10 min;短暂离心,然后加入无水乙醇400 µL,充分混匀15 s后,再次短暂离心去除管盖内壁上的水珠。将得到的溶液和絮状沉淀均加入CB3吸附柱,转移至收集管中,以12 000 r/min离心30 s;弃去收集管中的废液,再以12 000 r/min离心2 min;弃去收集管,打开CB 3吸附柱,置于滤纸上晾干数分钟后,转入一个干净的离心管中;加入TE洗脱缓冲液100 μL溶解DNA,轻轻混匀,作为供试品DNA储存液,于-20 ℃保存,备测。
2.2 样品基因组DNA提取片段完整性检测
取“2.1”项下获得的样品DNA储存液5 μL(牛鞭、驴鞭、猪鞭、羊鞭每种鞭类随机抽选一个样品),与6×Loa- ding buffer溶液1 μL混匀后,点样于0.8%琼脂糖凝胶(含GelRed显色剂),按2015年版《中国药典》(四部)通则 0541第三法[4]进行电泳分析。采用凝胶成像分析系统观察是否出现条带,以判断是否提取出完整的DNA片段。
2.3 样品DNA提取片段的纯度和浓度检测
取“2.1”项下获得的所有批次样品的DNA储存液各1 μL,采用核酸蛋白分析仪测定DNA的纯度及浓度。以260 nm/280 nm波长下的光密度比值(OD260/280)反映DNA纯度,当OD260/280在1.8~2.1范围内,则表明所获DNA无蛋白质或RNA污染。根据浓度测定结果,采用水将DNA储存液稀释至100 ng/μL,-20 ℃保存,用于后续试验,以避免DNA浓度过大造成条带下沉,影响试验准确性。
2.4 引物设计与合成
在美国国立生物技术信息中心(NCBI)官方网站(https://www.ncbi.nlm.nih.gov/)中的GenBank数据库中下载牛鞭的基因序列(编号:HQ184045.1),以牛鞭的线粒体细胞色素b基因(Cyt b)为靶基因,应用NCBI Primer-BLAST在线软件设计特异性引物。其上游引物为:5′-CATCAAACATCTCATCTTGATG-3′;下游引物为:5′-AGTGTAAGACCCGTAATATAAG-3′。将设计好的引物序列交由深圳华大基因科技服务有限公司合成。
2.5 不同物种鞭类样本DNA的PCR扩增及产物电泳分析
取“2.2”项下样本DNA稀释液为模板(牛鞭、驴鞭、猪鞭、羊鞭每种鞭类随机抽选一个样品),以无菌双蒸水作为阴性对照,进行PCR扩增。PCR反应体系(总体积为20 μL)包括:2×Taq PCR Master Mix 10 μL,上、下游引物(10 μmol/μL)各0.5 μL,模板DNA 1 μL,无菌双蒸水8 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s、58 ℃退火30 s、72 ℃延伸30 s,30个循环;72 ℃延伸10 min。所得产物于4 ℃保存。
取PCR产物5 μL,点样于1.5%琼脂糖凝胶(含GelRed显色剂),按2015年版《中国药典》(四部)通则 0541第三法[4]进行电泳分析。采用紫外凝胶成像自动分析仪观察PCR产物条带的位置及明暗程度,并拍照记录。
2.6 牛鞭样本的DNA测序验证
将“2.5”项下获得的牛鞭样本PCR产物转入质粒进行克隆。具体步骤:将样品PCR扩增产物进行1.5%琼脂糖凝胶电泳后,切下目的条带;采用琼脂糖凝胶DNA回收试剂盒对PCR产物进行纯化与收集;使用T载体连接试剂盒将已经纯化的PCR产物与T载体连接,金属浴过夜;利用冷热交替使DH5α感受态细胞胞吞上述T载体连接产物,培养一定时间;经蓝白斑筛选后选择合适菌落在液体培养基中扩增;使用质粒小提试剂盒将菌液中的质粒进行提取。克隆完成后,将含有目的片段的质粒转交上海生工生物工程有限公司进行测序,将测序结果以NCBI Nucleotide-BLAST在线软件进行比对,进行DNA物种鉴定。
2.7 方法学验证
2.7.1 特异性试验 在所有鞭类样品中,每批次随机抽取一份DNA稀释液为模板,以无菌双蒸水作为阴性对照,按“2.5”项下方法进行PCR扩增及1.5%琼脂糖凝胶电泳分析。
2.7.2 重复性试验 在同一实验室内,由同一实验人员在相同条件下按“2.7.1”项下方法重复进行2次试验。
3 结果
3.1 样品基因组DNA提取片段完整性
0.8%琼脂糖凝胶电泳结果显示,所提取的牛鞭及其伪品样品基因组DNA均在相应泳道内出现明显条带,表明已成功提取样品基因组DNA,詳见图1。
3.2 样品DNA的纯度和浓度
结果显示,每批次牛鞭及其伪品提取所得DNA的OD260/280均在1.8~2.0范围内,表明均未被蛋白或RNA污染。其纯度和浓度检测结果详见表1。
3.3 样品DNA的PCR产物电泳结果
1.5%琼脂糖凝胶电泳结果显示,牛鞭样本在200~300 bp之间均出现明显条带,几种伪品未见条带,表明该方法能够将牛鞭样本及其伪品进行区分。PCR产物电泳图详见图2。
3.4 牛鞭样本DNA测序结果
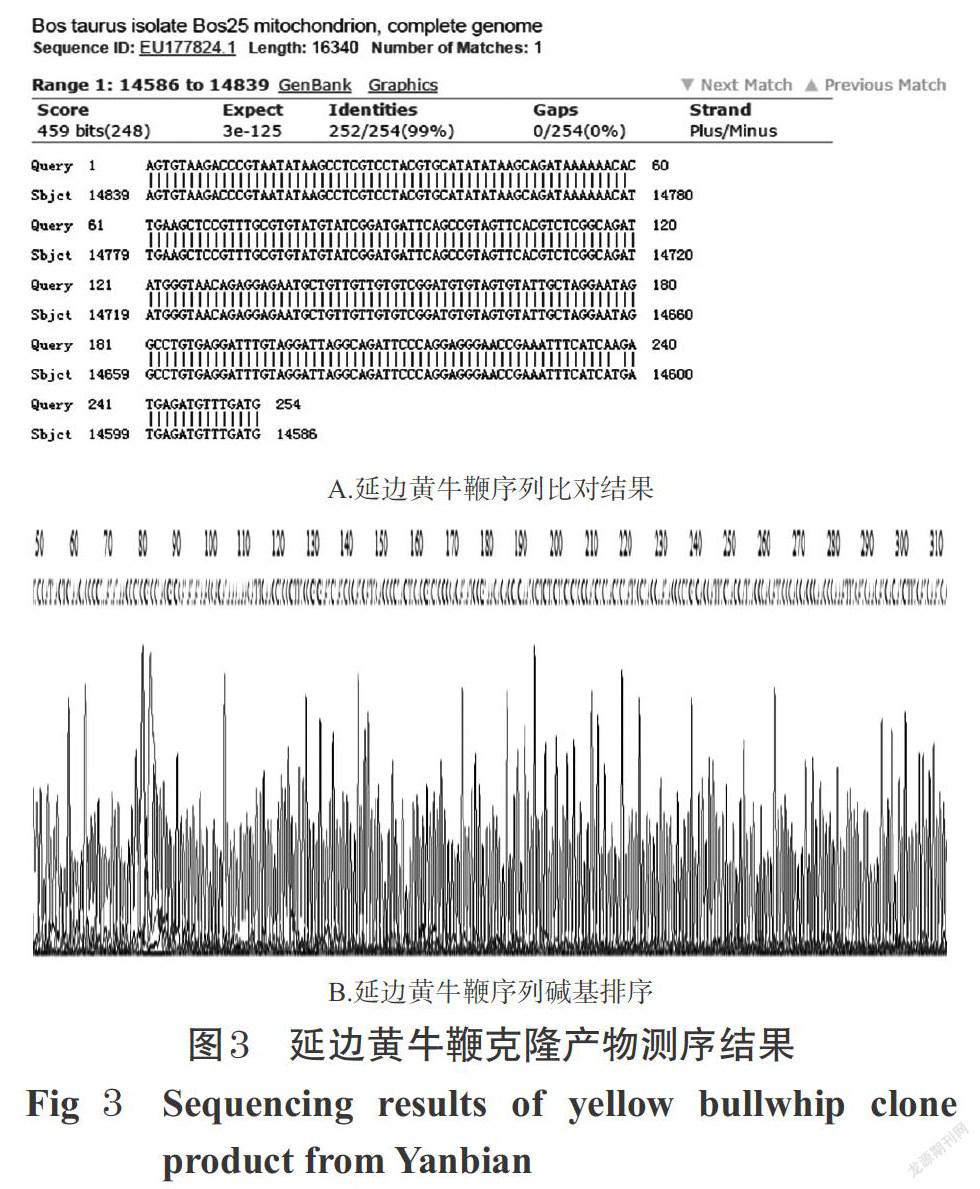
测序结果经NCBI Nucleotide-BLAST软件比对后显示,牛鞭样品所得目的片段的核苷酸序列与GeneBank中已登记的牛鞭物种相似性均为100%,证明克隆所得DNA片段即为牛鞭目的基因片段。以延边黄牛鞭为例,其测序结果详见图3。
3.5 方法学验证结果
3.5.1 特异性考察结果 1.5%琼脂糖凝胶电泳结果显示,仅牛鞭DNA模板扩增产物在200~300 bp出现了1条目的片段条带,而驴鞭、猪鞭、羊鞭等伪品样本DNA电泳结果均为阴性,未见产物条带,详见图4。这表明本方法特异性良好,能准确区分牛鞭及其伪品。
3.5.2 重复性考察结果 2次重复试验结果均显示,牛鞭样本DNA模板在200~300 bp之间出现了1条目的片段,其余伪品(驴鞭、猪鞭、羊鞭)样本DNA模板扩增产物电泳结果均为阴性,详见图5。2次检测结果中,样本DNA出现带的位置均一致,仅条带明暗程度略有不同,可能与样本浓度有关。这表明本方法重复性良好,在相同条件下,试验结果稳定可靠。
4 讨论
迄今为止,我国中药材鉴定一直采用基源鉴定、性状鉴定[5]、显微鉴定[6]及理化鉴定[7]等四大传统鉴定方法,以上方法在生物学的鉴定标识上都属于物种表型鉴定。由于上述方法容易受到药材所处自然环境、生长阶段、采收加工等相关因素影响,因此存在变异性大和伪造品不易鉴定等缺点[8]。例如,传统的方法是依据鉴定者的经验通过正伪品整体长度、色泽、横环纹等性状差异进行鉴别,虽然操作简单、容易操作,但主观性较强,其准确度往往取决于鉴定者的经验[9];显微鉴定法是借助残留毛干直径、髓干比例、平滑肌纤维直径、横纹肌纤维直径等量化特征进行分辨,过程虽精密但效率较低[10];红外光谱法能够保持样本的完整性,可以定性检测样品,显示特征性峰,但对实验人员技术要求高;聚丙烯酰胺凝胶电泳利用蛋白迁移率的不同,能直观显示出特异谱带的数量和位置,但操作复杂、用时较久;高效液相色谱法虽然检测灵敏度较高,但同时其分析成本和仪器的日常维护费用较高[11]。尽管现在已经通过多角度、多层面鉴定方法对鞭类药材进行分析,建立了相对较为客观的品质评价体系,但以上检测方法并未从遗传位点上区分出鞭类药材,使得至今未能研发出稳定性和有效性较高的用于区分牛鞭及其伪品的特异性DNA分子标记方法。
本研究应用具有高度种质特异性的PCR鉴定技术,在分子水平上利用生物体内遗传信息载体检测被鉴定对象的遗传标记特征,在进行中药鉴定时比传统中药鉴定方法更科学、客观和准确。位于线粒体内膜磷脂分子双层中的Cyt b基因,长度适中,结构简单,进化速度适宜,是阐明物种差异、遗传多样性较为合适的DNA片段[12]。PCR分子鉴定技术是对各种药材,尤其是中药易混品种,通过基因序列分析寻找其保守且特异的指纹区段,设计特异性引物进行PCR扩增,从分子水平上对中药材进行鉴定及分析的基因技术手段[13-14],可为药材正本清源提供科学准确的判定依据,同时也是牛鞭等中药材鉴定的发展趋势。
本研究将不同批次购买的牛鞭及其伪品(驴鞭、猪鞭、羊鞭)样本进行DNA提取;同时,在GenBank中查找鞭类Cyt b基因的相关信息,根据牛鞭与其他鞭类基因序列的差异,确定牛鞭的特异片段并以该片段为基础设计特异性引物,确保选择性地扩增相应的牛鞭DNA条带。经优化PCR反应体系和条件,确定退火温度为58 ℃,扩增的目的条带约为256 bp。PCR产物的凝胶电泳分析结果显示,含牛鞭成分的样本均出现目的基因条带,而伪品即其他种属鞭类样品均未见相应条带,表明所设计的PCR引物特异性强,能有效区分牛鞭和其他伪品。使用DNA测序技术将牛鞭及其伪品的PCR产物转入T克隆载体进行克隆测序,并在NCBI Nucleotide-BLAST软件中比对结果,可确证牛鞭的种属,也进一步证实了该鉴定方法的特异性较强。经方法学考察表明,该PCR鉴定方法特异性和重复性均较好。
综上所述,本研究根据牛鞭DNA指纹的特征,建立了基于牛鞭药材Cyt b基因的PCR鉴定方法,该方法简单、快速,准确性、特异性、重复性均良好,可满足牛鞭及其伪品的分析鉴定需求,可作为鉴别鞭类制品物种起源的有效手段。
参考文献
[ 1 ] 代婷婷,高晓晨,吴海燕,等.鞭类药材的化学成分和生物活性研究进展[J].中国现代中药,2014,16(12):1039- 1042.
[ 2 ] 刘德和,衣瑞彬.鞭药的历史沿革和发展[J].山东医药工业,2002,21(2):27-29.
[ 3 ] 周亭亭,李明成.基于DNA指纹鉴定技术的市售川贝母质量考察分析[J].北华大学学报(自然科学版),2017,18(6):743-746.
[ 4 ] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:67-68.
[ 5 ] 林大勇,李斌,曲道炜.几种常用动物药的真伪性状鉴别[J].国医论坛,2010,25(6):18-19.
[ 6 ] 王珺,张南平.中药显微鉴别研究与应用进展[J].中国药事,2018,32(8):1051-1057.
[ 7 ] 王远志.鞭类药材的鉴定研究[D].沈阳:辽宁中医学院,2004.
[ 8 ] 黄琼林,马新业,何瑞,等.基于条形码ITS2序列的青天葵及其混伪品分子鉴别[J].生物技术通报,2012(12):173-179.
[ 9 ] 于慧,汪涛,张辉,等.鹿鞭及鞭类药材研究[J].吉林中医药,2019,39(7):921-924.
[10] 王远志,李锋,康廷国.鞭类药材电泳及显微鉴定研究[J].中药研究与信息,2004,6(2):34-37.
[11] 孙绩岩,苑广信,李洪宇,等.鹿茸毛细管电泳DNA指纹图谱研究[J].中国药学杂志,2014,49(15):1300-1305.
[12] 于文静,周亭亭,张丽华,等.蕲蛇DNA检测试剂盒的评价及应用[J].中国药学杂志,2014,49(11):999-1003.
[13] 刘兴朵.中药材鉴定新技术新方法研究分析[J].中国民康医学,2019,31(9):101-102.
[14] 陈康,蒋超,袁媛,等.快速PCR方法在蛇类药材真伪鉴别中的应用[J].中国中药杂志,2014,39(19):3673-3677.
(收稿日期:2019-07-03 修回日期:2019-10-30)
(编辑:段思怡)
