补肾填髓方对阿尔茨海默病模型大鼠学习记忆 能力及线粒体氧化应激的影响
2019-09-10曹玉成王哲宋炜熙
曹玉成 王哲 宋炜熙



〔摘要〕 目的 觀察补肾填髓方对阿尔茨海默病(Alzheimer’s disease, AD)模型大鼠学习记忆能力及线粒体氧化应激的影响。方法 50只大鼠先用Y迷宫初筛,再按旷场实验得分随机分成正常组、模型组、假手术组、中药组、西药组。假手术组两侧侧脑室注射β淀粉样蛋白(Aβ)42~1,余下除正常组外均以双侧侧脑室注射(Aβ)1-42复制AD模型。造模后中药组灌服补肾填髓方,西药组灌服多奈哌齐,其他组灌服等容量生理盐水,连续干预28 d。Morris水迷宫检测大鼠学习记忆能力,酶联免疫吸附方法(ELISA)检测大鼠脑皮质及血清超氧化物歧化酶(superoxide dismufase, SOD)活性,硫代巴比妥酸法(TBA)检测大鼠脑皮质及血清丙二醛(malondialdehyde, MDA)活性,透射电镜观测海马线粒体超微结构。结果 与模型组比较,中药组和西药组大鼠水迷宫逃避潜伏期缩短,在原平台象限游泳时间及距离的百分比增加,差异均有显著统计学意义(P<0.05或P<0.01)。与模型组比较,中药组SOD活性升高,MAD活性减低(P<0.05,P<0.01);西药组的SOD活性升高,MDA活性降低(P<0.01);中药组及西药组的海马线粒体超微结构病理损害改善。结论 补肾填髓方可以改善AD大鼠的学习记忆能力,其机制可能与改善线粒体氧化应激有关。
〔关键词〕 阿尔茨海默病;补肾填髓方;氧化应激;线粒体
〔中图分类号〕R285.5;R745.1 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.04.006
Effects of Bushen Tiansui Fang on Learning and Memory Abilities and Oxidative Stress of Mitochondria of Alzheimer's Disease Model Rat
CAO Yucheng1, WANG Zhe2, SONG Weixi3*
(1. Qiyang Hospital of Traditional Chinese Medicine, Yongzhou, Hunan 426100, China; 2. The Second Xiangya Hospital of Central South University, Changsha, Hunan 410013, China; 3. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To observe the effects of Bushen Tiansui Fang on learning and memory abilities and oxidative stress of mitochondria of Alzheimer's disease (AD) model rats. Methods A total of 50 rats were initially screened by Y maze, and then divided into the normal group, the model group, the sham operation group, the Chinese medicine group, the Western medicine group randomly according to the score of open filed test. Aβ1-42 (amyloid β-protein) were injected into bilateral ventricle of rats to duplicate AD model, and Aβ42-1 were injected into the sham operation group rats as the same dose. After modeling, the Chinese medicine group and the Western medicine group were administered by gavage once a day for 4 weeks with Bushen Tiansui Fang and Donepezil respectively. At the same time, the remaining groups were given by gavage with the same capacity amount of normal saline, for continuous 28 days' intervention. The abilities of learning and memory were assessed with Morris water maze. The activity of superoxide dismutase (SOD) in prefrontal cortex and serum of rats was detected by enzyme linked immunosorbent assay (ELISA). The activity of malondialdehyde (MDA) in prefrontal cortex and serum of rats was detected by thiobarbituric acid (TBA) method. The ultrastructures of hippocampal mitochondria were observed with transmission electron microscopy. Results Compared with the model group, the escape latent period shortened in the Chinese medicine group and the Western medicine group, while the percentage of swimming time and swimming distance in the original platform quadrant increased (P<0.01). Compared with the model group, the SOD activity increased and MAD activity decreased in Chinese medicine group (P<0.05; P<0.01); the SOD activity increased and MDA activity decreased in the Western medicine group (P<0.01); the mitochondrial ultrastructure pathological changes in the Chinese medicine group and the Western medicine group were ameliorated. Conclusion The learning and memory abilities of AD rats can be improved by Bushen Tiansui Fang, and its mechanism may be related to the improvement of mitochondrial oxidative stress.
〔Keywords〕 Alzheimer's disease; Bushen Tiansui Fang; oxidative stress; mitochondria
阿尔茨海默病(Alzheimer’s disease, AD)是与年龄相关的中枢神经系统退行性疾病,以进行性记忆下降及认知损伤为特点[1]。由于人口老龄化,目前世界范围内AD患病人数已经达到4 400万[2],给社会带来沉重负担。AD的病因和发病机制复杂且并不完全清楚,现在的治疗药物不能完全满足临床需要,并且费用昂贵,还存在肝毒性、腹泻、恶心呕吐、头晕等不良反应[3]。因此,研究疗效更确切、副作用更少的AD治疗药物非常紧迫。近年来,大量文献研究报道,AD与氧化应激联系紧密,改善氧化应激可以明显改善AD[4-6]。补肾填髓方是根据中医学理论“肾虚髓亏”,基于经典方剂孔圣枕中丹(《千金方》)化裁而成,相关研究证实补肾填髓方药能有效延缓痴呆早期患者大脑结构的萎缩,改善其认知及记忆功能[7],但其作用机制并不十分明确。本研究拟以AD模型大鼠为实验对象,从线粒体的氧化应激角度,探讨补肾填髓方抗AD的作用机制。
1 材料与仪器
1.1 实验动物
90只健康雄性清洁级SD大鼠,体质量(180±20)g,购自斯莱克景达实验动物有限公司,许可证号:SYXK(湘)2010-0013;实验动物来源证号:430047000,饲养于湖南省人民医院动物实验室。所有动物饲养在室温22~25 ℃、湿度40%~60%条件下,以普通饲料喂养,自由进食饮水。将大鼠观察性饲养1周后进行Y迷宫实验初筛。
1.2 实验药物、试剂及仪器设备
补肾填髓方由石菖蒲10 g,远志10 g,何首乌15 g,淫羊藿15 g,龟板20 g,龙骨20 g组成。盐酸多奈哌齐片,卫材药业有限公司,批号:1611013。Aβ1-42,Sigma公司,批号:A4559。Aβ42-1,Sigma公司,批号:A2201(以无菌双蒸水将Aβ1-42及Aβ42-1配制成浓度为2 μg/μL, 置于37 ℃恒温箱孵育7 d,保存于4 °C冰箱备用)。丙二醛(malondialdehyde,MDA)试剂盒,南京建成,批号:A003-1。超氧化物歧化酶(superoxide dismufase, SOD)试剂盒,武汉华美,批号:P03037347。大鼠脑立体定位仪,美国KOPF(Model-900)。Morris水迷宫,上海欣软(XR-XM101)。Y迷宫,上海软隆(BW-MYM103)。透射式电子显微镜,美国FEI公司(Tecnai G2 Spirit)。
2 方法
2.1 AD大鼠模型的复制及干预
根据参考文献[8]行Y型迷宫初筛,剔除先天愚钝的大鼠,随后依据旷场实验水平运动得分将大鼠分为正常组、假手术组、模型组、西药组、中药组,每组10只。参照Xi等[9]方法,复制AD模型。除正常组外,各组大鼠以10%水合氯醛(350 mg/kg)腹腔注射麻醉后俯卧固定于脑立体定位仪,常规备皮消毒,头顶正中切开皮肤,找到大鼠前囟,结合《大鼠脑立体定向仪图谱》[10]及预实验结果,在大鼠两侧侧脑室(位置:前囟后1 mm,矢状缝向左、右侧旁开1.5 mm,深4.6 mm)用针头钻开颅骨,假手术组两侧侧脑室注入Aβ42-1 5 ?滋L,其余实验组缓慢注入Aβ1~42 5 ?滋L。注入时间均为5 min,留针时间5 min,注射完毕后缝合皮肤,局部红霉素外涂防感染。
正常组不灌胃,其他组造模后隔天开始灌胃。根据人与大鼠换算系数0.018,以大鼠体质量200 g,成人体质量60 kg为参考,西药组按0.33 mg/(kg·d)、中药组按生药量8.1 g/(kg·d)的剂量灌胃,给予药液8 mL/(kg·d)。模型组和假手术组灌服等容量生理盐水,连续给药4周。
造模成功标准[8]:造模结束后第15天,对大鼠再次进行Y型迷宫筛选,如15次测试中正确次数比造模前下降1/3者为造模成功。共剔除死亡大鼠5只,造模失败3只,将存活的成功模型纳入下一步实验,其中假手术组8只,模型组7只,中药组9只,西药组8只,正常组10只,成模率80%,并遵循随机原则补齐每组动物为10只。
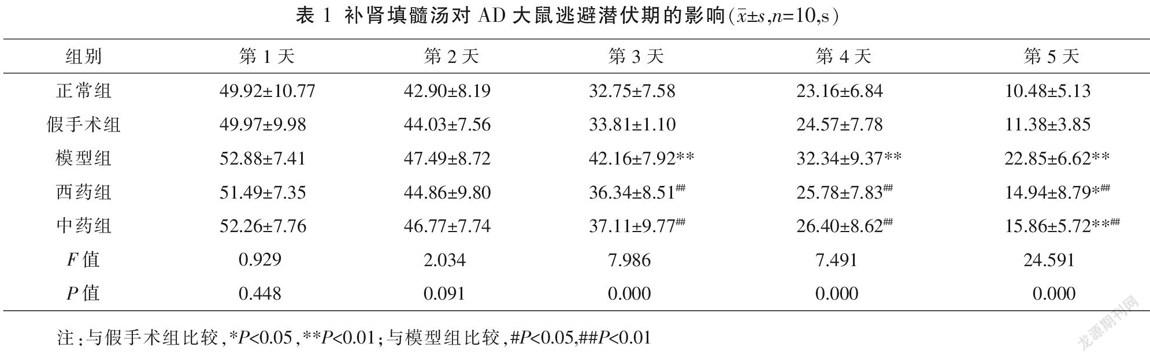
2.2 Morris水迷宫测试大鼠学习记忆能力
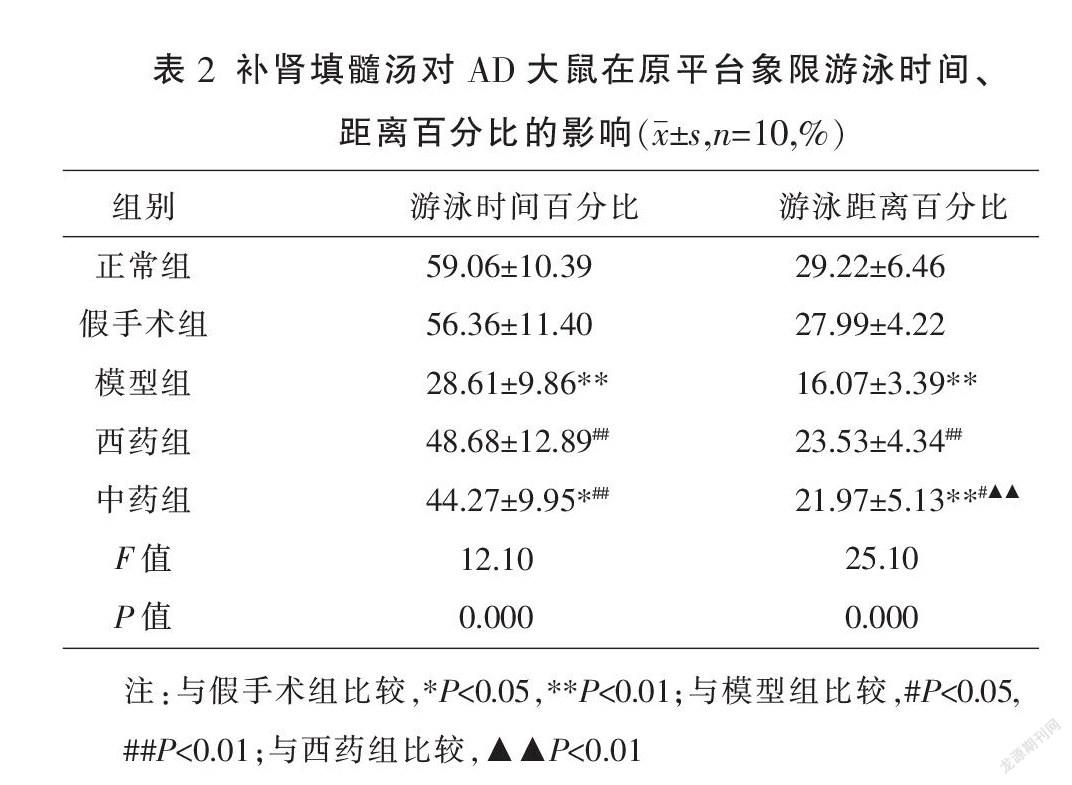
在各组大鼠28 d干预完成后,每天下午14:30左右开始定位航行训练,连续5 d。每天将大鼠面向池壁分别从4个平均分布的标记点轻轻放入水中,记录1 min内其找到水下平台所花费的时间(逃避潜伏期,escape latency)。第6天移除隐藏的平台,从定位航行实验的第1个入水点将大鼠放入水池,记录1 min内大鼠经过虚拟平台的总次数,原平台象限的活动时间与距离占总游泳时间及总游程的百分比[11]。
2.3 ELISA、TBA法分别测定前额皮质组织匀浆及血清中SOD、MDA活性
水迷宮测试结束后,大鼠用10%水合氯醛(350 mg/kg)麻醉,腹主动脉采血后,断头取脑,碎冰上迅速分离出大鼠前额皮质,预冷的生理盐水洗净血渍,吸干水分后称质量,制备成10%组织匀浆液,分别低温离心机3 500 r/min离心匀浆液及血液15 min,取上清,按照SOD、MDA试剂盒说明书操作测定。
2.4 电镜观察
大鼠麻醉处死后断头取脑,碎冰上分离大鼠海马,用2.5%戊二醛固定2 h以上,0.1 mmol/L磷酸缓冲液清洗3次;1%锇酸固定1~2 h,0.1 mmol/L磷酸缓冲液漂洗3次;常规50%、70%、90%、100%丙酮脱水,经过浸泡、包埋、固化后超薄切片机切片,柠檬酸铅和醋酸铀双染,透射电镜下放大20 000倍观察并拍照记录。
2.5 统计方法
用SPSS l7.0软件进行统计分析,实验数据均用“x±s”表示,水迷宫逃避潜伏期采用重复测量方差分析[12],其余各组间比较使用单因素方差分析,组间两两比较使用LSD检验,P<0.05表示差异有统计学意义。
3 结果
3.1 水迷宫定位航行试验
随着训练时间的延长,各组大鼠逃避潜伏期逐渐缩短。与假手术组比较,模型组第3天开始出现逃避潜伏期延长(P<0.01);与模型组比较,中药组、西药组逃避潜伏期第3天开始缩短(P<0.01)。与西药组相比,中药组逃避潜伏期稍有延长,但差异无统计学意义(P>0.05)。见图1、表1。
3.2 水迷宫空间探索试验
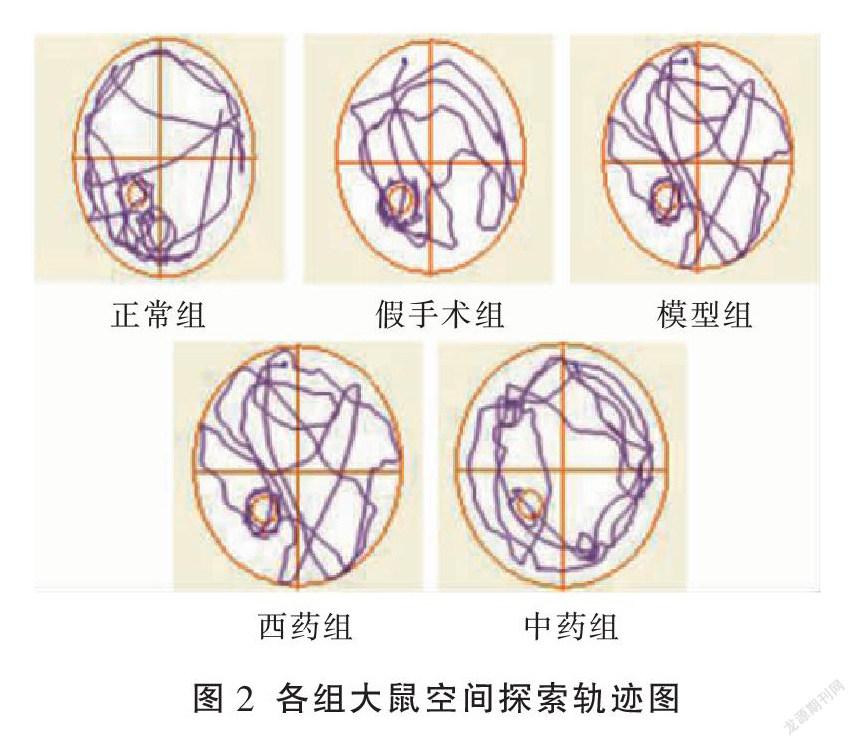
与假手术组相比,模型组大鼠原平台象限游泳时间百分比及游泳距离百分降低,差异有统计学意义(P<0.01);与模型组相比,中药组、西药组游泳时间及游泳距离的百分比升高(P<0.05或P<0.01);与西药组相比,中药组原平台象限游泳时间所占百分比稍有降低,但两者差异无统计学意义(P>0.05),中药组原平台象限游泳距离所占百分比降低,两者差异有统计学意义(P<0.01)。见表2、图2。
3.3 补肾填髓方对大鼠前额皮质组织及血清SOD、MDA酶活性的影响
与假手术组比较,模型组SOD活性明显下降,MDA活性显著升高(P<0.01);与模型组比较,中药组、西药组SOD活性均升高,MDA活性均显著下降(P<0.05或P<0.01);西药组与中药组SOD活性、MDA活性比较差异无统计学意义(P>0.05)。见表3。
3.4 补肾填髓方对大鼠海马线粒体的影响
电镜结果显示,正常组和假手术组线粒体形态清楚完整,大小、形状规则,分布均匀且数目多,外膜平整光滑,线粒体膜间隙无明显扩张,线粒体嵴排列整齐呈板层状,内膜和嵴内腔含有较多均匀的颗粒状基质,未见线粒体水肿及空泡化改变。
模型组部分线粒体形态欠完整,结构不清晰,体积缩小,大小、形状不规则,分布紊乱且数目减少,线粒体外膜模糊,内嵴大量断裂或溶解消失,线粒体肿胀,基质疏松清淡,未见基质颗粒,出现空泡化改变。
中药组、西药组大鼠线粒体组织结构上较为完整清晰,大小、形状相对规则,数目较模型组增多,外膜可见,尚光滑,内嵴增多,排列比较整齐,偶可见嵴内腔稍有扩大,内嵴溶解减轻,部分线粒体肿胀明显改善,基质较均匀,可见少许基质颗粒。见图3。
4 讨论
AD是一种与年龄相关的神经系统退行性疾病,β淀粉样蛋白沉积成老年斑是AD病理标志,并且被认为直接损害学习能力和记忆[13],其中Aβ1-42能够自我组装形成寡聚体和淀粉样纤维而具有很强的细胞毒性;Aβ42-1作为它的反序列肽,缺乏了自我组装及构成毒性寡聚态的能力,不具有细胞毒性,故而在许多研究中作为Aβ1-42的对照肽[14]。条件恐惧、放射状迷宫、Morris水迷宫实验、Y迷宫实验等均是AD行为学评价的常用方法[15-16]。AD患者后期多伴有如幻想、焦虑、抑郁等精神症状,旷场实验是评价实验动物在新异环境中自主行为、探究行为与紧张度的一种方法,常用于评价实验动物在新异环境中的焦虑状态。初期就选择Y迷宫进行初筛,并配合旷场实验评分,既可避免Morris水迷宫初筛大鼠会遗留对平台记忆干扰后期Morris水迷宫测试结果,又可排除大鼠情绪原因引起自主活动差异而影响最终的测试结果。造模后大鼠Morris水迷宫实验测定结果显示,模型组逃避潜伏期延长,在原平台象限的游泳时间和游泳距离百分比缩短,假手术组未见明显变化,表明模型大鼠学习记忆受损。
AD发病机制复杂,多种因素参与了它的发病过程,其中氧化应激可能在其中占有重要的地位,大量实验研究及回顾性研究均提出AD发生发展与氧化应激密切相关[17-19]。尽管生理浓度的活性氧在体内的一些信号通路中起着重要作用,但活性氧的过度产生会引起脂质、蛋白、核酸等分子损伤。MDA是一种重要的脂质过氧化产物,表明了机体受氧化损伤的程度。活性氧的消除主要通过酶促及非酶促两种途径,SOD是体内重要抗氧化酶,可通过催化还原态单电子氧转化为过氧化氢从而清除体内氧自由基,减轻氧化损伤的程度,维持生物体细胞成分正常的结构和功能[20]。通过抗氧化手段进行干预,或可延缓疾病向AD终末的进展。本实验结果显示,模型组血清及皮质抗氧化酶SOD活性均有下降,MDA活性均表现升高趋势;中药组可以升高皮质及血清中的SOD活性,降低MDA活性。表明补腎填髓方可以增强机体的抗氧化能力,拮抗过度产生的氧自由基,这与姜招峰等[21]的研究有共通之处,其研究表明海马及皮层部位的氧自由基损伤与大鼠记忆及学习能力密切相关。
由于线粒体电子传递中不可避免的出现电子泄露,成为了机体活性氧主要产生来源,90%内源性氧自由基均由线粒体而来,线粒体自身亦可受到氧自由基的破坏,加剧线粒体的损伤,从而形成恶性循环[22]。本研究通过电镜观察线粒体超微结构,结果显示模型组线粒体形态不完整,结构破坏,体积变小,分布紊乱且数目减少,出现空泡化改变,表明AD模型鼠线粒体整体结构受损;大鼠灌服中药补肾填髓方能使线粒体组织结构部分恢复,大小、形状变得规则,数目增多。表明补肾填髓方对受损的AD大鼠线粒体结构的破坏有改善作用。
AD属于中医学“痴呆”“呆证”的范畴,病性以本虚标实为主,以髓海空虚为本,痰浊、瘀血阻络为标,而肾虚髓空是其根本原因。肾与脑之间有着密不可分的联系,“痴呆”的中医药治疗多集中在补肾填髓。老年痴呆临床辨证分型流行病调查也发现,髓海不足证在所有证型中出现频次最高[23]。补肾填髓方基于经典方剂“孔圣枕中丹”(《千金方》)化裁而成,以淫羊藿、何首乌为君药,功效在于滋阴补肾、强精益血;臣药龟板、龙骨强精益髓,增慧添智;佐以远志、石菖蒲开窍豁痰,醒神益智。纵观全方药物组成,主要功效在于补肾填髓,且兼顾了化痰开窍。现代药理研究表明:淫羊藿中的成分淫羊藿苷可以通过抗氧化应激、抗炎、清除自由基、抑制乙酰胆碱酯酶的活性以及抑制Aβ聚集等途径发挥对AD的改善作用[24]。何首乌主要水溶性成分二苯乙烯苷可改善拟痴呆大鼠的学习记忆能力,提高大鼠海马组织CA1区脑啡肽酶及低密度脂蛋白相关受体1表达,增强对Aβ的降解和转运[25]。远志粗提物经D101大孔吸附树脂富集后,发现皂苷类成分和黄酮类成分或许能通过抗氧化应激,改善小鼠的学习记忆功能[26]。石菖蒲的主要有效成分β-细辛醚可以改善认知功能,其作用机制包括了抑制炎症因子IL-1β、TNF-α的分泌及下调AQP4的表达来保护星形胶质细胞[27]。
本实验显示补肾填髓方可以改善AD大鼠的学习记忆能力,增强抗氧化应激能力,且能够改善线粒体的结构,其机制可能与改善线粒体相关的氧化应激有关,更深入的机制研究还需下一步进行。
参考文献
[1] MALLIKARJUNA N, PRAVEEN K, YELLAMMA K. Role of Lactobacillus plantarum MTCC1325 in membrane-bound transport ATPases system in Alzheimer's disease-induced rat brain[J]. Bioimpacts, 2016,6(4):203-209.
[2] KOUéMOU N, TAIWE G, FCO M, et al. Nootropic and Neuroprotective Effects of Dichrocephala integrifolia on Scopolamine Mouse Model of Alzheimer's Disease[J]. Frontiers in Pharmacology, 2017,8:847.
[3] 李 慧.治疗阿尔茨海默病药物的临床研究进展[J].中国新药杂志,2017,26(6):648-655.
[4] GANGULY G, CHAKRABARTI S, CHATTERJEE U, et al. Proteinopathy, oxidative stress and mitochondrial dysfunction: cross talk in Alzheimer's disease and Parkinson's disease[J]. Drug design, development and therapy, 2017,11:797-810.
[5] 周 鸿,霍利琴,张静泽,等.舒脑欣滴丸对D-半乳糖致阿尔茨海默病早期模型大鼠的神经保护作用及机制研究[J].中草药,2016,47(17):3074-3078.
[6] 张运辉,伍大华,袁春云,等.二苯乙烯苷和三七总皂苷配伍对Aβ(25-35)致PC12细胞损伤影响的研究[J].湖南中医药大学学报,2015,35(9):20-22.
[7] 黎巍威,王學美.中医从“肾”防治阿尔茨海默病的现代研究[J]. 中国实验方剂学杂志,2010,16(13):227-231.
[8] 易显富,彭 力,陈向军,等.电针对阿尔茨海默病模型SD大鼠学习记忆功能及海马神经细胞凋亡的影响[J].实用临床医药杂志,2015,19(1):1-6.
[9] XI Y, DING J, HAN J, et al. The effect of soybean isoflavone on the dysregulation of NMDA receptor signaling pathway induced by β-amyloid peptides 1-42 in rats[J]. Cellular and molecular neurobiology, 2015,35(4):555-562.
[10] P G, W C. The rat brain in stereotaxic coordinates[M]. 6th ed. New York: Elsevier Academic Press, 2007:78-80.
[11] LIU M, GUO H, LI C, et al. Cognitive improvement of compound danshen in an Abeta25-35 peptide-induced rat model of Alzheimer's disease[J]. BMC Complementary and Alternative Medicine, 2015,15:382.
[12] 邱 宏,金国琴,金如锋,等.水迷宫重复测量数据的方差分析及其在SPSS中的实现[J].中西医结合学报,2007(1):101-105.
[13] SHARMA S, VERMA S, KAPOOR M, et al. Alzheimer's disease like pathology induced six weeks after aggregated amyloid-beta injection in rats: increased oxidative stress and impaired long-term memory with anxiety-like behavior[J]. Neurological Research, 2016,38(9):838-850.
[14] VADUKUL D, GBAJUMO O, MARSHALL K, et al. Amyloidogenicity and toxicity of the reverse and scrambled variants of amyloid-β 1-42[J]. FEBS Letters, 2017,591(5):822-830.
[15] PUZZO D, LEE L, PALMERI A, et al. Behavioral assays with mouse models of Alzheimer's disease: practical considerations and guidelines[J]. Biochemical Pharmacology, 2014,88(4):450-467.
[16] SUGANTHY N, MALAR D, DEVI K. Rhizophora mucronata attenuates beta-amyloid induced cognitive dysfunction, oxidative stress and cholinergic deficit in Alzheimer's disease animal model[J]. Metabolic Brain Disease, 2016,31(4):937-949.
[17] PERSSON T, POPESCU B, CEDAZO-MINGUEZ A. Oxidative stress in Alzheimer's disease: why did antioxidant therapy fail?[J]. Oxidative Medicine and Cellular Longevity, 2014,2014:427318.
[18] DI DOMENICO F, TRAMUTOLA A, BUTTERFIELD D. Role of 4-hydroxy-2-nonenal (HNE) in the pathogenesis of alzheimer disease and other selected age-related neurodegenerative disorders[J]. Free Radical Biology and Medicine, 2017,111:253-261.
[19] BRADLEY-WHITMAN M, TIMMONS M, BECKETT T, et al. Nucleic acid oxidation: an early feature of Alzheimer's disease[J]. Journal of Neurochemistry, 2014,128(2):294-304.
[20] MANOHARAN S, GUILLEMIN G, ABIRAMASUNDARI R, et al. The Role of Reactive Oxygen Species in the Pathogenesis of Alzheimer's Disease, Parkinson's Disease, and Huntington's Disease: A Mini Review[J]. Oxidative Medicine and Cellular Longevity, 2016,2016:8590578.
[21] 姜招峰,周 翔,楊翰仪.海马及皮层的氧自由基损伤与大鼠学习能力和记忆能力的关系[J].中国行为医学科学,2001,10(4):286-288.
[22] SIMONCINI C, ORSUCCI D, CALDARAZZO IENCO E, et al. Alzheimer's pathogenesis and its link to the mitochondrion[J]. Oxidative Medicine and Cellular Longevity, 2015,2015:803942.
[23] 李 帅,哈德尔巴哈尔,张 凯,等.老年性痴呆中医证型研究[J]. 河南中医,2014,34(3):420-421.
[24] 高宁辛,马宇昕,王淑美,等.淫羊藿苷对阿尔茨海默病的改善作用及机制研究进展[J].广东化工,2018,45(363):104-105.
[25] 李小黎,刘晓梅,赵瑞珍,等.何首乌二苯乙烯苷对拟痴呆大鼠学习记忆和海马组织CA1区脑啡肽酶及低密度脂蛋白相关受体1表达的影响[J].中国全科医学,2015,18(32):3948-3951.
[26] 孟 磊,庞 月.远志抗老年痴呆活性部位筛选[J].锦州医科大学学报,2018,39(4):19-23.
[27] YANG Y, XUAN L, CHEN H, et al. Neuroprotective Effects and Mechanism of β-Asarone against Aβ1-42-Induced Injury in Astrocytes[J]. Evidence-based Complementary and Alternative Medicine, 2017,2017:8516518.
