培养基主成分优化提高大花金挖耳胞内黄酮产量
2019-09-10李玉平龚宁
李玉平 龚宁

摘 要:【目的】优化组合培养基中大量、微量元素及附加激素等培养条件,筛选出大花金挖耳细胞培养黄酮的生产培养基。【方法】以NT+1.0 mg·L-1 NAA + 0.2 mg·L-1 6-BA为基本培养基,先优化组合其大量元素NH+4、NO-3、K+,再优化组合微量元素MoO2-4、Zn2+、BO3-3、Co2+、Cu2+、I-、Mn2+,最后分别附加2,4-D、KT、GA3,测定大花金挖耳悬浮培养细胞生长、黄酮含量及产量。【结果】大量元素优化、微量元素优化及附加激素KT、GA3,大花金挖耳细胞培养物中黄酮产量均得到了显著提升(P<0.05),添加2,4-D降低了黄酮产量。本研究筛选得到大花金挖耳细胞培养生产黄酮类化合物的最佳NT培养基为:大量元素NH+4、NO-3、K+分别为15.46 mmol·L-1、14.10 mmol·L-1、19.10 mmol·L-1,微量元素MoO2-4、Zn2+、BO3-3、Co2+、Cu2+ 、I-、Mn2+分别为3.0 μmol·L-1、0.06 mmol·L-1、0.4 mmol·L-1、0.2 μmol·L-1、0.4 μmol·L-1、10 μmol·L-1、0.2 mmol·L-1,附加KT 0.2 mg·L-1。在此培养条件下,大花金挖耳细胞培养物中黄酮含量达到2.05%,是基本培养基的1.68倍;黄酮产量为517.87 mg·L-1,是基本培养基的1.80倍。【结论】在前期研究的基础上,通过培养基主成分优化,提高了大花金挖耳细胞培养生产黄酮的产量,初步得到了黄酮生产培养基。
关键词: 大量元素;微量元素;植物激素;黄酮;大花金挖耳
中图分类号:Q 813.1文献标识码:A文章编号:1008-0384(2019)06-652-08
Abstract: 【Objective】 Formulation of the medium for Carpesium macrocephalum culture to produce flavonoids was optimized from the one obtained by a previous study.【Method】 Using NT+NAA 1.0 mg·L-1+0.2 mg·L-1 6-BA as the base, the medium optimizations were firstly carried out on the macro-elements, NH+4, NO-3 and K+, then the micro-elements, MoO2-4, Zn2+, BO3-3, Co2+, Cu2+, I-, and Mn2+ and followed by the added 2,4-D, KT and GA3. The cellular growth as well as the flavonoids yield in the culture suspension were monitored for evaluation. 【Result】 With the optimized addition of the macro- and micro-elements plus KT or GA3, the flavonoids produced by C. macrocephalum culture significantly increased (P<0.05), but reduced by the presence of 2,4-D. The finalized medium consisted of the base with added 15.46 NH+4 mmol·L-1, NO-3 14.10 mmol·L-1, K+ 19.10 mmol·L-1, MoO2-4 3.0 μmol·L-1, Zn2+ 0.06 mmol·L-1, BO3-3 0.4 mmol·L-1, Co2+ 0.2 μmol·L-1, Cu2+ 0.4 μmol·L-1, I- 10 μmol·L-1, Mn2+ 0.2 mmol·L-1, and KT 0.2 mg·L-1. The resulting flavonoids content in the culture suspension was 2.05%, which was 1.68-fold of control, and the flavonoids yield 517.87 mg·L-1, which was 1.80-fold of control. 【Conclusion】 By further modifying the previously obtained medium, the flavonoids produced from the C. macrocephalum culture significantly increased.
Key words:macroelements; microelements; phytohormone; flavonoids; Carpesium macrocephalum
0 引言
【研究意義】大花金挖耳Carpesium macrocephalum Franch.et Sav.系菊科天名精属多年生草本植物,具有抗肿瘤、止血等医用价值[1-2]和杀菌、杀虫及除草等农药活性[3-5]。黄酮类化合物是其主要活性成分之一[6-7],具有抗菌、抗病毒、抗癌等药用价值和病虫害防御、化感等植保作用[8-9],具有极大的开发价值。【前人研究进展】利用细胞培养生产黄酮类化合物是解决大花金挖耳野生植物资源短缺和黄酮类化合物人工合成困难等问题的有效手段[10-11]。培养基种类、大量元素、微量元素、植物激素、诱导子、细胞系、光照、pH等因素都会对植物细胞生物合成黄酮类化合物产生影响[12]。郭佳祺[13]通过优化接种量、培养基、转速、pH值、无机盐浓度、光照周期等培养条件,提高了蒺藜细胞生物合成黄酮的能力;赵德修等[14]开展了温度、光照、激素、碳源等不同理化因子对雪莲培养细胞生物合成黄酮的研究;陈红贤等[15]研究发现碳源、氮源、磷源等大量元素的消耗与国槐槐角种胚细胞生长和黄酮的积累密切相关,黄酮的积累和细胞生长属于部分生长偶联型。李玉平等[11,16-17]研究了大花金挖耳愈伤组织的诱导、增殖,建立了细胞悬浮系,并初步开展了培养基、大量元素、微量元素等理化因素对大花金挖耳细胞培养黄酮类化合物的研究。【本研究切入点】在前期研究中,采取单因素试验已筛选出了对大花金挖耳细胞培养生产黄酮类化合物有显著影响的大量元素[17]和微量元素[18]中各元素的最适浓度,亟待进一步优化组合相关理化因子及培养条件,提高大花金挖耳培养细胞的黄酮产量。【拟解决的关键问题】本研究遴选对大花金挖耳培养细胞生长和黄酮含量增加有贡献的硝酸钾(KNO3)、硝酸铵(NH4NO3)、钼酸钠(Na2MoO4·2H2O)、硫酸锌(ZnSO4·7H2O)、硫酸铜(CuSO4·5H2O)硼酸(H3BO3)等大量、微量元素化合物进行组合优化,并分别附加激素2,4-D、KT、GA3,旨在筛选黄酮生产培养基,提高细胞黄酮产量,为大花金挖耳工厂化细胞培养黄酮类化合物提供依据。
1 材料和方法
1.1 试验材料
1.1.1 细胞悬浮系
大花金挖耳细胞悬浮系由西北农林科技大学陕西省生物农药工程技术研究中心筛选获得[16],繼代培养于基本培养基NT0(NT+1.0 mg·L-1 NAA + 0.2 mg·L-1 6-BA+40 g·L-1蔗糖)。继代培养时间为7~10 d(细胞生长的对数期),培养条件:pH 5.8、摇床120 r·min-1、(25±2)℃,光照强度1 500~2 000 lx、光照12 h·d-1,下同。
1.1.2 仪器和试剂
主要仪器:EBP-190S电子天平(Sartorius公司);S-315Tomy High-pressure steam sterilizer(Tomy KOGYO CO.LTD.Nerima Tokyo.Japan);UV1102紫外/可见分光光度计(上海天美科学仪器有限公司);PHS-25型酸度计(上海雷磁仪器厂); ZRD-5030全自动鼓风干燥箱(上海智诚分析仪器制造有限公司); HZT2双层振荡器(哈尔滨市东联电子技术开发有限公司)。
主要试剂:芦丁标准品(中国药品生物制品检定所);萘乙酸(NAA)、6-苄氨基嘌呤(6-BA)、二氯苯氧乙酸(2,4-D)、苄氨基腺嘌呤(KT)、赤霉酸(GA3)(美国Sigma 公司);培养基中添加的蔗糖、肌醇及NT[19]培养基中添加的各种化合物均为分析纯;丙酮为分析纯。
1.2 试验方法
1.2.1 悬浮培养细胞生长及黄酮累积的优化试验
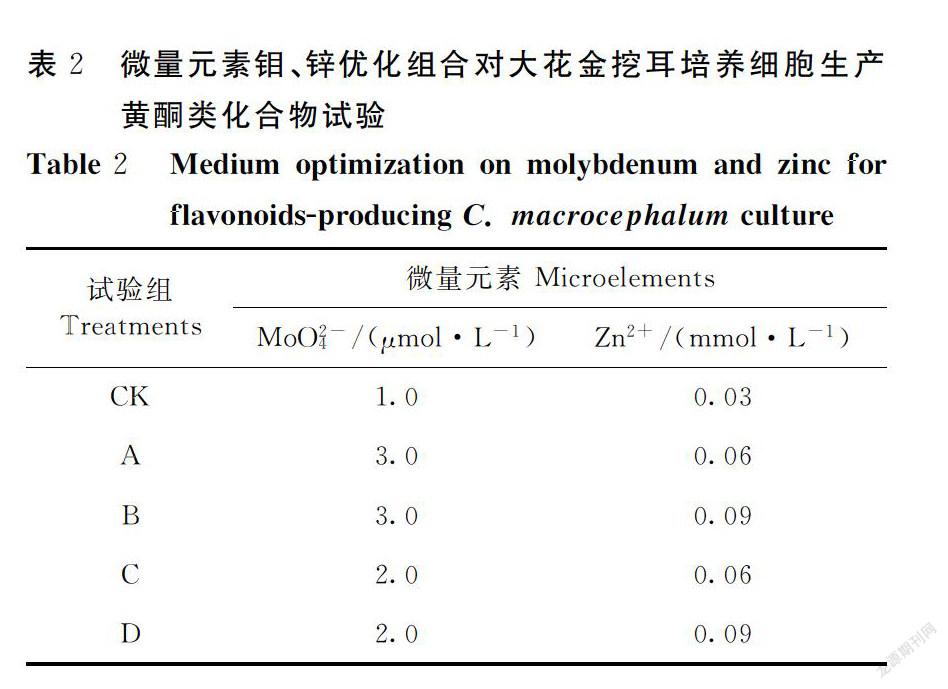
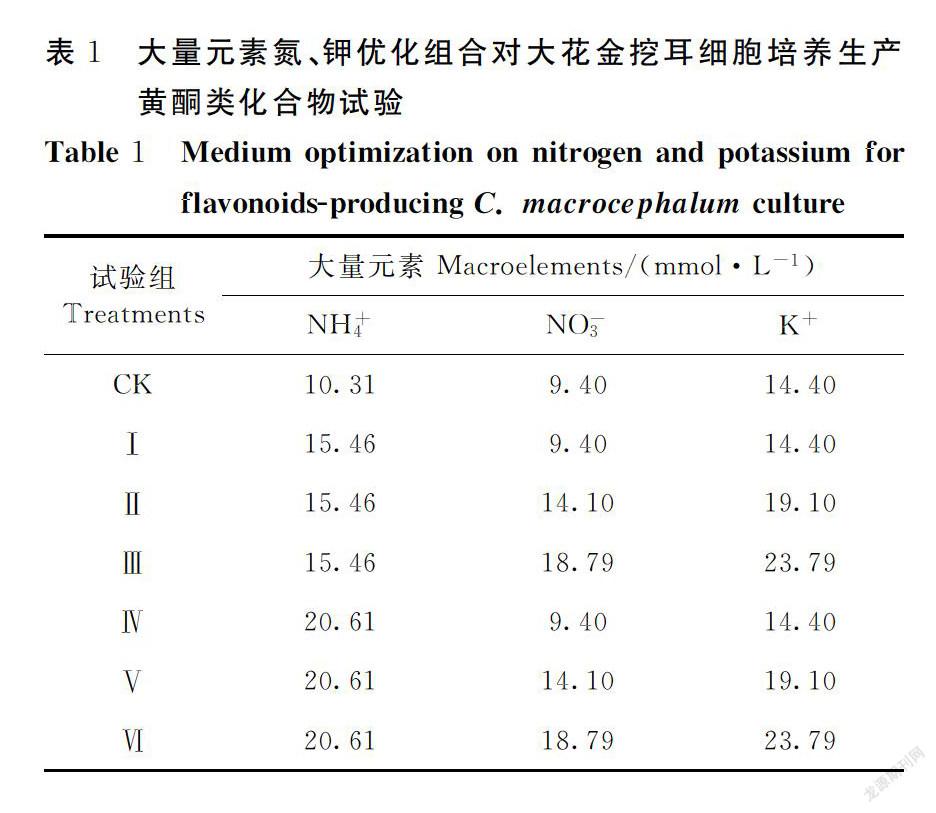
将基本培养基(NT0)中培养7~10 d的细胞接种40 g·L-1鲜重于试验所设计的培养基中,试验均采用250 mL三角瓶,每瓶100 mL液体培养基。培养条件同上。考察大量、微量元素优化及附加激素2,4-D、KT、GA3对悬浮培养细胞生长及黄酮累积的影响。
向培养基NT0中添加KNO3和NH4NO3,对大花金挖耳悬浮培养细胞生长和黄酮含量增加有显著影响的大量元素NH+4、NO-3、K+进行优化组合(表1),其他大量元素为NT培养基固有浓度[19],以NT0为对照(CK),考察大量元素优化组合对大花金挖耳悬浮培养细胞生长和黄酮合成的影响,并得到生产培养基NT1; 在大量元素优化组合的基础上,选取前期试验中对大花金挖耳悬浮培养细胞生长和黄酮含量增加最为显著的MoO2-4、Zn2+两种微量元素进行优化组合(表2),BO3-3、Co2+、Cu2+、I-、Mn2+等微量元素离子浓度依次为:0.4 mmol·L-1 、0.2 μmol·L-1、0.4 μmol·L-1、10 μmol·L-1、0.2 mmol·L-1,以NT1为对照(CK),考察微量元素优化组合对大花金挖耳悬浮培养细胞生长和黄酮合成的影响,并得到生产培养基NT2; 在大量元素和微量元素优化组合培养基的基础上,以NT2为对照(CK),再分别添加2,4-D(0、0.1、0.2、0.5、1.0 mg·L-1)、KT(0、0.1、0.2、0.5、1.0 mg·L-1)和GA3(0、0.1、0.2、0.3、0.5 mg·L-1),进一步研究激素对细胞生长和黄酮产量的影响。
1.2.2 生物量的测定
将上述不同试验处理培养基悬浮培养20 d左右的褐化细胞进行真空抽滤,所得细胞60℃烘干,细胞干重DW(g·L-1)为培养细胞的生长指标。细胞净生长量=收获时细胞干重-接种时细胞干重。
1.2.3 黄酮含量的测定和产量的计算
总黄酮含量测定参考文献[18]。以芦丁为标品,确定检测波长为510 nm,以芦丁质量浓度L(mg·mL-1)对吸光值A进行线性回归,得方程L=0.0768 A-0.0004(r=0.999 7)。将上述各试验处理中悬浮培养20 d的细胞抽滤、烘干、粉碎,以丙酮为溶剂,取适量过60目筛的粉碎细胞干粉,振荡提取3次,每次24 h,合并提取液,浓缩后用30%乙醇定容至0.50 g·mL-1,取适量供试液,测定总黄酮含量(X%),X% = V×Y/N×M×10-1,V为提取液体积(mL),Y为供试液总黄酮质量浓度(mg·mL-1),N为细胞质量(g),M为稀释倍数。总黄酮产量(mg·L-1) =黄酮含量(%)×细胞生长量(g·L-1)×1000。
1.3 数据处理
以上试验重复3次,采用DPS数据分析软件对试验数据进行Duncan分析(P=0.05)。2 结果与分析
2.1 大量元素优化组合对悬浮培养细胞的生长和黄酮累积的影响
如图1所示,大量元素优化组合后的培养基对大花金挖耳培养细胞的生长和黄酮化合物的累积均有显著的影响。从细胞生长量上看,处理Ⅱ和Ⅲ显著高于对照,处理Ⅳ、Ⅴ显著低于对照(P<0.05),以处理Ⅲ(15.46 mmol ·L-1NH+4+ 18.79 mmol ·L-1NO-3 +23.79 mmol ·L-1K+ )所得细胞净干重最高,为22.70 g·L-1,是对照的1.05倍;NT1中悬浮培养的细胞呈黄色,明显深于NT0(图2)。从黄酮含量和黄酮产量上看,所有处理均高于对照,其中处理Ⅱ和处理Ⅲ的黄酮含量和产量均显著高于对照(P<0.05),黄酮含量是对照的1.20~1.21倍,黄酮产量是对照的1.26倍;处理Ⅱ(NH+4 15.46 mmol·L-+ NO-3 14.10 mmol·L-1+K+ 19.10 mmol·L-1)所得黄酮含量最高,为1.48%(P<0.05),产量也最高,为363.95 mg·L-1。因此,以处理Ⅱ试验组为大量元素优化组合提高培养细胞生物合成黄酮类化合物的最适培养基NT1。
2.2 微量元素优化组合对悬浮培养细胞的生长和黄酮累积的影响
如图3所示,在优化大量元素培养基的基础上,研究发现微量元素优化组合后的培养基对大花金挖耳培养细胞黄酮化合物的累积有显著的影響。从细胞生长量上看,4个处理均较对照有一定的增高,但差异不显著;从黄酮含量上看,处理A、B、C显著高于对照(P<0.05),以处理A最高,达1.89%,是对照的1.55倍;从黄酮产量上看,所有处理均高于对照,处理A、B差异显著(P<0.05),以处理A(3.0 μmol·L-1 MoO2-4+ 0.06 mmol·L-1 Zn2+ +0.4 mmol·L-1 BO3-3+ 0.2 μmol·L-1 Co2+ + 0.4 μmol·L-1 Cu2+ + 10 μmol·L-1 I-+ 0.2 mmol·L-1Mn2+ )最高(P<0.05),达476.97 mg·L-1,是对照的1.66倍。因此,认为处理A试验组为微量元素优化组合提高培养细胞生物合成黄酮类化合物的最适培养基NT2。
2.3 2,4-D对悬浮培养细胞的生长和黄酮类化合物累积的影响
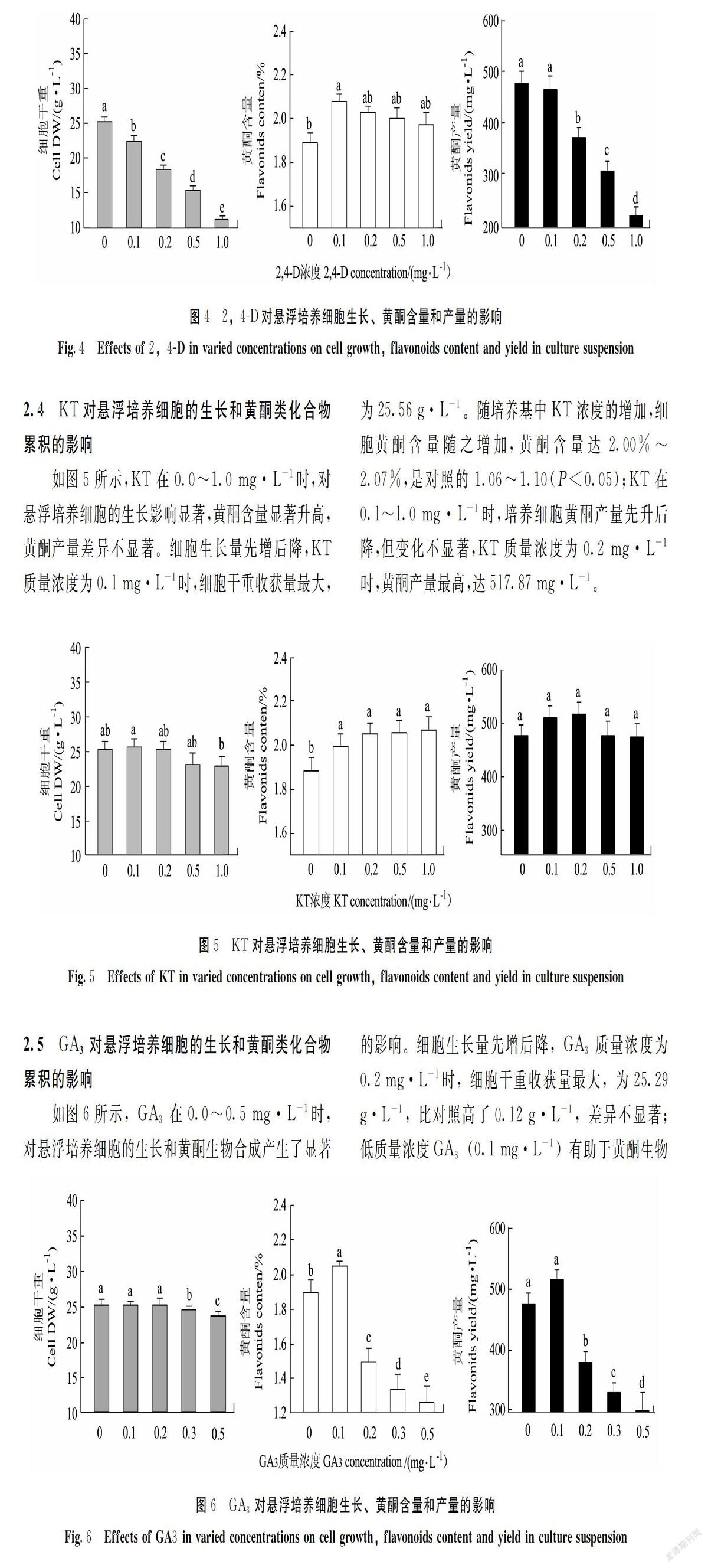
如图4所示,2,4-D在0.0~1.0 mg·L-1时,对大花金挖耳悬浮培养细胞黄酮生物合成有显著影响。培养基中添加2,4-D降低了培养细胞的干重收获量和黄酮产量;低浓度2,4-D(0.1 mg·L-1)有助于黄酮生物合成,含量为2.08%,是对照的1.10倍(P<0.05),但此时黄酮产量仅为464.62 mg·L-1,与对照差异不显著。
2.4 KT对悬浮培养细胞的生长和黄酮类化合物累积的影响
如图5所示,KT在0.0~1.0 mg·L-1时,对悬浮培养细胞的生长影响显著,黄酮含量显著升高,黄酮产量差异不显著。细胞生长量先增后降,KT质量浓度为0.1 mg·L-1时,细胞干重收获量最大,为25.56 g·L-1。随培养基中KT浓度的增加,细胞黄酮含量随之增加,黄酮含量达2.00%~2.07%,是对照的1.06~1.10(P<0.05);KT在0.1~1.0 mg·L-1时,培养细胞黄酮产量先升后降,但变化不显著,KT质量浓度为0.2 mg·L-1时,黄酮产量最高,达517.87 mg·L-1。
2.5 GA3对悬浮培养细胞的生长和黄酮类化合物累积的影响
如图6所示,GA3在0.0~0.5 mg·L-1时,对悬浮培养细胞的生长和黄酮生物合成产生了显著的影响。细胞生长量先增后降,GA3质量浓度为0.2 mg·L-1时,细胞干重收获量最大,为25.29 g·L-1,比对照高了0.12 g·L-1,差异不显著;低质量浓度GA3(0.1 mg·L-1)有助于黄酮生物合成,含量高达2.05%,是对照的1.08倍(P<0.05),随培养基中GA3质量浓度的增加,细胞黄酮含量显著降低;GA3为0.1 mg·L-1时,黄酮产量最高,达516.06 mg·L-1,是对照1.08倍(P<0.05),继续增加GA3质量浓度,培养细胞的黄酮产量显著降低。
3 讨论与结论
植物细胞培养黄酮化合物受培养基组分、激素、物理条件等多方面因素的影响,目前没有统一的标准条件适于所有的植物细胞培养,这就需要研究者对不同植物细胞培养生产黄酮的最佳条件进行研究[12]。培养基组分是植物培养细胞生长和次生代谢物积累中最直接、最重要的影响因素[19]。本文主要围绕提高大花金挖耳培养细胞黄酮产量的大量、微量元素及激素优化组合进行讨论分析。
相对于高盐培养基MS和低盐培养基White,NT属于中等无机盐培养基,其中的N、P、Ca、Mg、K等大量元素对大花金挖耳悬浮培养细胞生长和黄酮合成均产生了影响。本研究选取前期试验[17]中对大花金挖耳细胞培养有显著贡献的NH+4、NO-3、K等大量元素进行进一步优化组合,发现当NT培养基中NH+4、NO-3、K+浓度依次为15.46、14.10、19.10 mmol·L-1时,显著提高了黄酮含量和产量,分别为1.48%和363.95 mg·L-1,分别是对照的1.21和1.26倍。可见,调节NT中总氮浓度或铵态氮与硝态氮的比例可显著促进培养细胞生长和黄酮生物的合成,这与水母雪莲、银杏、草莓等植物细胞培养黄酮的研究相似[12]。分析国槐槐角[15]、茶条槭[20]、玫瑰茄[21]细胞培养次生代谢物中氮源消耗的规律,不难推断,氮源消耗的前期主要用于细胞蛋白质、核酸等结构性组分的合成,后期主要用于各种与次级代谢相关酶的合成[22];铵态氮与细胞生长密切相关,硝态氮与黄酮、紫杉醇、没食子酸等次生代谢物的合成相关[15,20-23];钾离子在细胞培养过程中发挥着“离子泵”的作用,对细胞渗透压及营养物质的吸收具有调节作用[24]。
微量元素是植物细胞酶的组成分子或活化剂,具有重要的生理生化作用[18,25-26]。笔者前期系统研究了NT培养基中MoO2-4、Zn2+、BO3-3、Co2+、Cu2+、I-、Mn2+、Fe2+等8种微量元素单一因素对大花金挖耳悬浮培养细胞生长和黄酮合成的影响,本研究选取前期试验中对大花金挖耳细胞培养有显著贡献的MoO2-4、Zn2+等微量元素进行进一步的优化组合,发现大量元素优化后的NT培养基中MoO2-4、 Zn2+、BO3-3、Co2+、Cu2+ 、I-、Mn2+等微量元素浓度依次为3.0 μmol·L-1、 0.06 mmol·L-1、0.4 mmol·L-1、0.2 μmol·L-1、0.4 μmol·L-1、10 μmol·L-1、0.2 mmol·L-1时,培养细胞的黄酮含量和产量可分别达到1.89%和476.97 mg·L-1,较优化大量元素的NT1培养基再次提高了黄酮的含量和产量。可见,微量元素含量虽少,但调节NT中微量元素浓度及其配比仍可显著促进细胞生长和黄酮生物的合成,说明微量元素在细胞培养过程中,既独立发挥各自生理生化作用,同时又与大量元素及其他微量元素相互作用协同促进了大花金挖耳悬浮细胞的光合、呼吸、氮代谢等初生代谢,并提升了培养细胞黄酮类等化合物的生物合成能力。
不同种类、不同浓度的植物生长素和细胞分裂素及其配比对植物细胞的生长和次生代谢产物的积累有着显著的影响[27]。本研究以NT+1.0 mg·L-1 NAA + 0.2 mg·L-1 6-BA为基本培养基,在大量元素和微量元素优化组合的基础上,再分别添加2,4-D、KT和GA3,结果发现低质量浓度2,4-D(0.1 mg·L-1)有助于黄酮生物合成,2,4-D抑制黄酮的生物合成,添加2,4-D抑制了细胞的生长,总体降低了黄酮的产量,这与2,4-D在许多植物细胞培养中抑制次生代谢物质的产生的研究结论相一致[27]。另外,低质量浓度KT(0.1 mg·L-1)有助于细胞的生长,高质量浓度(>0.1 mg·L-1)抑制了细胞的生长,附加KT(0.1~1.0 mg·L-1)黄酮含量增加显著,0.2 mg·L-1 KT时,黄酮产量最高达517.87 mg·L-1,是对照1.09倍,可见附加不同浓度KT对细胞生长和黄酮合成效果不同,这与KT在红花细胞生长及红花色素合成中发挥的作用相似[28]。低浓度GA3促进了细胞生长和黄酮的生物合成,高浓度GA3抑制了细胞黄酮的合成,这可能与GA3抑制查尔酮合成酶有关[29-30]。
总之,在前期研究的基础上,通过NT培养基中大量元素、微量元素逐步优化及添加激素等试验手段,大花金挖耳悬浮培养细胞黄酮含量和产量显著高于对照,影响顺序为:大量、微量元素优化,并附加KT的NT培养基>大量、微量元素优化的NT培养基>大量元素优化的NT培养基,黄酮含量大小依次是:2.05%、1.89%、1.48%,黄酮产量大小依次为:517.87、476.97、363.95 mg·L-1。本研究系统优化了NT培养基中对大花金挖耳细胞培养有促进作用的相关因子,初步筛选得到了黄酮生产培养基,为实现大花金挖耳细胞培养工业化生产黄酮提供了试验依据。
参考文献:
[1]中国科学院中国植物志编委会.中国植物志[M],北京:科学出版社,1989:295-296.
Chinese Academy of Sciencer Chinese Flora Writers.Flora of China[M].Beijing:Sciene Press,1989:295-296.(in Chinese)
[2]谢宗万,余友芩.全国中草药名鉴[M].上海:人民卫生出版社,1996:756.
XIE Z W,YU Y Q.Appraisal of Traditional Chinese Medical Herbs in China[M].Beijing:People′s Medical Publishing House,1996:756.(in Chinese)
[3]李玉平,慕小倩,冯俊涛,等.几种菊科植物杀菌活性的初步研究[J].西北农林科技大学学报(自然科学版),2002,30(1):68-72.
LI Y P,MU X Q,FENG J T,et al.Primary study on the fungicidal activity of compositae plants[J].Journal of Northwest A&F University (Natural Science Edition),2002,30(1):68-72.(in Chinese)
[4]郝双红,祝木金,冯俊涛,等.35种菊科植物除草活性初步测定[J].西北农林科技大学学报(自然科学版),2005,32(5):22-26.
HAO S H,ZHU M J,FENG J T,et al.Preliminary study on the herbicidal activity of composite plants[J]. Journal of Northwest A&F University (Natural Science Edition),2005,32(5):22-26.(in Chinese)
[5]張宏利,冯俊涛,陈安良,等.秦岭山区204种植物对粘虫生物活性测定[J].西北林学院学报,2004,19(3):92-94.
ZHANG H L,FENG J T,CHEN A L,et al.Insecticidal activity of 204 plants to Mythimna separata in the Qinling Mountains[J]. Journal of Northwest Forestry University,2004,19(3):92-94.(in Chinese)
[6] KIM M R,LEE S K,KIM C S,et al. Phytochemical constituents of Carpesium macrocephalum[J].Archives of Pharmacal Research, 2004, 27(10):1029-1033.
[7]王俊儒,胡志彬,冯俊涛,等.大花金挖耳不同部位挥发油化学成分比较分析[J].西北植物学报,2008,28(6):1239-1245.
WANG J R,HU Z B,FENG J T,et al.Chemical constituents of essential oil from different parts of Carpesium macrocephalum[J].Acta Botanica Boreali-Occidentalia Sinica,2008,28(6):1239-1245.(in Chinese)
[8]周明,沈勇根,朱丽琴,等.植物黄酮化合物生物合成、积累及调控的研究进展[J].食品研究与开发,2016,37(18):216-221.
ZHOU M,SHEN Y G,ZHU L Q,et al.Research progress on biosynthesis,accumulation and regulation of flavonoids in plants[J].Food Research and Development,2016,37(18):216-221.(in Chinese)
[9]杨才琼,杨文钰,刘江.植物类黄酮的化学生态学意义[J].天然产物研究与开发,2018,30(11):2009-2016.
YANG C Q,YANG W Y,LIU J.Advances on chemical ecology of plant flavonoids[J].Natural Product Research and Development,2018,30(11):2009-2016.(in Chinese)
[10]陈月华,朱艳,张翔,等.植物细胞悬浮培养中次生代谢产物积累的研究进展[J].中国野生植物资源,2016,35(3):41-48.
CHEN Y H,ZHU Y,ZHANG X,et al.Research progress in plant cell suspension culture for production of secondary metabolites[J].Chinese Wild PlantResources,2016,35(3):41-48.(in Chinese)
[11]李玉平,姜在民,冯俊涛,等.不同培养条件对大花金挖耳愈伤组织生长及黄酮产量的影响[J].核农学报,2008,22(3):286-290.
LI Y P,JIANG Z M,FENG J T,et al.Effects of different cultural conditionson callus growth and flavonoid yield of Carpesium macrocephalum[J].Journal ofNuclear Agricultural Sciences,2008,22(3):286-290.(in Chinese)
[12] 李燕,王春兰,郭顺星,等.植物组织和细胞培养物中黄酮类物质积累影响因素的研究进展[J].中国药学杂志,2006,41(9):651-655.
LI Y,WANG C L,GUO S X,et al.Advances in studies on factors affecting the accumulation of flavonoids in plant tissues and cell cultures[J].Chinese Journal of Pharmaceuticals,2006,41(9):651-655.(in Chinese)
[13]郭佳祺.蒺藜悬浮培养体系建立及不同因子对黄酮醇含量影响[D].长春:吉林农业大学,2017.
GUO J Q.Establishment of Tribulus terrestris L.suspension culture system and effects of different factors on flavonoids content [D].Changchun:Jilin Agricultural University,2017.(in Chinese)
[14]赵德修,汪沂,赵敬芳.不同理化因子对雪莲培养细胞中黄酮类形成的影响[J].生物工程学报,1998(3):24-29.
ZHAO D X,WANG Y,ZHAO J F.Effect of Physical and Chemical factors on callus growth and flavonoids biosynthesis in the callus cultures of Saussurea medusa[J].Chinese Journal of Biotechnology,1998(3):24-29.(in Chinese)
[15]陈红贤,于笑笑,王晨阳,等.国槐槐角种胚细胞悬浮培养的动力学研究[J].浙江农林大学学报,2016, 33(2): 272-279.
CHEN H X,YU X X,WANG C Y,et al.Kinetics of Sophora japonica embryo cells in a suspension culture system
[J].Journal of Zhejiang A & F University,2016, 33(2):272-279.(in Chinese)
[16]李玉平,龚宁,王永宏,等.大花金挖耳细胞悬浮系的建立及黄酮类化合物的产生[J].食品科学,2010,31(21):239-243.
LI Y P,GONG N,WANG Y H,et al.Optimization of cell suspension culture of Carpesium macrocephalum for flavonoid production[J]. Food science,2010,31(21):239-243.(in Chinese)
[17]李玉平,張妮,陈晓旭,等.大花金挖耳细胞悬浮培养及其胞内代谢产物化感潜力的研究[J].草地学报,2010,18(5):708-713.
LI Y P,ZHANG N,CHEN X X,et al.Allelopathy potential of intracellular secondary metabolic products and cell suspension culture of Carpesium macrocephalum Franch.et Sav[J]. Acta Agrestla Sinica,2010,18(5):708-713.(in Chinese)
[18]李玉平,李惟雄.微量元素对大花金挖耳细胞生长和黄酮含量积累的影响[J].福建农业学报,2019,34(1):1-8.
LI Y P,LI W X.Effects of trace elements in culture medium on growth, flavonoids content and intracellular metabolite allelopathy of Carpesium macrocephalum[J].Fujian Journal of Agricultural Sciences,2019,34(1):1-8.(in Chinese)
[19]朱至清.植物细胞工程[M].北京:化学工业出版社,2003:20,209.
ZHU Z Q.Plant Cell Engineering[M].Beijing:Chemical Industry Press,2003:20,209.(in Chinese)
[20]董杰,詹亚光,任健.茶条槭悬浮培养的动力学[J].林业科学,2012,48(10):18-23.
DONG J,ZHAN Y G,REN J.Kinetics in suspension culture of Acer ginnala[J].Scientia Silvae Sinicae,2012,48(10):18-23.(in Chinese)
[21]阮茜,郭勇.磷限制培养中玫瑰茄细胞生长及花青素形成动力学[J].华南理工大学学报(自然科学版),1999,27(1):86-90.
RUAN Q,GUO Y.Kinetics on growth of Roselle cells and anthocyanin formation in phosphorus limiting cultures[J].Journal of South China University of Technology(Natural Science Edition),1999,27(1):86-90.(in Chinese)
[22]李春,李娟,沈慧慧,等.肉苁蓉细胞悬浮培养的代谢动力学研究[J].天然产物研究与开发,2007,19(2):193-197.
LI C,LI J,SHEN H H,et al.Metabolic Kinetics dynamic of suspension culture of Cistanche deserticola[J].Natural
Product Research and Development,2007,19(2):193-197.(in Chinese)
[23]仇燕,王丽,刘子会,等.对数期继代对南方红豆杉细胞培养动力学的影响[J].中草药,2003,34(9):849-852.
QIU Y,WANG L, LIU Z H,et al.Effect of subculture at logarithmic phase on kinetics of cell cultures of Taxus chinensis var. mairei[J].Chinese Traditional and Herbal Drugs,2003,34(9):849-852.(in Chinese)
[24]郭志刚,都军,刘瑞芝.紫杉细胞生长过程与营养物质消耗的动态研究[J].清华大学学报(自然科学版),2002,5(42):599-602.
GUO Z G,DU J,LIU R Z.Kinetic investigation of Taxus cell growth and nutrient consumption[J].J Tsinghua Univ (Natural Science Edition),2002,5(42):599-602.(in Chinese)
[25]李琰,张朝红,马希汉.培养基成分对杜仲愈伤组织生长及次生代谢产物含量的影响[J].武汉植物学研究,2004,22(4):359-363.
LI Y,ZHANG Z H,MA X H.Effects of medium concentration on callus growth and secondary metabolites of Eucommia ulmoides[J].Journal of Wuhan Botanical Research,2004,22(4):359-363.(in Chinese)
[26]郑成木,刘进平.热带亚热带植物微繁殖[M].长沙:湖南科学技术出版社,2001:59-66.
ZHENG C M,LIU J P.Micropropagation of Tropical and Subtropical Plants[M].Changsha:Hunan Science and Technology Press,2001:59-66.(in Chinese)
[27]吕春茂,范海延,姜河,等.植物细胞培养技术合成次生代谢物质研究进展[J].云南农业大学学报,2007,12(1):1-7.
LV C M,FAN H Y,JIANG H.Research Advances on synthesis of secondary Metabolities by plant cell culture[J].Journal of Yunnan Agricultural University,2007,12(1):1-7.(in Chinese)
[28]GAO W Y, FAN L, PAEK K Y. Yellow and red pigment production by cell cultures of Safflower (Carthamus tinctorius L.) in a Bioreactor [J]. Plant Cell Tiss Organ Culture, 2000, 60: 95-100.
[29]王军妮,黄艳红,牟志美,等.植物次生代謝物黄酮类化合物的研究进展[J].蚕业科学,2007(3):499-505.
WANG J N,HUANG Y H,MOU Z M,et al.Research progress on flavonoid of the plant secondary metabolites[J].Canye Kexue,2007,(3):499-505.(in Chinese)
[30]李琳玲,程华,程水源,等.银杏查尔酮合成酶基因启动子(GbCHSP)调控元件及功能分析[J].园艺学报,2010,37(12):1919-1928.
LI L L,CHENG H,CHEN S Y,et al.Regulatory elements and functional analysis of chalcone synthase gene promoter from Ginkgo biloba L[J].Acta Horticulturae Sinica,2010,37(12):1919-1928.(in Chinese)
(责任编辑:张 梅)
