转C0030.2.5基因玉米对大鼠的亚慢性毒性研究
2019-09-10王睿张艳红胡贻椿李敏吴景欢杨晓光毛德倩
王睿 张艳红 胡贻椿 李敏 吴景欢 杨晓光 毛德倩
摘 要:目的:研究喂飼转C0030.2.5基因玉米对大鼠的亚慢性毒性。方法:选用断乳SD大鼠140只,随机分为7组,即3个转基因组(72.70%、36.35%、18.18%)、3个亲本玉米组(72.7%、35.35%、18.18%)、1个常规基础饲料对照组,每组20只,雌雄各半。动物2只/笼喂养,自由进食饮水,连续观察90d。观察大鼠体重、进食量、血液学指标、血生化指标,实验结束后摘取动物脏器进行病理组织学检查。结果:各剂量组动物的体重均呈增长趋势,体重增长正常,中、末期的血液学和血生化指标中个别指标虽有统计学差异,但并无生物学意义。各主要脏器系数及病理组织学检查比较,均未发现有生物学意义的改变。结论:现有实验结果不能证实该转C0030.2.5基因玉米对大鼠有亚慢性毒性作用。
关键词:转基因玉米;C0030.2.5基因;亚慢性毒性
转基因玉米利用转基因方法可以显著提高玉米抗虫、抗除草剂的品质,具有重要的经济效益,但这种技术是否会对人体带来危害,是社会关注的热点问题[1-4]。本研究依据“实质等同性”原则[5],按照中华人民共和国农业行业标准(NY/T 1102—2006)《转基因植物及其产品食用安全检测—大鼠90d喂养实验》[6],对转C0030.2.5基因玉米进行了大鼠90d喂养实验,了解分析该转基因玉米是否会对大鼠产生亚慢性毒性作用,为该转基因玉米的食用饲用性安全提供科学依据。
1 材料与方法
1.1 样品
转C0030.2.5基因玉米(以下简称转基因玉米)、转化受体DBN567(以下简称亲本玉米)、常规基础饲料AIN-93G(以下简称对照玉米),均为黄色籽粒;C0030.2.5、DBN567,由北京大北农生物技术有限公司提供,经产品检测后开展本次实验。
1.2 材料与主要仪器
L535R湘仪低速冷冻离心机、BS-220型全自动生化分析仪、BC-5000VET全自动五分类血液分析仪、Leica HI1220烘片机、Leica RM2016轮转式切片机、Leica HI1210摊片机、Leica EG1150H型石蜡包埋机。血细胞稀释液及溶血剂,深圳迈瑞生物医疗电子股份有限公司;血生化检测试剂盒,深圳迈瑞生物医疗电子股份有限公司、重庆中元生物技术有限公司。
1.3 实验动物和饲养条件
选用北京维通利华实验动物技术有限公司提供的健康SD大鼠(SPF级,许可证号:SCXK(京)2012—0001)。饲养地点:汇智泰康生物技术(北京)有限公司,级别:屏障环境,许可证号:SYXK(京)2014—0022。
1.4 饲料配制
实验开始前在北京市营养源研究所对各种玉米的营养成分进行全面检测,参照美国营养研究所的AIN-93G配方,在保证营养平衡的基础上计算转基因玉米能掺入饲料的最大比例。经计算得出各玉米在饲料中的最大掺入量为72.70%,以此作为高剂量,中、低剂量的玉米掺入量分别设为35.35%、18.18%。以上饲料由北京华阜康生物科技股份有限公司制备。配制好的饲料辐照灭菌后真空包装保存供实验使用。
1.5 实验方法
选用断乳SD大鼠140只,随机分为7组,即C0030.2.5低、中、高剂量组(以下简称转低、转中、转高),转化受体玉米DBN567低、中、高剂量组(以下简称亲低、亲中、亲高),AIN-93G(以下简称对照组)。每组20只,雌雄各半。动物2只/笼喂养,自由饮食,每周称量1次大鼠体重,每周记录1次给食量和剩食量,连续观察90d。各组于实验中期和末期分别采血测定各项血液学、血生化指标,实验结束后摘取动物脏器进行病理组织学检查。
1.6 观察指标
1.6.1 动物的一般表现、体重、食物利用率 每周称量1次大鼠体重,记录1次给食量和剩食量。计算食物利用率:
食物利用率=实验期内动物体重增加(g)/实验期内动物总进食量(g)×100%(1)
1.6.2 血液学检查 分别于实验中期和末期对实验动物血液中红细胞(RBC)数、血红蛋白(Hb)量、血小板(PLT)数、白细胞(WBC)数及其分类(中性、淋巴、单核)进行血液学指标测定。实验中期大鼠眼内眦取血,实验结束大鼠戊巴比妥钠腹腔注射麻醉,腹主动脉采血。
1.6.3 临床生化学检查 实验中期和末期动物空腹采血进行血液生化指标测定。测定指标为总蛋白(TP)、白蛋白(ALB)、血糖(GLU)、尿素氮(UREA)、肌酐(CREA)、胆固醇(TC)、甘油三酯(TG)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)、碱性磷酸酶(ALP)。
1.6.4 脏体比 实验结束处死动物取肝、肾、肾上腺、脾、胸腺、心脏、睾丸称重,计算相应的脏体比(以百克体重计算)。
1.6.5 病理组织学 解剖进行大体观察及组织病理学检查。组织病理学检查组分别为C0030.2.5高剂量组、对照玉米DBN567高剂量组、AIN-93G,检查组织有脑、心脏、肺、肝、肾、肾上腺、脾、胃肠(十二指肠、空肠和回肠)、胸腺、甲状腺、睾丸、附睾、前列腺、卵巢和子宫。
1.7 统计方法
转C0030.2.5基因玉米低、中、高剂量组与相应剂量的转化受体DBN567组和AIN-93G对照组比较,采用SPSS统计软件进行单因素方差分析(ANOVA),方差齐时采用Bonferroni检验,方差不齐采用Games-Howell检验。以P<0.05为差异有统计学意义。
2 结果与分析
2.1 生长状况及食物利用率
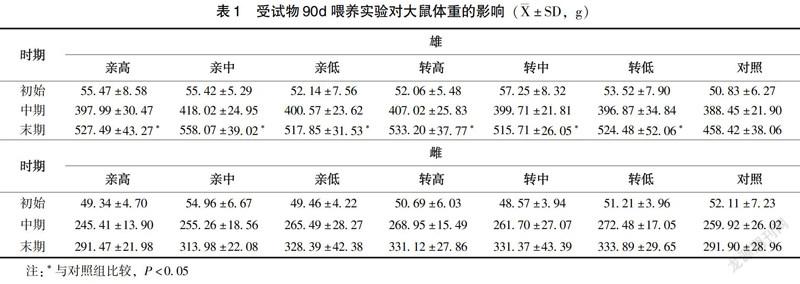
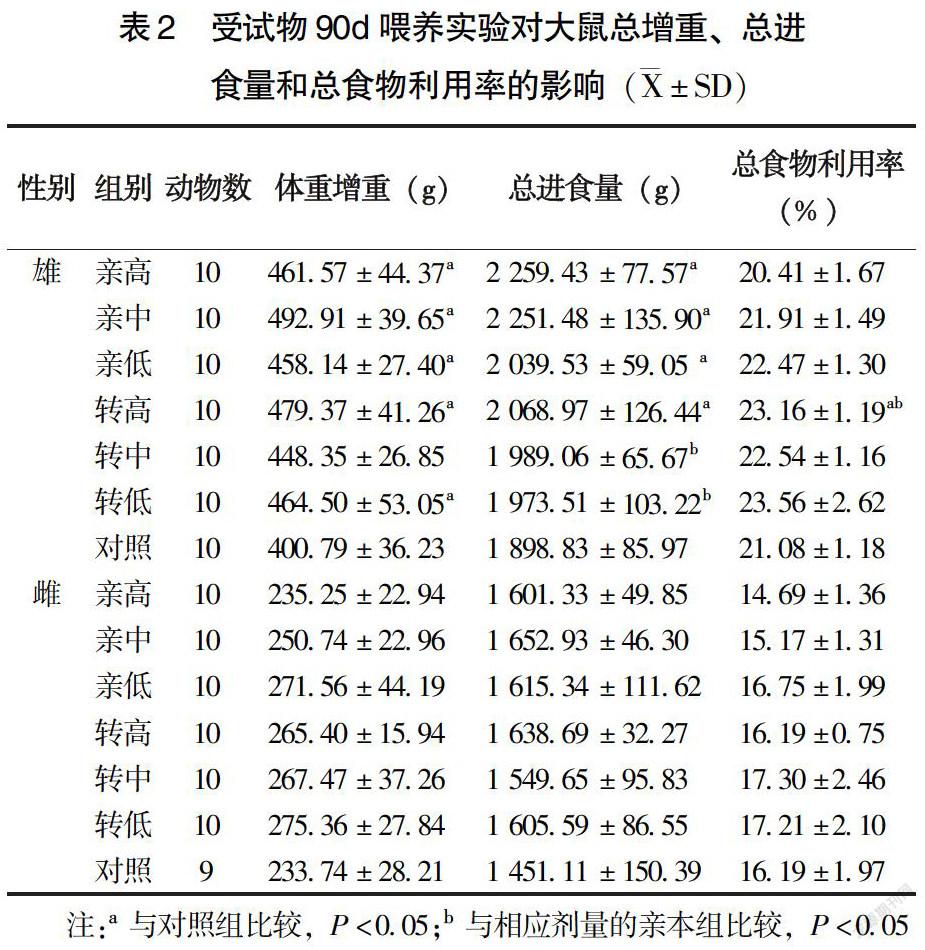
对照组中有1只雌性动物在第9周意外死亡,大体解剖脏器未见异常,该组其他动物以及其余各组动物在整个实验期间活动、生长正常,被毛浓密有光泽。雄、雌性大鼠C0030.2.5各剂量组与相应剂量的亲本玉米DBN567组相比较,体重未见显著差异(表1)。雄性大鼠转中、转低组总进食量低于相应剂量的亲本组(P<0.05),雄性大鼠转高组总食物利用率高于亲高组(P<0.05),其余各剂量组雌、雄动物的总增重、总进食量以及总食物利用率未见显著差异(P>0.05)(表2)。与对照组相比,雄性大鼠转高、转中、转低组和亲高、亲中、亲低组体重(表1)均有显著性增加(P<0.05),尤其在实验末期。雄性大鼠转高组总食物利用率高于对照组(P<0.05)(表2),雄性大鼠3个亲本组及转高组体重增重和总进食量、转低组体重增重、转高组总食物利用率均高于对照组(P<0.05)。其余各雌、雄大鼠体重增重、总进食量、总食物利用率在各玉米掺饲剂量组和对照组之间未见显著差异(P>0.05)(表2)。
2.2 血液学指标
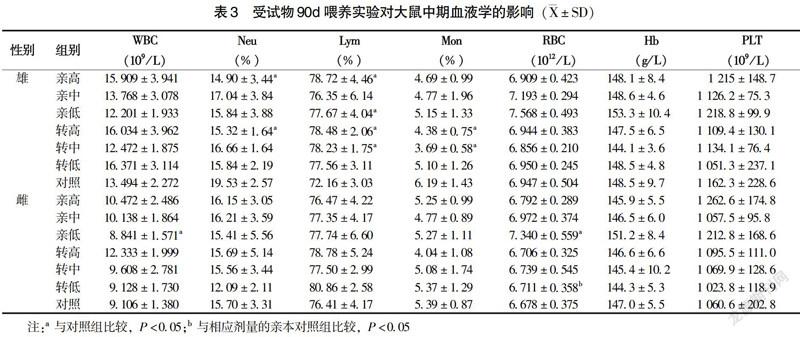
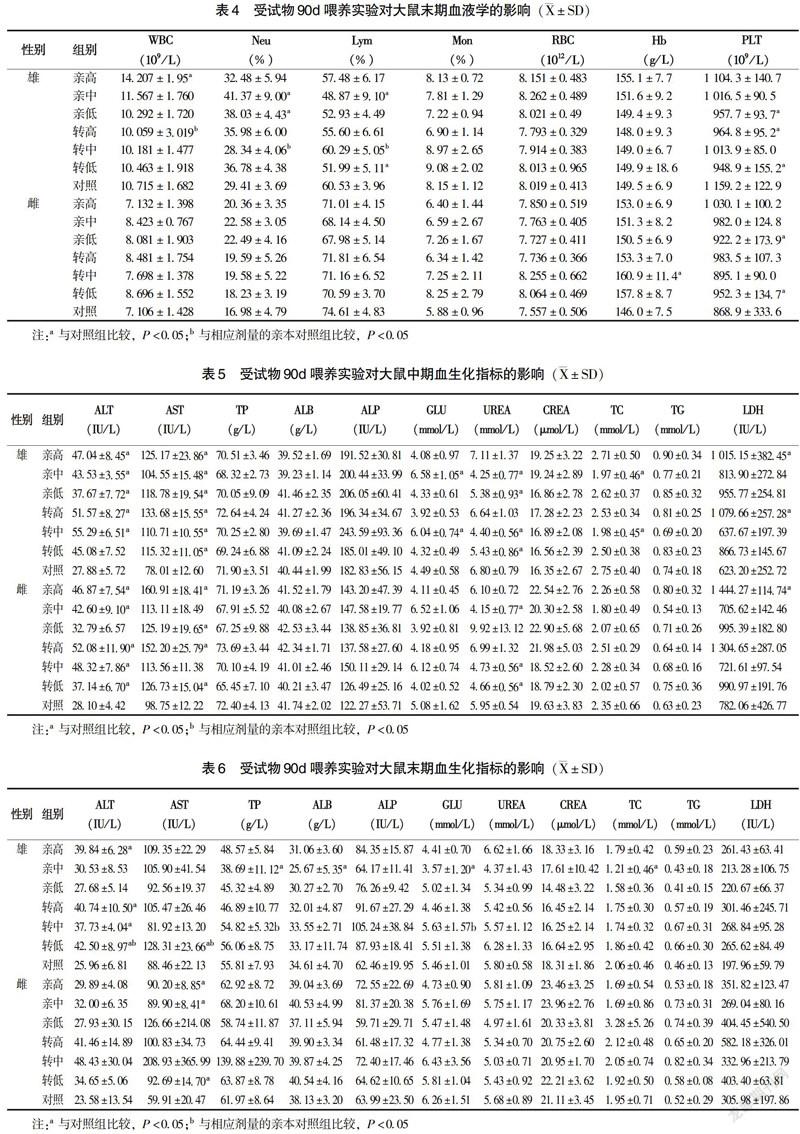
实验中期,雄性大鼠亲高组、转高组中性粒细胞显著降低(P<0.05);亲高组、亲低组、转高组、转中组淋巴细胞水平显著增高(P<0.05);转高组、转中组单核细胞百分比显著降低(P<0.05)。在雌性大鼠中,亲低组RBC水平显著升高而WBC水平显著降低(P<0.05),转低组RBC与亲本组比较显著降低(P<0.05)(表3)。实验末期,亲高组1只雌性大鼠、转高组2只雄性大鼠样本出现凝血,对照组中1只雌性大鼠在第9周意外死亡,检测结果未纳入数据统计。与相应剂量的亲本组比较,雄性大鼠转高组WBC、转中组中性粒细胞及淋巴细胞水平显著降低(P<0.05);与对照组相比,雄性大鼠亲高组WBC水平显著升高,亲中组、亲低组中性粒细胞显著升高,亲中组、转低组淋巴细胞水平显著降低,亲低组、转高组、转低组PLT数显著降低(P<0.05);雌性大鼠转中组血红蛋白显著升高,亲低组、转低组PLT数显著升高(P<0.05)(表4)。由表3~4可见,实验中期或末期有个别指标出现统计学差异,或尽在实验中期出现,或未呈现剂量—反应关系,且均在该品系动物正常值范围内[7-8],认为无生物学意义。其余各组各指标与对照组相比,差异均无统计学意义(P>0.05),转基因其余各组各项指标与其相应剂量的亲本对照组比较,差异均无统计学意义(P>0.05)。
2.3 血生化指标
实验中期,与对照组相比,雄性大鼠3个亲本组、转高组、转中组ALT水平显著升高(P<0.05);转基因玉米各剂量组、亲本各剂量组AST水平显著增高(P<0.05);亲中组、转中组GLU水平显著升高、TC水平显著降低(P<0.05);亲中组、转中组、转低组UREA水平显著降低(P<0.05);亲高组、转高组LDH水平显著增高(P<0.05)。在雌性大鼠中,亲高组、亲中组、转基因玉米各剂量组ALT水平显著升高(P<0.05);親高组、亲低组、转高组、转低组AST水平显著增高(P<0.05);亲中组、转中组、转低组UREA水平显著降低(P<0.05);亲高组LDH水平显著增高(P<0.05)(表5)。实验末期,与相应剂量的亲本组比较,雄性大鼠转低组ALT、AST水平和转中组TP、GLU水平显著升高(P<0.05)。与对照组相比,雄性大鼠亲高组、转基因玉米各剂量组ALT水平显著升高(P<0.05);转低组AST水平显著增高(P<0.05);亲中组TP、ALB、GLU水平显著降低(P<0.05)。在雌性大鼠中,亲高组、亲中组、转低组AST水平显著增高(P<0.05)(表6)。由表5~6可见,实验中期与末期转基因组和亲本组有个别指标与对照组差异有统计学意义,但无剂量-反应关系且变化均在该品系动物正常值范围内[8-10],认为无生物学意义。其余各组各指标与对照组相比,差异均无统计学意义(P>0.05),转基因其余各组各项指标与其相应剂量的亲本对照组比较,差异均无统计学意义(P>0.05)。
2.4 大鼠脏体比
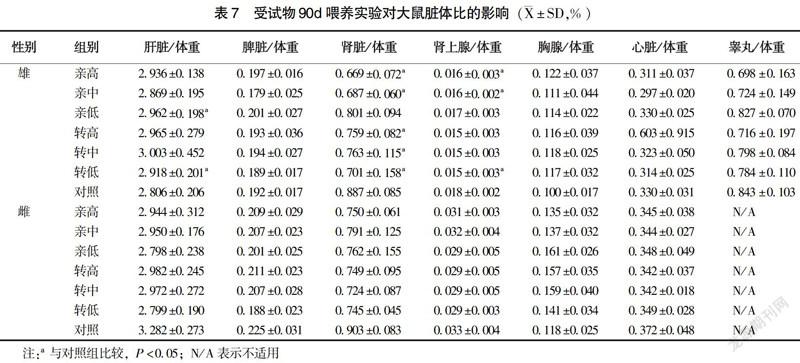
实验末期对各剂量组的脏器重量称重,并计算脏体比。雄性大鼠亲低组、转低组肝脏脏体比显著升高(P<0.05),亲高、转基因玉米各剂量组的肾脏脏体比显著降低(P<0.05),亲高组、亲中组、转低组肾上腺脏体比显著降低(P<0.05),其余各组大鼠脏体比与对照组相比,差异均无统计学意义(P>0.05)。转基因各剂量组脏体比与相应亲本组相比,差异均无统计学意义(P>0.05)(表7)。
2.5 大体病理及组织学检查
各组大鼠外观、皮肤未见异常,胸、腹腔膜未见出血点、积液,主要脏器正常,未见明显病理病变。对转基因玉米、亲本玉米以及AIN-93G对照组SD大鼠脑、心、肺、肾、肝、肾上腺、脾、胃肠(十二指肠、空肠和回肠)、胸腺、甲状腺、睾丸、附睾、前列腺、卵巢及子宫进行了病理组织学检查,未见与受试物有关的特异性毒性病理改变。
3 讨论
本研究将转基因玉米及其亲本对照分别掺入饲料给予大鼠90d,结果发现,雄性、雌性大鼠转基因玉米各剂量组与相应剂量的亲本对照玉米组相比较,体重、体重增长、周摄食量、对周食物利用度虽有个别统计学意义上的显著性差异,但在历史对照数据范围内,且总体重增加、总进食量和总食物利用率未见显著差异。实验中期和末期各项血液学指标和血生化指标结果显示,转基因玉米各剂量组与相应剂量的亲本对照玉米组相比较,有个别指标有统计学差异,但大部分有差异的指标没有同时与2个对照组都存在差异或没有同时在雌雄大鼠中存在差异,且基本上都在文献报道的正常范围之内[5-10],且未出现剂量-效应关系。
脏器重量变化可转基因玉米各剂量组与其相应剂量的亲本对照相比较,脏器重量和脏体比均无显著性差异(P>0.05)。实验末期对7组SD大鼠脑、心、肺、肾、肝、肾上腺、脾、胃肠(十二指肠、空肠和回肠)、胸腺、甲状腺、睾丸、附睾、前列腺、卵巢及子宫进行了病理组织学检查,未见与受试物有关的特异性毒性病理改变。此外,动物实验中会受转基因食品特性外的一些不确定因素的影响[11],因此认为这些差异有可能与大鼠个体差异有关,而不应认为指标升高是因饲喂转基因饲料造成的。
综上所述,本实验结果未发现具有对大鼠有生物学意义的亚慢性毒性作用。本研究还将开展急性毒性实验、多代繁殖实验、营养功效等研究,以更好地评价该转基因玉米的食用安全性。
参考文献
[1]郭红卫.转基因食品的安全性评价概况[J].上海预防医学杂志,2001,13(4):153-155.
[2]农业部.农业转基因生物安全评价指南[S].2006:6.
[3]张力,程呈,何宁,等.转基因高油酸大豆对大鼠的亚慢性毒性研究[J].毒理学杂志,2011,25(5):391-394.
[4]张力,王静,姜淑卿,等.转Cry1Ab/Cry2Aj 和G10evo(EPSPS)基因抗虫耐草甘膦玉米对大鼠的亚慢性毒性研究[J].环境与健康杂志,2016,33(7):585-589.
[5]WHO.Application of the principles of substantial equivalence to the safety evaluation of food components from plants derived by modern biotechnolog[R].Geneva:WHO,1995:11.
[6]中华人民共和国农业行业标准,转基因植物及其产品食用安全检测——大鼠90d喂养实验[S].北京:中华人民共和国农业部,2006.
[7]田辉,樊柏林.SPF级Wistar大鼠血液学及生化指标正常值范围探讨[J].实验动物科学,2007,24(2):23-24.
[8]蒋中仁,徐薇,金伟,等.SD大鼠血液学指标、血生化指标及脏体比正常值范围探讨[J].预防医学情报杂志,2011,27(10):789-791.
[9]齐云,蔡润兰,刘彬,等.新药长毒试验动物血液生化测定规范化研究系列之五[J].中国比较医学杂志,2006,16(4):193-196.
[10]朱华,高虹,黄澜,等.清洁级SD大鼠标准生物学指标的建立[J].医学动物防制,2005,21(9):629-633.
(责任编辑 唐建敏)
