山羊伪结核棒状杆菌的分离鉴定及耐药性分析
2019-09-10黄丽丽林裕胜江锦秀张靖鹏游伟肖义军胡奇林
黄丽丽 林裕胜 江锦秀 张靖鹏 游伟 肖义军 胡奇林



摘 要:【目的】分離、鉴定福建省某养殖场病死山羊的病原,明确山羊病死原因,为山羊伪结核棒状杆菌病的防治提供科学依据。【方法】以无菌采集的病羊肺脏为材料,进行细菌分离纯化,鉴定分离菌株的形态特征及培养特性;提取菌株DNA,利用特异性引物和16S rRNA通用引物进行PCR,16S rRNA扩增片段送公司进行克隆测序并对序列进行分析;并进行生化、药敏和动物攻毒试验。【结果】该分离菌株在含10%脱纤维绵羊血的琼脂培养基上,生长成直径1 mm左右、中央凸起、乳白色、边缘不整齐、伴有β溶血环的菌落,在营养琼脂培养基上生长不良,在麦康凯琼脂培养基上不能生长。16S rRNA测序结果经NCBI在线软件Blast后显示与GenBank上的伪结核棒状杆菌的同源性高达100%;山羊伪结核棒状杆菌特异性PCR有目的扩增条带;生化试验结果与伯杰氏细菌鉴定手册中伪结核棒状杆菌相符,表明分离菌为山羊伪结核棒状杆菌,命名为FJ-PN。小鼠攻毒试验结果显示,小鼠腹腔与皮下注射0.3 mL含量为4×105CFU·mL-1的分离菌,在40 h内全部死亡;山羊攻毒试验结果显示,山羊经皮下注射2 mL、鼻腔接种1 mL含量为4×105CFU·mL-1的分离菌3 d后死亡。药敏试验结果显示该菌对克拉霉素、环丙沙星、青霉素、四环素、左氟沙星、氧氟沙星、庆大霉素高度敏感,对红霉素、氯霉素、氨苄西林、头孢噻肟、头孢西丁、利福平低度敏感,对链霉素、甲氧苄啶表现耐药。【结论】本研究分离到的1株细菌为山羊伪结核棒状杆菌,具有较强的致病性,且对抗生素表现出一定的耐药性,为该病的诊断和合理用药提供了理论支持。
关键词:伪结核棒状杆菌;山羊;耐药性;分离;鉴定
中图分类号:S 855.1+2文献标识码:A文章编号:1008-0384(2019)08-925-08
Abstract:【Objective】To identify the pathogen that caused the death of goats in a farm in Fujian for prevention and treatment of Pseudotuberculosis. 【Method】Aseptically collected specimens of lung tissues from the dead goats were used to isolate the microbes for morphological observation and strain identification. DNA of the isolates were extracted, and the specific and 16S rRNA universal primers selected for PCR. The 16S rRNA amplified fragment was cloned, sequenced and analyzed. Biochemical, drug sensitivity, and animal challenge tests were performed on the isolate for taxonomic identification. 【Results】The isolated strain was cultured on an agar medium containing 10% defibrated sheep blood to grow into a colony with a diameter of about 1 mm, a central bulge, a milky white color, an irregular edge, and a beta hemolysis ring. It did not grow well on a nutrient agar nor a MacConkey agar medium. The 16S rRNA sequencing showed an up to 100% homology with Corynebacterium pseudotuberculosis on GenBank by the NCBI online software Blast. Like the specific PCR of C.pseudotuberculosis, that of the isolate also had the same amplified targeted bands. In addition, the biochemical test on the isolate duplicated the characteristics of C. pseudotuberculosis shown in the Berger's Bacterial Identification Manual. Hence, the isolated pathogen named as FJ-PN was verified to be C. pseudotuberculosis. A challenge test on mice with an intraperitoneal or subcutaneous injection of 0.3 mL of 4×105 CFU·mL-1 of the isolate died within 40 h. Furthermore, two goats injected subcutaneously with 2 mL of 4×105 CFU·mL-1 and intranasal inoculated simultaneously with 1 mL of 4×105 CFU·mL-1 of the isolate died within 72 h. The drug sensitivity test showed that the strain was highly sensitive to clarithromycin, ciprofloxacin, penicillin, tetracycline, levofloxacin, ofloxacin, and gentamicin, slightly sensitive to erythromycin, chloramphenicol, ampicillin, cefotaxime, cefoxitin, and rifampicin, and resistant to streptomycin or trimethoprim. 【Conclusion】The pathogenic bacteria isolated from the diseased goats was identified as C. pseudotuberculosis. It had a strong pathogenicity with varying degrees of drug resistance to antibiotics.
Key words:Corynebacterium pseudotuberculosis; goat; antibiotics resistance;isolation; identification
0 引言
【研究意义】羊伪结核棒状杆菌病Pseudotuberculosis是由伪结核棒状杆菌(Corynebacterium pseudotuberculosis,CP)引起的人和多种动物共患的一种接触性慢性细菌性传染病[1],其临床特征主要表现为浅表淋巴结肿大,呈脓性干酪样坏死,部分羊只组织脏器内出现干酪样脓肿,故该病也称为干酪样淋巴结炎 (Caseouslymphadenitis,CLA)[2]。该病的发病率一般在8.36%~30%[3-4],一年四季均可发病[5],且患病率随年龄增大而升高[6]。该病主要发生于绵羊和山羊,此外,该菌也可感染骆驼、马、牛、兔等多种动物[7-8]。其感染途径主要是体内外创伤引起,也可通过破损的皮肤、污染的饲料及破溃的脓汁在羊群中直接接触传播,此外,该病也可经呼吸道、消化道或吸血昆虫传播[9]。由于该病发病缓慢且致死率低,难以引起养殖户重视,而该病一旦侵入羊群则很难彻底清除,是当今世界公认的难以防治的传染病之一,世界上几乎所有养羊的国家或地区甚至大部分羊场都有该病存在[10]。【前人研究进展】伪结核棒状杆菌隶属棒状杆菌属,放射菌科,兼性胞内寄生,为革兰氏阳性菌[11],该菌能够产生坏死性、溶血性外毒素,其成分以磷脂酶为主[5]。1888年EDWARD从奶牛的淋巴管炎中首次分离出伪结核棒状杆菌[12],1891年Preisz 和Guinard从羊的肾脏脓肿中再次分离到[13],此后,一些学者相继从马、骆驼、羊和人的病变材料中分离到[14-18]。1956年我国在羊结核结节中分离到该菌[19]。1989年,Zhao等成功研制出该菌分离用选择培养基, 并用该培养基分离到伪结核棒状杆菌[18,20]。至今,该菌能从羊鼻腔、咽腔及羊体内外生长脓疱处分离得到。由其引起的羊伪结核棒状杆菌病在世界范围内广泛流行,我国内蒙古、陕西、甘肃、新疆、云南和广东等[18,21]地区均有该病发生的报道,给养羊业的发展造成极大损失,已引起广大学者的关注[22-23],各个国家都对该病的防治和检测都非常重视,因此被农业部列为三类动物疫病[24]。羊伪结核棒状杆菌病根据其病变类型分为体表型和内脏型,有时两种类型可以同时见于同一只病羊。目前,该病的诊断方法主要有血清学诊断和细菌分离鉴定,血清学诊断方法以酶联免疫吸附试验 (ELISA)为主,王韡等[7]、霍宁宁等[11]和王璇等[25]通过ELISA 法诊断;郑敏等[26]、韦志锋等[27]、朱伟英等[28]通过分离羊伪结核棒状杆菌并鉴定来诊断该病。【本研究切入点】从病羊皮肤脓肿中分离出伪结核棒状杆菌的报道较多,然而国内尚未有从肺脏脓肿中分离出该菌的报道。本研究从福建省某羊场病死山羊的肺脏脓肿中分离出1株细菌,疑似山羊伪结核棒状杆菌。【拟解决的关键问题】为了明确该分离菌株的分类地位、致病性及药物敏感性,本研究对分离菌株进行了系统鉴定、致病性和药物敏感性试验,为福建省山羊伪结核棒状杆菌病的诊断和合理用药提供理论依据。
1 材料与方法
1.1 病料来源与采集
福建省屏南县某山羊养殖场某栋羊舍约有10%山羊出现皮肤脓肿、部分病羊脓肿处流出浓汁,病羊精神较差、食欲降低,2019年3月23日, 1头山羊出现急性死亡。对送检病死羊进行剖检,可见肺脏肿大、有脓肿、出血,心脏、脾脏、肝脏、肾脏未见明显病变。无菌采取病变肺组织,4~8℃保存备用。
1.2 相关试剂及动物来源
Premix-Taq酶、DNA Marker等购自TaKaRa公司;微生物药敏试纸购自温州市康泰生物科技有限公司;营养琼脂培养基、麦康凯琼脂培养基、生化鉴定管购自青岛高科技工业园海博生物技术有限公司;Ezup柱式动物基因组DNA抽提试剂盒、血液琼脂培养基、LB培养基等购自生工生物工程(上海)股份有限公司; 試验用Balb/c小白鼠购自福州吴氏实验动物贸易有限公司;试验用山羊购自无伪结核棒状杆菌感染羊场。
1.3 细菌的分离培养
无菌挑取肺脏脓肿处组织划线接种于血琼脂平板上,37℃培养24 h后再挑取单个的溶血菌落接种到含10%胎牛血清的LB肉汤培养基上进行培养。将培养后的菌液稀释后再次接种于血琼脂平板上,挑取单个的菌落接种到含有10%胎牛血清的LB肉汤培养基上进行增菌培养。
1.4 引物设计
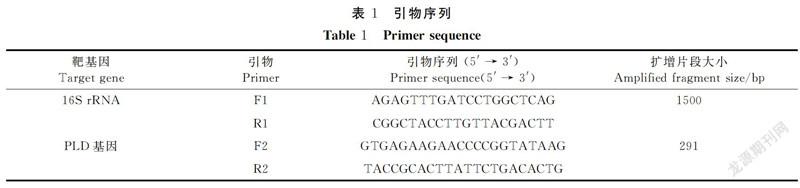
细菌16S rRNA通用引物参照Weisburg等[29]设计合成,山羊伪结核棒状杆菌磷脂酶D (phospholipase D,PLD)基因特异性引物参照许国洋等[30]设计合成,引物由铂尚生物技术(上海)有限公司合成,其序列见表1。
1.5 细菌的形态观察
挑取纯化后接种血琼脂平板上的单个菌落,进行革兰氏染色、镜检以及细菌形态观察。
1.6 16S rRNA序列分析和特异性PCR鉴定
取纯化培养后菌液200 μL,使用生工生物工程(上海)股份有限公司生产的动物基因组DNA提取试剂盒抽提DNA。以抽提后的DNA为模板进行16S rRNA 基因的PCR扩增,扩增体系为:Premix-Taq酶20 μL,16S rRNA上、下游引物(10 μmol·L-1)各2 μL,DNA模板6 μL,ddH2O补足40 μL,PCR程序为:95℃预变性5 min;95℃变性45 s,52℃退火30 s,72℃延伸1 min,30个循环;72℃终延伸10 min,4℃保存。将PCR扩增产物送铂尚生物技术(上海)有限公司进行克隆测序,获得的序列与GenBank中细菌16S rRNA 基因序列进行比较。山羊伪结核棒状杆菌特异性PCR鉴定,20 μL反应体系:Premix-Taq酶10 μL,上、下游引物(10 μmol·L-1)各1 μL,DNA模板3 μL,ddH2O 5 μL,PCR反应条件:94℃预变性5 min;95℃变性45 s,55℃退火45 s,72℃延伸45 s,30个循环;72℃终延伸 10 min。反应结束后取5.0 μL PCR扩增产物在1%琼脂糖凝胶上电泳检测,凝胶成像仪拍照分析。
1.7 生化试验
取处于指数生长期的分离菌按照青岛高科技工业园海博生物技术有限公司生化反应试剂盒说明书进行操作,操作后的生化管置于37℃恒温培养箱中培养24~48 h,观察其生化特性。
1.8 药敏试验
取处于对数生长期的分离菌悬液0.2 mL均匀涂布在血琼脂平板上,涂布好的血琼脂平板静置片刻,将药敏试纸片放置在平板上并用镊子轻压以防脱落,37℃倒置培养24 h,测量抑菌圈(含药敏纸片)的大小,每种药片作3次重复,取平均值为抑菌圈直径(mm)。按照温州市康泰生物科技有限公司提供的生物药敏试纸说明书,判定分离菌株对抗生素的敏感(S)、中介(I)及耐药(R)性。
1.9 动物攻毒试验
1.9.1 小鼠攻毒试验
取14只Balb/c小鼠,随机分成3组,攻毒组2组,每组5只,空白组4只。攻毒组分别进行皮下和腹腔注射接种,每只小鼠接种0.3 mL含量为4×105 CFU·mL-1的分离菌,空白对照组腹腔和皮下各注射0. 3 mL PBS。接种后观察临床症状及死亡情况等。同时分别取皮下注射组与腹腔注射组小鼠的肝脏、脾脏及皮下脓肿物再进行细菌分离鉴定。
1.9.2 山羊攻毒试验
取3月龄健康山羊3只,2只皮下接种2 mL含量为4×105 CFU·mL-1的分离菌,同时经鼻腔接种1 mL含量为4×105CFU·mL-1的分离菌,另1只皮下和鼻腔分别接种2 mL和1 mL生理盐水作为空白对照。接种后观察临床症状及死亡情况等。试验结束后采集攻毒山羊的肾脏、肝脏及肺脏再进行细菌分离鉴定。
2 结果与分析
2.1 细菌的分离培养
无菌挑取病死羊肺脏脓肿处组织,接种在血琼脂平板上,在37℃培养箱中培养24 h后可见平板上长出针尖大小的菌落,不透明,呈乳白色,菌落周围有狭窄的β型溶血环,随着培养时间延长菌落变为灰白色,光滑,半透明,且有明显的溶血现象。在普通琼脂培养基上生长不良,在麦康凯琼脂培养基上不能生长。
2.2 细菌染色特性
对分离的细菌进行涂片染色、镜检,可见革兰氏阳性短球杆菌,菌体两端钝圆且着色较深,菌体单个、散在排列。
2.3 分离菌16S rRNA 基因序列鉴定及特异性PCR鉴定
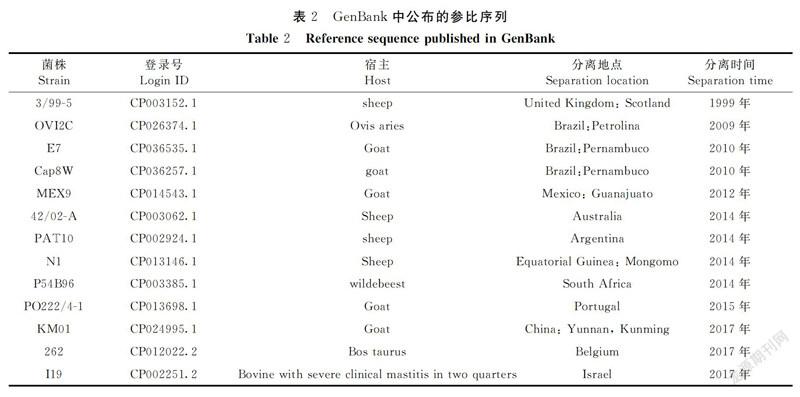
通过对分离菌株16S rRNA进行PCR扩增,经1%琼脂糖凝胶电泳后可见1条目的片段,其大小为1 500 bp左右,与预期目的片段大小相符(图略)。克隆测序结果显示,所扩增的片段大小为1 512 bp;与GenBank中收录的CP003152.1、CP026374.1、CP036535.1、CP036257.1、CP014543.1、CP003062.1、CP002924.1、CP013146.1、CP003385.1、CP013698.1、CP024995.1、CP012022.2、CP002251.2等(表2)山羊伪结核棒状杆菌的16S rRNA同源性高达100%。遗传进化树结果显示(图1),分离菌与山羊伪结核棒状杆菌在同一分支上,表明该分离菌为山羊伪结核棒状杆菌,命名为FJ-PN。同时用伪结核棒状杆菌特异性引物进行PCR验证,结果如图2所示,在290 bp左右有一条带,与预测值相符,证实分离菌为山羊伪结核棒状杆菌。
2.4 生化试验
将分离的山羊伪结核棒状杆菌接种到微量生化管中,在37℃培养24~48 h后观察,结果显示,该分离菌能够分解尿素酶、苯丙氨酸脱羧酶,不能分解3%氯化钠氨基酸脱羧酶、赖氨酸脱羧酶、氨基酸脱羧酶、鸟氨酸脱羧酶;能发酵1%NaCl甘露糖和1%NaCl乳糖,不能发酵核糖醇、肌醇、甘露醇、蜜二糖、棉子糖;10%NaCl胰胨水、半固體琼脂、氰化钾试验均呈阳性,硫化氢、西蒙氏枸橼酸盐和MR-VP试验均呈阴性。其生化特性与《伯杰细菌鉴定手册》[31]中的伪结核棒状杆菌的生化特性相符。
2.5 山羊伪结核棒状杆菌分离株的药敏试验
将涂布菌液且贴有药敏片的血琼脂平板37℃培养24 h 进行观察,结果显示该分离菌对克拉霉素、环丙沙星、青霉素、四环素、左氟沙星、氧氟沙星、庆大霉素高度敏感,对红霉素、氯霉素、氨苄西林、头孢噻肟、头孢西丁、利福平低度敏感,对链霉素、甲氧苄啶耐药。
2.6 小鼠攻毒试验
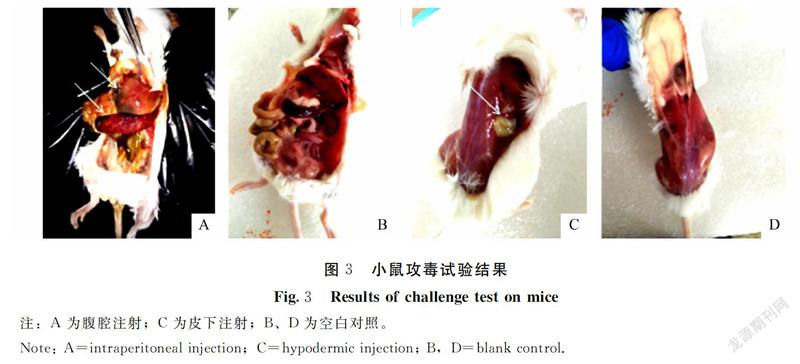
小鼠在经过腹腔注射0.3 mL含量为4×105CFU·mL-1的山羊伪结核棒状杆菌后,16 h攻毒小鼠出现精神不佳、活力下降、背部毛蓬松竖起等症状,24 h 3只小鼠死亡,其余2只萎靡不振,32 h后攻毒小鼠全部死亡。皮下注射组攻毒后20 h小鼠精神不佳,24 h有 1只小鼠死亡,其余4只活力下降、背部毛蓬松竖起,32 h 有4只小鼠死亡,余1只萎靡不振,40 h后全部小鼠死亡。空白对照组小鼠均正常。无菌剖检病死小鼠,发现腹腔注射攻毒小鼠肝脏和脾脏肿大、出血且切面有小白点,皮下注射攻毒小鼠的皮下有淡黄色针尖至粟粒大小的结核样脓肿,空白对照组小鼠均正常(图3)。从腹腔注射组小鼠的肝脏、脾脏以及皮下注射组小鼠的皮下脓肿物中再次分离到细菌,分别提取其DNA,用伪结核棒状杆菌特异性引物进行PCR鉴定,腹腔注射组和皮下注射组小鼠分离到的细菌均有特异性的扩增条带(图略)。
2.7 山羊攻毒试验
山羊经过皮下接种2 mL、鼻孔接种1 mL含量为4×105CFU·mL-1的山羊伪结核棒状杆菌后,20 h攻毒山羊出现精神不佳、活力降低等症状,48 h山羊表现出精神极度沉郁、采食量严重降低等症状,攻毒3 d后山羊死亡。剖检病死山羊,发现攻毒山羊皮下出血、肺部有纤维素粘连、腹腔出血、肾脏表面有出血点(图4)。从攻毒山羊肾脏、肝脏以及肺脏组织中再次分离到细菌,分别提取其DNA,用伪结核棒状杆菌特异性引物进行PCR鉴定,结果显示,肾脏、肝脏以及肺脏中分离到的细菌均有山羊伪结核棒状杆菌特异性的扩增条带(图略)。
3 讨论与结论
伪结核棒状杆菌引起的结核棒状杆菌病目前在世界范围内广泛流行,给养殖业带来巨大损失,已引起广大学者的关注[22-23]。
PCR作为快速检测技术,在病原鉴定中得到广泛应用,伪结核棒状杆菌的PCR鉴定中常以16S rRNA、rpoB和PLD基因作为靶基因进行检测[32]。郑敏等[26]、韦志锋等[27]、朱伟英等[28]和李基棕等[33]根据16S rRNA对分离的山羊伪结核棒状杆菌进行鉴定;许国洋等[30]根据伪结核棒状杆菌的磷脂酶D基因建立了山羊伪结核棒状杆菌PMA-PCR检测方法。因此,本研究通过细菌16S rRNA基因通用引物和针对伪结核棒状杆菌特异性PCR引物对分离菌进行鉴定,经16S rRNA克隆测序和伪结核棒状杆菌特异性PCR鉴定后,证实分离菌为山羊伪结核棒状杆菌。通过细菌形态观察及生化试验结果显示,该菌在血琼脂平板上呈现针尖大小的菌落,且有明显的溶血现象;该菌能够发酵1%NaCl甘露糖和1%NaCl乳糖,不能发酵核糖醇、肌醇、甘露醇、蜜二糖、棉子糖,这与郑敏等[26]、王志芳等[34]、李国平等[35]、朱伟英等[28]和李基棕等[33]报道的一致,符合伪结核棒状杆菌的生化特性。
动物攻毒试验结果显示,经腹腔注射和皮下注射2种方法接种的小鼠,在40 h内全部死亡;经皮下注射途径接种的山羊在攻毒3 d后死亡,剖检发现皮下出血、肺部有纤维素粘连、肾脏表面有出血点,从攻毒山羊肾脏、肝脏以及肺脏组织中再次分离到山羊伪结核棒状杆菌,证明本研究分离的山羊伪结核棒状杆菌具有较强的毒力。
羊伪结核棒状杆菌病目前尚未有商品化疫苗,因此临床上该病的发病率居高不下,发病羊只能通过抗生素进行治疗,但是最近的研究表明,伪结核棒状杆菌已对如复方新诺明、链霉素、呋喃妥因等药物产生了耐药性[33,36-37],因此通过药敏试验寻找高敏药物治疗该病是指导临床生产的重要手段之一。本研究的药敏试验结果显示,分离的山羊伪结核棒状杆菌对克拉霉素、环丙沙星、青霉素、四环素、左氟沙星、氧氟沙星、庆大霉素为高度敏感,对红霉素、氯霉素、氨苄西林、头孢噻肟、头孢西丁、利福平为低度敏感,对链霉素、甲氧苄啶表现耐药。该结果与潘淑惠等[38]、王璇等[10]、张梦思等[36]、吴浩阳等[37]研究结果一致,而与王志芳等[34]、韦志锋等[27]研究结果不一致,侧面反映了不同地区分离株的耐药性有所差异。
综上所述,本研究从福建省病死山羊肺脏中分离出1株山羊细菌,经系统鉴定证明该菌为山羊伪结核棒状杆菌,致病性试验结果显示分离的山羊伪结核棒状杆菌具有较强的毒力,药敏试验结果显示该菌对克拉霉素、环丙沙星等高度敏感,对红霉素、氯霉素等低度敏感,对链霉素、甲氧苄啶表现耐药,为该病的诊断和合理用药提供了科学依据。
參考文献:
[1]李文杨,刘远,张晓佩,等. 山羊伪结核棒状杆菌的分离鉴定[J]. 中国草食动物科学,2014,34(5):49-51.
LI W Y, LIU Y, ZHANG X P, et al. Isolation and identification of Corynebacterium pseudotuberculosis[J]. Chinese Herbivore Science, 2014, 34(5): 49-51.(in Chinese)
[2]BAIRD G J, FONTAINE M C. Corynebacterium pseudotuberculosis and its Role in Ovine Caseous Lymphadenitis[J]. Journal of Comparative Pathology, 2007, 137(4): 179-210.[3]周作勇,李和贤,杨浩钺,等.伪结核棒状杆菌毒力因子的研究进展[J].中国人兽共患病学报,2017,33(12):1115-1119.
ZHOU Z Y, LI H X, YANG H Y, et al. Advances in research on virulence factors of Corynebacterium pseudotuberculosis[J].Chinese Journal of Zoonoses,2017,33(12):1115-1119.(in Chinese)
[4]徐志豪,黄诗琴,李乡城,等.四川省山羊皮下脓肿的流行病学调查及病原体分析[J].中国兽医科学,2016,46(8):991-996.
XU Z H, HUANG S Q, LI X C, et al. Epidemiological investigation and pathogen analysis of subcutaneous abscess in goats in Sichuan Province[J].Chinese Journal of Veterinary Sciences,2016,46(8):991-996.(in Chinese)
[5]马玉馨,李文贵,郑国英,等. 山羊伪结核棒状杆菌TaqMan荧光定量PCR检测方法的建立和初步应用[J]. 畜牧与兽医,2018,50(10):82-87.
MA Y X, LI W G, ZHENG G Y, et al. Establishment and preliminary application of TaqMan fluorescent quantitative PCR assay for detection of Corynebacterium pseudotuberculosis[J]. Animal Husbandry and Veterinary Medicine, 2018, 50(10): 82-87.(in Chinese)
[6]趙宏坤,范伟兴,胡敬东,等. 羊伪结核病研究进展[J]. 中国预防兽医学报,2000(3):77-78.
ZHAO H K, FAN W X, HU J D, et al. Progress in research on pseudo-tuberculosis in sheep[J]. Chinese Journal of Preventive Veterinary Medicine, 2000(3): 77-78.(in Chinese)
[7]王韡,张彦明,邢福珊,等. 羊伪结核棒状杆菌的分离鉴定及ELISA检测方法的建立[ J]. 中国兽医学报,2005(1):34-36.
WANG W, ZHANG Y M, XING F S, et al. Isolation and identification of Corynebacterium pseudotuberculosis and establishment of ELISA method[J]. Chinese Veterinary Journal, 2005(1): 34-36.(in Chinese)
[8]DORELLA F A, PACHECO L G C, OLIVEIRA S C, et al. Corynebacterium pseudotuberculosis: Microbiology, biochemical properties, pathogenesis and molecular studies of virulence[J]. Veterinary Research, 2006, 37(2): 201-218.
[9]朱志雄,梁文娟. 浅谈山羊伪结核病的防治[J]. 广西畜牧兽医,2015,31(1):32,46.
ZHU Z X, LIANG W J. Discussion on prevention and treatment of goat pseudotuberculosis[J]. Guangxi Animal Husbandry and Veterinary Medicine, 2015, 31(1): 32,46.(in Chinese)
[10]王璇,潘淑惠,万一元. 山羊感染伪结核棒状杆菌病的诊断[J]. 贵州农业科学,2009,37(5):121-122.
WANG X, PAN S H, WAN Y Y. Diagnosis of Goat infection with Coryneform pseudotuberculosis bacteria[J]. Guizhou Agricultural Sciences, 2009, 37(5): 121-122.(in Chinese)
[11]霍宁宁, 朱伟英, 高洋,等. 羊伪结核抗体间接ELISA检测方法的建立[J]. 西北农林科技大学学报(自然科学版), 2016, 44(10):12-17.
HUO N N, ZHU W Y, GAO Y, et al. Establishment of indirect ELISA for detection of pseudotuberculosis antibodies in sheep[J]. Journal of Northwest A&F University(Natural Science Edition), 2016, 44(10): 12-17.(in Chinese)
[12]Institut Pasteur (Paris, France). Annales de l'Institut Pasteur[M]. Elsevier, 1986.
[13]HENDERSON A. Pseudotuberculous Adenitis Caused by Corynebacterium pseudotuberculosis[J]. Journal of Medical Microbiology, 1979, 12(1): 147-149.
[14]PUISSEGUR J A. Various considerations and experiences with Corynebacterium diphtheria ovis[J]. Rev Sanid Milit Argent, 1952: 234-243.
[15]ANDERSON D E, RINGS D M, KOWALSKI J. Infection with Corynebacterium pseudotuberculosis in five alpacas[J]. Journal of the American Veterinary Medical Association, 2004, 225(11): 1743-1747.
[16]STEHMAN, SUSAN M. Paratuberculosis in Small Ruminants, Deer, and South American Camelids[J]. Vet Clin North Am Food Anim Pract, 1996, 12(2): 441-455.
[17]MACLEAN P D, LIEBOW A A, ROSENBERG A A. Hemolytic Corynebacteriulvi Reselvibling Corynebacterium Ovis and Corynebacterium Pyogenes in Man[J]. Journal of Infectious Diseases, 1946, 79(1): 69-90.
[18]赵宏坤,周维武,吉增福,等. 由溶解的山羊胎儿分离出一株羊伪结核棒状杆菌[J]. 中国畜禽传染病,1994(2):31-32.
ZHAO H K, ZHOU W W, JI Z F, et al. A strain of Corynebacterium pseudotuberculosis isolated from a dissolved goat fetus[J]. Chinese Journal of Animal and Poultry Infectious Diseases, 1994 (2): 31-32.(in Chinese)
[19]王建辰. 133个结节的山羊假结核病一例报告[J]. 西北农学院学报,1958(3):113-116.
WANG J C.A report of 133 nodular goat pseudotuberculosis cases[J]. Journal of Northwest Agricultural University, 1958(3): 113-116.(in Chinese)
[20]ZHAO H K, HIRAMUNE T, KIKUCHI N, et al. Selective medium containing fosfomycin, nalidixic acid and culture supernatant of Rhodococcus equi for isolation of Corynebacterium pseudotuberculosis[J]. Zentralblatt Für Veterinrmedizin Reihe B. Journal of Veterinary Medicine, 2010, 38(10): 743-748.
[21]王全溪,李國平. 波尔山羊伪结核棒状杆菌的分离鉴定[J]. 中国兽医杂志,2004(9):53-54.
WANG Q X, LI G P. Isolation and Identification of Corynebacterium pneumoniae from Boer Goat[J]. Chinese Journal of Veterinary Medicine, 2004(9): 53-54.(in Chinese)
[22]郑国英,马玉馨,李太仙,等. 昆明市西山区山羊伪结核棒状杆菌的分离鉴定[J]. 动物医学进展,2017,38(9):32-37.
ZHENG G Y, MA Y X, LI T X, et al. Isolation and Identification of Corynebacterium pseudomonas from Goats in Xishan District, Kunming City[J]. Progress in Animal Medicine, 2017, 38(9): 32-37.(in Chinese)
[23]VALDIVIA J, REAL F, ACOSTA F, et al. Interaction of Corynebacterium pseudotuberculosis with ovine cells in vitro[J]. Veterinary Pathology, 2013, 50(2): 318-323.
[24]一、二、三类动物疫病病种名录——中华人民共和国农业部第96号公告(1999年2月12日)[J]. 贵州畜牧兽医,1999(4):30.
List of diseases of the first, second and third types of animal diseases-Announcement No. 96 of the Ministry of Agriculture of the People's Republic of China (February 12, 1999)[J]. Guizhou Animal Husbandry and Veterinary Medicine, 1999 (4): 30.(in Chinese)
[25]王璇,潘淑惠,万一元. 山羊伪结核棒状杆菌病的ELISA诊断[J]. 上海畜牧兽医通讯,2009(2):29.
WANG X, PAN S H, WAN Y Y. ELISA diagnosis of goat pseudotuberculosis coryneformis disease[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2009(2): 29.(in Chinese)
[26]郑敏,胡杰,欧绍毅,等. 广西黑山羊伪结核棒状杆菌的分离与鉴定[J]. 广西农业科学,2010,41(10):1128-1130.
ZHENG M, HU J, OU S Y, et al. Isolation and Identification of Corynebacterium pseudomonas from Guangxi Black Goat[J]. Guangxi Agricultural Sciences, 2010, 41(10): 1128-1130.(in Chinese)
[27]韦志锋,李常挺,陶立,等. 山羊干酪性淋巴结炎病原的分离和鉴定[J]. 中国动物检疫,2011,28(7):54-55,59.
WEI Z F, LI C T, TAO L, et al. Isolation and identification of the pathogen of goat casein lymphadenitis[J]. Chinese Animal Quarantine, 2011, 28(7): 54-55,59.(in Chinese)
[28]朱伟英,猴银行,霍宁宁,等. 一株奶山羊伪结核棒状杆菌的分离与鉴定[J]. 动物医学进展,2017,38(5):127-132.
ZHU W Y, HOU Y H, HUO N N, et al. Isolation and Identification of Corynebacterium pseudomonas from a Milk Goat[J]. Progress in Animal Medicine, 2017, 38(5): 127-132.(in Chinese)
[29]WEISBURG W G, BARNS S M, PELLETIER D A, et al. 16S ribosomal DNA amplification for phylogenetic study[J]. J Bacteriol, 1991, 173(2): 697-703.
[30]許国洋,付利芝,龙小飞,等. 山羊伪结核棒状杆菌PMA-PCR检测方法的建立[J]. 现代畜牧兽医,2018(11):9-13.
XU G Y, FU L Z, LONG X F, et al. Establishment of PMA-PCR detection method for Corynebacterium pseudotuberculosis[J]. Modern Animal Husbandry and Veterinary Medicine, 2018(11): 9-13.(in Chinese)
[31]RE·布坎南,NE·吉本斯. 伯杰细菌鉴定手册[M]. 第八版. 北京:科学出版社,1984:382-389,833-844.
R E BU K N, N E JI B S. Berger Bacterial Identification Manual[M]. 8th Edition. Beijing: Science Press, 1984: 382-389,833-844. (in Chinese)
[32]GUERRERO J A V, ROBERTO MONTES de OCA JIMNEZ, DIBARRAT J A, et al. Isolation and molecular characterization of Corynebacterium pseudotuberculosis from sheep and goats in Mexico[J]. Microbial Pathogenesis, 2018, 117: 304-309.
[33]李基棕,李文良,毛立,等. 伪结核棒状杆菌的分离鉴定及病原性研究[J]. 江苏农业科学,2018,46(4):158-162.
LI J Z, LI W L, MAO L, et al. Isolation, Identification and Pathogenicity of Corynebacterium pseudomonas[J]. Jiangsu Agricultural Sciences, 2018, 46(4): 158-162.(in Chinese)
[34]王志芳,杨增岐,宋志军,等. 羊伪结核病病原的分离鉴定[J]. 中国预防兽医学报,2004(5):47-49.
WANG Z F, YANG Z Q, SONG Z J, et al. Isolation and Identification of the Pathogen of Sheep Pseudotuberculosis[J]. Chinese Journal of Preventive Veterinary Medicine, 2004(5): 47-49.(in Chinese)
[35]李国平,陈家祥,王全溪. 波尔山羊伪结核棒状杆菌在我省的首次分离鉴定[J]. 福建畜牧兽医,2003(5):1-2.
LI G P, CHEN J X, WANG Q X, et al. The first isolation and identification of Corynebacterium pseudotuberculosis in Boer Province[J]. Fujian Animal Husbandry and Veterinary Medicine, 2003(5): 1-2.(in Chinese)
[36]张梦思,李和贤,周作勇. 四川达州地区山羊伪结核棒状杆菌病的诊断及药敏试验[J]. 中国兽医杂志,2015,51(12):54-56,50.
ZHANG M S, LI H X, ZHOU Z Y. Diagnosis and drug susceptibility test of Pseudotuberculosis coryneformosis in goats in Dazhou area, Sichuan Province[J]. Chinese Journal of Veterinary Medicine, 2015, 51(12): 54-56,50.(in Chinese)
[37]吴浩阳,许信刚,任杰,等. 山羊伪结核棒状杆菌的分离与鉴定[J]. 畜牧与兽医,2018,50(9):74-77.
WU H Y, XU X G, REN J, et al. Isolation and Identification of Corynebacterium pseudotuberculosis[J]. Animal Husbandry and Veterinary Medicine, 2018, 50(9): 74-77.(in Chinese)
[38]潘淑惠,王璇,万晴姣,等. 山羊伪结核棒状杆菌感染途径及病理变化观察[J]. 上海畜牧兽医通讯,2007(5):24-25.
PAN S H, WANG X, WAN Q J, et al. Pathway and Pathological Changes of Corynebacterium tuberculosis in Goat[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine,2007(5): 24-25.(in Chinese)
(责任编辑:张 梅)
