大肠杆菌茶氨酸合成酶基因γ-GGT的生物信息学分析
2019-09-10吕晶晶张天缘杨仕梅宋莉赵德刚
吕晶晶 张天缘 杨仕梅 宋莉 赵德刚
摘 要:γ-谷氨酰转肽酶(γ-GGT)是催化L-茶氨酸合成的关键酶之一,对其编码基因的解析有助于进行茶氨酸的合成调控和异源表达生产研究,本论文利用生物信息学方法,对大肠杆菌(Escherichia coli)γ-GGT基因的结构和特性进行分析。结果显示,E.coli γ-GGT基因编码580个氨基酸,主要氨基酸为甘氨酸和亮氨酸,γ-GGT酶蛋白等电点为5.38,分子量为61.7 kDa,属于酸性不稳定亲水性蛋白,具有信号肽序列和保守功能结构域,在细胞质周质中发挥作用,其二级结构元件主要是α-螺旋和无规卷曲,在微生物中进化较为保守。研究结果为进一步研究γ-GGT基因功能及其应用奠定了基础。
关键词:大肠杆菌;γ-谷氨酰胺转肽酶;茶氨酸合成;GGT酶蛋白;生物信息学
中图分类号:Q180.99
文献标识码:A
文章编号:1008-0457(2019)01-0074-05 国际DOI编码:10.15958/j.cnki.sdnyswxb.2019.01.014
茶氨酸(Theanine)是一种不参与蛋白组成的游离氨基酸[1],于1950 年首次从绿茶中首次分离得到[2],是一种难以替代的生物活性物质,具有广泛的药用和保健价值,如降血压[3]、提高免疫力[4]、抑制兴奋[5]、减轻体重[6]、缓解精神压力[7,8]、提高学习能力和记忆力[7]等。γ-谷氨酰胺转肽酶(γ-Glutamyltranspeptidase,γ-GGT)是茶氨酸合成途径中的关键酶,其通过将谷氨酰胺上的γ-谷氨酰基转移到乙胺受体上催化合成茶氨酸[4],该反应过程不需要ATP,底物可以是成本低廉的谷氨酰胺和谷胱甘肽等[9],因此γ-GGT在茶氨酸生产中具有重要价值。对γ-谷氨酰胺转肽酶编码基因γ-GGT的认识是其异源表达生产茶氨酸的基本前提,本文通过生物信息学分析方法,对大肠杆菌(Escherichia coli)γ-GGT基因及其编码产物的理化性质、蛋白质结构及系统进化发育等进行分析和功能预测,旨在为进一步研究该基因及利用其生产茶氨酸奠定基础。
1 材料与方法
1.1 序列来源
大肠杆菌γ-GGT基因的CDS序列(EG10374)来自NCBI数据库(https://www. ncbi. nlm. nih. gov/)。
1.2 方法
采用ExPASy工具分析GGT蛋白的理化性質,使用PSORTB软件预测GGT蛋白的亚细胞定位[11],利用在线软件SignalP 4.1 Server(http://www.cbs.dtu.dk/ services/SignalP/)预测分析信号肽,利用在线分析工具SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa _automat.pl?page=npsa_sopma. html)预测蛋白二级结构,利用SWISS-MODE (https:// swissmodel.expasy.org/)在线分析工具预测蛋白三级结构,通过Pfam数据库对蛋白结构域进行分析,通过blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线比对不同物种的GGT蛋白序列结构,用MEGA7.0软件构建系统进化树。
2 结果与分析
2.1 GGT蛋白的理化性质和亚细胞定位
通过ExPASy中的ProtParam工具对E.coli γ-GGT基因编码的GGT蛋白(gamma-glutamyltrans- peptidase/GGT/EC)进行理化性质分析。结果表明:γ-GGT基因编码580个氨基酸,组成氨基酸中以甘氨酸(Gly)最为丰富(占9.7%),其次是亮氨酸(Leu)(占6.7%)。带负电荷的氨基酸残基总数(Asp+Glu)为66,带正电荷的氨基酸残基总数(Arg+Lys)为55,以负电荷氨基酸为主。E.coli GGT蛋白的其理论等电点pI为5.38,呈酸性。其理论分子量为61.7kDa。不稳定系数为43.42,推测GGT蛋白为不稳定蛋白。
利用PSORTB软件对GGT蛋白进行亚细胞定位预测发现(表1),E.coli GGT蛋白位于细胞质膜、细胞质、外膜和细胞外的分值为0,位于周质的分值为10,表明GGT蛋白位于细胞周质,该可能性为100%。
2.2 GGT蛋白的信号肽和疏/亲水性特性
信号肽是引导新生蛋白向分泌通路转移的短肽链,其与蛋白的分泌特性有关。结果显示,信号肽酶切位点C-score(C)分值为26;综合剪切位点Y-score(Y)分值为26;信号肽位点S-score(S)是分值为17,可见GGT蛋白具有信号肽序列,且信号肽位于1-25位氨基酸之间,表明E.coli GGT蛋白是一种分泌蛋白。
通过ExPasy中的ProtScale工具对E.coli GGT蛋白进行疏水性及亲水性的预测分析。结果显示该蛋白的平均亲水系数为-0.220,表明 GGT蛋白是一种亲水性蛋白,分布在细胞膜的可能性不大。
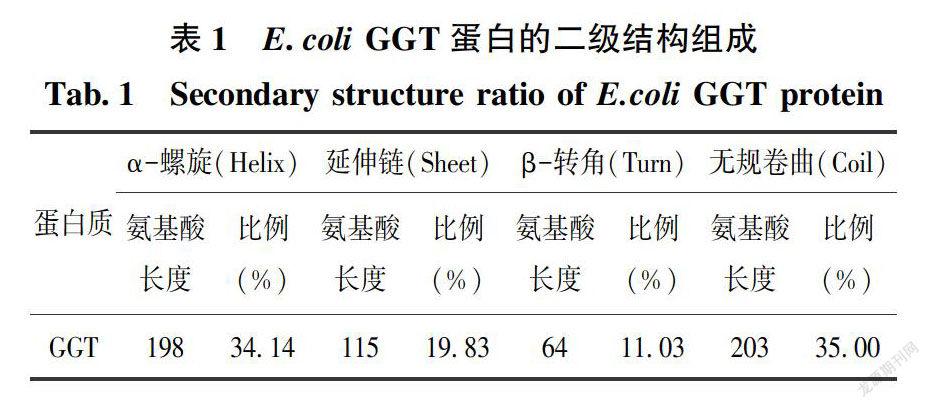
2.3 GGT蛋白的二级结构组成与分布
利用SOPMA在线工具分析E.coli GGT蛋白的二级结构。结果表明,GGT蛋白的二级结构由34.14%的α-螺旋(Helix),19.83%的延伸链(Sheet),11.03%的β-转角(Turn)和35%的无规卷曲(Coil)组成,以Helix和Coil结构为主(表2)。
E.coli GGT蛋白的二级结构组成成分分布图显示,各组成单元Helix、Sheet、Turn和Coil均较为平衡地分布于整个蛋白多肽链中。
2.4 GGT蛋白的三级结构主要元件
通过SWISS-MODEL在线分析工具对E.coli GGT蛋白进行三级结构预测分析,建立其三维结构模型。该模型显示出GGT蛋白具有明显可见的Helix和Coil结构,其空间结构的主要组成元件是α-螺旋和无规卷曲,这与二级结构的分析结果是一致的。
2.5 GGT蛋白的功能结构域
利用Pfam数据库对E.coli GGT蛋白进行结构域分析。结果显示GGT蛋白具有明显的保守结构域(Pfam登录号:PF01019),除了1-25位氨基酸序列构成的信号肽以外,在63-574位氨基酸之间构成γ-谷氨酰胺转肽酶的功能结构域。在原核和真核生物中,γ-谷氨酰胺转肽酶是由两条多肽链(一个重链和一个轻亚基)组成的酶,其由单链前体通过自动催化切割加工而成,小亚基上的N-端氨基酸是严格保守的苏氨酸残基,该残基是自加工和酶反应的催化亲和位点[12-14],可以催化谷胱甘肽的γ-谷氨酰基部分转移到氨基酸、多肽或是水等受体上形成谷氨酸,这是GGT在γ-谷氨酰循环、谷胱甘肽的合成和降解途径以及药物和异生毒素解毒中发挥关键作用的结构基础。
2.6 GGT蛋白的进化分析
对大肠杆菌与部分物种的GGT蛋白进行系统进化分析,以揭示大肠杆菌与其他物种GGT蛋白的亲缘关系。利用MEGA 7.0软件基于GGT蛋白氨基酸序列构建系统发育树(Neighbor-Joining,NJ),在Boostrap值为1000的条件下,发现GGT蛋白进化相对保守,不同物种的GGT主要聚在一个大类群中,仅小部分单独分支。大肠杆菌的GGT蛋白与肠道沙门氏菌亚种肠道血清变型伤寒沙门氏菌(NP_458368.1)同源性最高,其次是天蓝色链霉菌 (NP_630494.1),在微生物中表现出较高的亲缘关系;而与新型腹泻原虫 (XP 001827855.1)的亲缘关系最远,暗示在不同物种间GGT蛋白酶的催化能力可能会有较大区别。
3 结论与讨论
γ-GGT基因编码的γ-谷氨酰胺转肽酶在生物体内广泛存在[9],是谷胱甘肽代谢过程中的一个关键酶,对该基因的结构和特性的解析是利用其进行生物反应器生产目标产品的重要基础。信号肽是对蛋白的分泌起主导作用的位于分泌蛋白N端的一段序列[15-16],细菌GGT蛋白为可溶性蛋白,其在自身信号肽的介导下被转运至周质空间发挥生理作用[17],细菌GGT一般位于周质[18]和胞外[19]。
本研究表明,大肠杆菌GGT蛋白具有信号肽序列,是一种不稳定的亲水性周质酶蛋白,这与上述报道是一致的。由于细胞周质的氧化环境有利于蛋白的折叠,其产生的蛋白具有活性并易于提取纯化[20],E.coli GGT蛋白超量表达时可获得有效高活性的蛋白,在基因工程生物反应器生产中有利于提高目标产品的产量。已有报道证实重组大肠杆菌工程菌株可以獲得γ-GGT基因的高效表达[21]。在生物细胞中,GGT酶催化谷胱甘肽的γ-谷氨酰基部分转移到氨基酸、多肽或水等受体上形成谷氨酸,也可通过催化底物谷氨酰胺和乙胺发生转谷氨酰基反应生成茶氨酸[22],在谷胱甘肽的合成和降解、γ-谷氨酰循环以及药物和异生毒素解毒等过程中发挥关键作用,该生物学功能实现的结构基础是GGT蛋白特定的结构功能域[9]。本研究通过Pfam数据库对GGT蛋白进行搜索发现其具有保守和典型的功能域结构,这为揭示其催化活性提供了分子依据。对哺乳动物和细菌GGT基因的测序分析表明,GGT基因均编码580个氨基酸,编码蛋白的同源性极高[23-27],可见,GGT蛋白的进化相对保守,在不同物种间具有一定的通用特性,本研究中不同物种的GGT蛋白主要聚在一个大类群中予以了证实,尤其在微生物中最为明显,这也提示进行GGT蛋白的异源表达生产具有较高的可行性。
参 考 文 献:
[1] 高小红,袁 华,喻宗沅. 茶氨酸的研究进展[J].化学与生物工程,2004,21(1):7-9.
[2] Sakato Y. The chemical constituents of tea :III. A new amide theanine[J]. Nippon Nogeikagaku Kaishi,1949(23):262-267.
[3] 吕 毅,郭雯飞,倪捷儿,等. 茶氨酸的生理作用及合成[J].茶叶科学,2003,23(1):1-5.
[4] 王丽鸳,王贤波,成 浩,等. 基因工程菌生物合成茶氨酸条件研究[J].茶叶科学,2007,27(2):111-116.
[5] Yokogoshi H,Kobayashi M. Hypotensive effect of gamma-glutamylmethylamide in spontaneously hypertensive rats[J].Life Sciences,1998,62(12):1065-1068.
[6] Kamath AB,Wang L,Das H,et al. Antigens in tea-beverage prime human Vγ2Vδ2 T cells in vitro and in vivo for memory and nonmemory antibacterial cytokine responses[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(10):6009-6014.
[7] Yokogoshi H,Mochizuki M,Saitoh K. Theanine-induced reduction of brain serotonin concentration in rats[J].Bioscience Biotechnology & Biochemistry,1998,62(4):816-817.
[8] Kakuda T,Nozawa A,Unno T,et al. Inhibiting effects of theanine on caffeine stimulation evaluated by EEG in the rat[J].Journal of the Agricultural Chemical Society of Japan,2000,64(2):287-293.
[9] 帅玉英. γ-谷氨酰转肽酶的纯化和性质及其用于L-茶氨酸的生物制备研究[D].扬州:江南大学,2011.
[10] 王风青,梁金钟,付大伟,等. γ-PGA降解酶系基因pgdS和ggt的克隆及生物信息分析[J].食品工业科技,2016,37(16):190-194.
[11] Suzuki H,Izuka S,Miyakawa N,et al. Enzymatic production of theanine,an “umami” component of tea,from glutamine and ethylamine with bacterial γ-glutamyltranspeptidase[J].Enzyme & Microbial Technology,2002,31(6):884-889.
[12] Boanca G,Sand A,Okada T,et al. Autoprocessing of Helicobacter pylori gamma-glutamyltranspeptidase leads to the formation of a threonine-threonine catalytic dyad[J].Journal of Biological Chemistry,2007,282(1):534.
[13] Takahashi H,Watanabe H. Post‐translational processing of Neisseria meningitidisγ‐glutamyl aminopeptidase and its association with inner membrane facing to the cytoplasmic space[J].Fems Microbiology Letters,2004,234(1):27-35.
[14] 杨运桂,徐京宁,胡泰山,等.信号肽疏水性的提高促进青霉素G酰化酶分泌[J].生物化学与生物物理学报(英文),2000(2):163-168.
[15] Izard J W,Doughty M B,Kendall D A. Physical and Conformational Properties of Synthetic Idealized Signal Sequences Parallel Their Biological Function[J].Biochemistry,1995,34(31):9904.
[16] 郭 亮,沈 微,王正祥,等. 生物转化法生产茶氨酸的重组大肠杆菌的构建[J].食品与生物技术学报,2005,24(2):41-45.
[17] Suzuki H,Kumagai H,Tochikura T. γ-Glutamyltranspeptidase from Escherichia coli K-12:Formation and location [J].Journal of Bacteriol,1986,168 (3):1332-1335.
[18] Hiromichi Minami,Hideyuki Suzuki,Hidehiko Kumagai. Salt-tolerant γ-glutamyltranspeptidase from Bacillus subtilis,168 with glutaminase activity[J].Enzyme & Microbial Technology, 2003,32(3):431-438.
[19] 郭建華. 蔗糖浓度对渗透休克法提取细胞周质重组蛋白的影响[J].安徽农业科学,2017,45(4):147-148.
[20] 贾晓鹤,陈 莉,赵宁伟,等. 生物转化法应用重组谷氨酰转肽酶合成L-茶氨酸[J].食品工业科技,2008(2):166-169.
[21] Suzuki H,Kumagai H. Autocatalytic Processing of γ-Glutamyltranspeptidase[J].Journal of Biological Chemistry,2002,277(45):43536-43543.
[22] Ishiye M, Yamashita M, Niwa M. Molecular cloning of the γ-glutamyltranspeptidase gene from a Pseudomonas strain [J].Biotechnol ogy Progree,1993,9 (3):323-331.
[23] Suzuki H,Kumagai H. Gamma-glutamyltranspeptidase from Escherichia coli K-12[J].Seikagaku the Journal of Japanese Biochemical Society,1989,61(6):491-496.
[24] Chevalier C,Thiberge J M,Ferrero R L,et al. Essential role of Helicobacter pylori γ-glutamyltranspeptidase for the colonization of the gastric mucosa of mice[J].Molecular Microbiology,2010,31(5):1359-1372.
[25] Xu K,Strauch MA. Identification,sequence,and expression of the gene encoding gamma-glutamyltranspeptidase in Bacillus subtilis[J].Journal of Bacteriology,1996,178(14):4319-4322.
[26] Lin LL,Chou PR,Hua YW,et al.Overexpression,one-step purification,and biochemical characterization of a recombinant γ-glutamyltranspeptidase from Bacillus licheniformis[J].Applied Microbiology and Biotechnology,2006,73 (1):103-112.
[27] JeanF. Tomb,Owen White,Anthony R. Kerlavage,et al. The complete genome sequence of the gastric pathogen Helicobacter pylori[J].Nature,1997,388(6642):539.
