陕甘花楸果实多糖的结构表征及抗氧化活性研究
2019-09-10王铖博陈乐乐焦彩珍石继鹏慕星星张继
王铖博 陈乐乐 焦彩珍 石继鹏 慕星星 张继
摘 要:陜甘花楸(Sorbus koehneana)是我国西北地区特有的灌木之一,主要被用于观赏和制作家具,但对其有效成分的研究却鲜见报道,从而限制了陕甘花楸产业的进一步开发和利用。该研究以陕甘花楸果实为原料,经石油醚脱脂后,采用超声辅助水提醇沉法提取、Sevag法脱蛋白,得到了较纯的花楸果实多糖(SSP),并对其进行结构表征和抗氧化活性研究。结果表明:(1)经苯酚-硫酸法测得多糖纯度为65.8%;FT-IR检测官能团,发现在3 420 cm-1、2 929 cm-1和1 733 cm-1处存在多糖的典型吸收峰;用SEC-LLS测得重均分子量(Mw)为1.739×105,数均分子量(Mn)为5.052×104,多分散系数为3.443,表明分子量分布较为均一;经三氟乙酸酸解、糖腈衍生化等处理及气相-质谱联用法测定SSP的单糖组成,表明SSP由甘露糖、葡萄糖和未知单糖等3种单糖组成,摩尔比为2.2∶1.4∶6.4。(2)体外抗氧化活性实验表明:SSP具有很好的DPPH清除活性、超氧阴离子清除活性以及较强的还原力;当SSP浓度为2 mg·mL-1时,SSP对DPPH自由基的清除能力相当于BHT的96%,对超氧阴离子自由基清除能力为Vc的76.07 %,还原能力等价于Vc的92%。以上表明该多糖可以用于抗衰老和抗炎等方面,是一种优良的天然抗氧化剂,为花楸资源的进一步开发利用提供了更为广阔的前景。
关键词:陕甘花楸, 多糖, 提取纯化, 结构表征, 抗氧化活性
中图分类号:Q946.3
文献标识码:A
文章编号:1000-3142(2019)11-1527-07
Abstract:Sorbus koehneana is one of the shrubs peculiar in Northwest China. It is mainly used for ornamental and making tools. The research on its effective components is rarely reported, which limits the further development and utilization of the industry of S. koehneana. The polysaccharide components in the fruit of S. koehneana were extracted, and their structures and antioxidant activities were studied. Take S. koehneana fruit as materials, use ultrasonic assisted water extraction and alcohol precipitation, and sevage method to remove protein. Thus, we obtained the S. koehneana fruit polysaccharide(SSP). The results were as follows:(1) The polysaccharide content detected by phenol-sulfuric acid method was 65.8%. The functional group was detected by FT-IR and the polysaccharide was observed to have three characteristic peaks of sugar at 3 420 cm-1, 2 929 cm-1 and 1 733 cm-1, whose molecular weight(Mw) was detected by the SEC-LLS was 1.739×105, number average molecular weight(Mn) was 5.052×104 and the polydispersity was 3.443, and uniform molecular weight distribution. Acidolysis of polysaccharides with trifluoroacetic acid, hydroxylamine hydrochloride and acetic anhydride were derivatized. The monosaccharide composition of S. koehneana polysaccharides was determined by GC-MS, and the polysaccharides were composed of three kinds of monosaccharides such as mannose, glucose and unknown monosaccharide, and the molar ratio was 2.2∶1.4∶6.4.(2) The antioxidant activity tests in vitro showed that the SSP had high scavenging capacity on DPPH, superoxide anion radicals and reducing power. The scavenging capacity of SSP on DPPH radical was 96% of BHT, 76.07% of Vc on superoxide anion radical and 92% of Vc on reduction, while the concentration of SSP was 2 mg·mL-1. Through this study, we can not only provide theoretical basis for the efficient extraction of polysaccharides from S. koehneana fruits, but also provide a broader prospect for the further development and utilization of S. koehneana resources.
Key words:Sorbus koehneana, polysaccharide, extraction and purification, structural characterization, antioxidant activity
花楸(Sorbus pohuashanensis),为蔷薇科苹果亚科花楸属。果实为圆形,颜色为红色,结实期为9—10月(Li et al., 2012)。研究表明,花楸属植物有抗氧化、抗癌、治疗炎症、护肝等功能,花楸果实具有利尿、治疗心血管疾病等功能(Li, 2011; Termentzi et al., 2006)。陕甘花楸(S. koehneana)是花楸属植物的一个种,果实中富含多种生物活性物质,如多糖、维生素、蛋白质和膳食纤维等(Li et al., 2012)。
多糖是其中重要的一种生物活性物质,由于其具有抑制肿瘤细胞生长、抗氧化、抑菌、防辐射、保护心血管、调节机体免疫力、清除自由基等活性(王运强,2009; Chen et al., 2015; Liu et al., 2018),且绿色安全,已引起人们的广泛关注(徐雅琴等,2017)。
董成国(2016)研究表明,可以采用超声波辅助水提法,这是由于在超声波传播的过程中,能够作用于提取液,产生空化效应、热效应和机械效应,其中以空化效应为主,会导致植物细胞壁发生破裂,从而释放目标产物到提取液中,有利于提高多糖的得率。在多糖的结构表征研究中,常使用FT-IR检测样品含有的官能团,初步鉴定样品是否为多糖类物质;通过对多糖物质的酸解及乙酰化处理,使用GC-MS来检测其单糖组成;多糖的生物活性与分子量有很大的关系,所以采用SEC-LLS来测定多糖物质的分子量及分散系数。人体在生命活动过程中,会产生大量的自由基,自由基的存在会造成组织和细胞的巨大损伤,加速机体的衰老,许多疾病的发生和发展都与氧化损伤存在很大的关系,如心血管疾病和癌症等(Hu et al., 2010)。目前合成的化学抗氧化药物均有一定的副作用,因此,寻找高效低毒的天然抗氧化剂具有重要的研究意义。
1 材料與方法
1.1 材料
所用材料采自甘肃省兰州市石佛沟国家森林公园,海拔2 800~3 000 m的小溪边阴坡,野生,经西北师范大学生命科学学院令利军副教授鉴定为蔷薇科花楸属陕甘花楸(Sorbus koehneana),标本编号2016-07-15-010。
1.2 仪器和试剂
1.2.1 主要仪器 KQ-250DE数控超声波清洗器(昆山市超声仪器有限公司);UV 9100b紫外-可见分光光度计(北京莱伯泰科仪器有限公司);LGJ-18S真空冷冻干燥机(北京松源华兴科技发展有限公司);Nicoletis10傅里叶变换红外光谱仪(美国Thermo公司);体积排阻色谱-光散射联用(SEC-LLS);Polaris Q-Focus GC气相-质谱联用仪(美国Thermo公司)。
1.2.2 试剂 溴化钾(天津市光复精细化工研究所);石油醚(烟台市双双化工有限公司);DPPH(西安热默尔生物科技有限公司);BHT(淄博祥东化工有限公司);Vc(太原永耀生物科技有限公司);NBT(上海沪宇生物科技有限公司)。
1.3 方法
1.3.1 陕甘花楸果实多糖(SSP)的提取、分离和纯化 将陕甘花楸果实晾干,粉碎过100目筛,以石油醚作为脱脂溶剂,使用索氏提取器进行脱脂处理。取50 g脱脂花楸粉,按料液比1∶20加入蒸馏水,超声辅助提取(董成国,2016)。提取温度60 ℃,功率200 W,提取时间1 h。提取液4 000 r·min-1离心10 min,收集上清。重复提取一次,合并上清液,浓缩。80%乙醇醇沉。离心收集沉淀即得花楸果实粗多糖。粗多糖复溶,按4∶1的比例加入Sevage试剂(氯仿∶正丁醇=4∶1),重复多次,直至紫外光260~280 nm范围没有吸收峰(郭元亨等,2018)。脱蛋白处理后的粗糖液冷冻干燥,即得花楸果实多糖(SSP)。
1.3.2 多糖含量的测定 使用苯酚-硫酸法在490 nm处测定吸光值,以葡萄糖作标准曲线,计算多糖含量(Liu et al., 2018)。
1.3.3 红外光谱(FT-IR)分析 SSP的红外光谱分析采用KBr压片法。取充分干燥的花楸果实多糖样品,按KBr∶样品=100∶1的比例进行压片。使用FT-IR在4 000~400 cm-1的波数范围内扫描16次,分辨率4 cm-1(王小江等,2017)。
1.3.4 分子量测定 参照殷军(2013)使用的方法,并略作修改。样品分子量采用体积排阻色谱-光散射联用(SEC-LLS)进行测定。检测器为多角度激光光散射仪(DAWN Eos, Wyatt Technology Co., USA),λ=690 nm;色谱柱为UltrahydrogelTM column(7.8 mm×300 mm, Waters, USA);示差折光检测器(DAWN Eos, Wyatt Technology Co., USA)。检测样品浓度为2.0 mg·mL-1,样品检测前经孔径为0.2 μm过滤器过滤。
1.3.5 单糖组成分析 用GC-MS研究单糖组成,参考刘琴等(2014)的方法。
花楸果实多糖酸解:准确称取20 mg花楸果实多糖,加入4 mL 4 mol·L-1三氟乙酸,并在氮气保护条件下油浴120 ℃处理10 h后,减压浓缩蒸干其中的三氟乙酸。
柱前衍生化:向减压蒸干后的多糖样品中,加入10 mg盐酸羟胺和1 mL吡啶,氮气保护90 ℃反应30 min,待冷却后,向反应体系中加入1 mL乙酸酐进行乙酰化处理,氮气保护下90 ℃反应30 min。减压蒸干后加入1 mL氯仿溶解,无水硫酸钠脱水过0.22 μm微孔滤膜,待气质分析。
气相色谱条件:TR-5ms SQC色谱柱(30 mm × 0.25 mm × 0.25 μm),升温条件:从120 ℃(保持3 min)开始,以5 ℃·min-1升温至250 ℃保持5 min。载气为高纯氦气(He),柱流量为1.0 mL·min-1,分流比为1∶50,进样口温度250 ℃,进样量0.2 μL。
质谱(MS)条件:电离方式为电子电离(electron ionization, EI)源,电子能量70 eV,离子源温度250 ℃,四极杆150 ℃,扫描质量范围为33~550 m·z-1,无溶剂延迟。
标准单糖处理方法和GC-MS条件同上。
1.3.6 DPPH自由基清除活性测定 精确称取SSP和BHT配制浓度为0.2、0.6、1.0、2.0 mg·mL-1的溶液。在SSP组和BHT组中分别加0.5 mL 2.0×10-4 mol·L-1的DPPH,遮光静置0.5 h,517 nm下测得Ai。吸取不同浓度待测多糖溶液以及BHT溶液2 mL,加入0.5 mL蒸馏水,测得Aj。0.5 mL DPPH溶液中加等体积的蒸馏水,测得A0,重复3次求平均值(Cheng & Kan, 2017)。计算公式如下:
DPPH清除率=(1-Ai-AjA0)×100%。
1.3.7 超氧阴离子清除活性测定 精确称取SSP和Vc配制浓度为0.2、0.6、1.0、2.0 mg·mL-1的溶液。取1 mL 4种梯度的SSP溶液和Vc溶液,分别加浓度为557 μmol·L-1 NADH-2Na、45 μmol·L-1 PMS及108 μmol·L-1 NBT各1mL,混匀后,于25 ℃反应5 min,510 nm下测得Ai。以蒸馏水为对照,测得A0,重复三次求平均值(Li et al., 2006)。计算公式如下:
超氧阴离子清除率=(1-AiA0)×100%。
1.3.8 还原力测定 参照于学海等(2014)使用的方法并略作修改。SSP与Vc配制浓度为0.02、0.06、0.1、0.2、0.6、1、2 mg·mL-1的溶液。各取1 mL 7种浓度的多糖溶液和Vc溶液依次加入磷酸缓冲液(pH 6.6)和铁氰化钾[K3Fe(CN)6]溶液(质量分数为1%)各2.5 mL,混匀后50 ℃水浴20 min,然后加入三氯乙酸溶液(质量分数为10%)2.5 mL,混匀,1 000 r·min-1离心10 min,取上清液2.5 mL,再加入蒸馏水和氯化铁(FeCl3,质量分数0.1%)各2.5 mL,混匀,静置10 min,蒸馏水调零,在700 nm处测定吸光值,每个样品重复3次,以700 nm吸光值的平均数表示还原力的高低。
1.4 数据分析
采用SPSS18.0统计分析软件的ANOVA方法对实验数据进行差异显著性检验分析,以P<0.05为差异显著,数据表示为平均值±标准差(x±s)。
2 结果与分析
2.1 SSP的提取与纯化
經苯酚-硫酸法测得梯度葡萄糖的吸光值,得到标准曲线。回归方程:Y=16.238 54X-0.043 85,R2=0.999 06。式中,Y为吸光度,X为浓度。测得SSP纯度为65.8%。
2.2 红外光谱分析
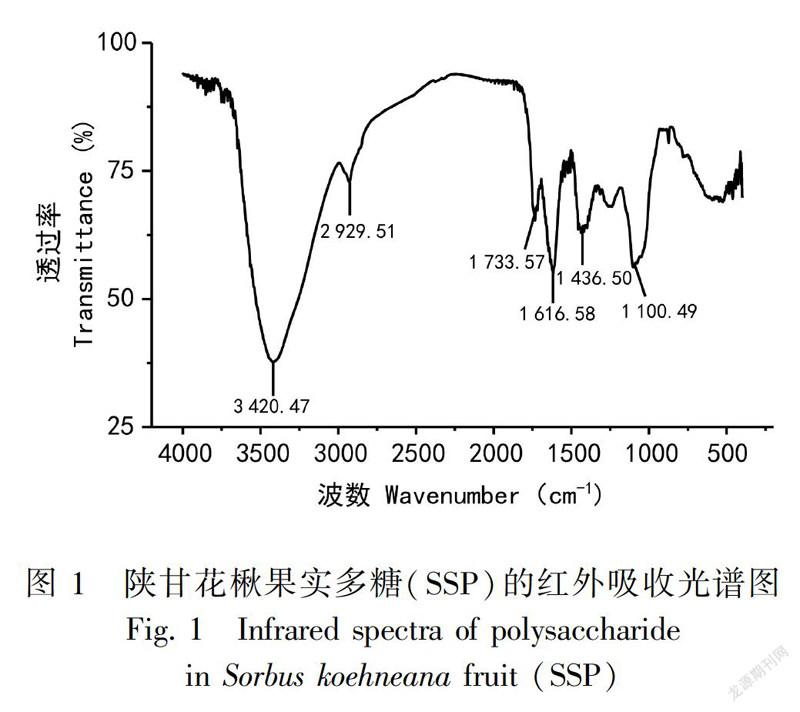
红外光谱是定性鉴定多糖结构的基本方法,根据红外光谱中各特征峰的位置和性状可以推断出多糖结构的特征。图1为 SSP在4 000~400 cm-1范围内的红外吸收光谱。表现出典型的多糖吸收峰。其中,波数3 420.47 cm-1处的大而宽的吸收峰为分子量羟基(-OH)的伸缩振动峰(Chen et al., 2018);2 929.51 cm-1处的肩峰是亚甲基(-CH2)中C-H键的伸缩振动峰(封燕等,2016);1 733.57 cm-1处的吸收峰是醛基(-CHO)的C=O伸缩振动峰(Wang et al., 2018);1 616.58 cm-1和1 436.50 cm-1左右处的吸收峰对应的可能是C-H 键伸缩振动峰和=CH2的变形特征峰(张逸等,2017);1 100.49 cm-1处是吡喃糖环的特征吸收峰,表明该糖为吡喃糖(封燕等,2016)。
2.3 分子量测定
采用SEC-LIS法测定SSP的分子量,软件分析可知,SSP重均分子量(Mw)为1.739×105,数均分子量(Mn)为5.052×104,多分散系数(Mw·Mn-1)为3.443,说明其分子量分布较为均一。
2.4 单糖组成分析
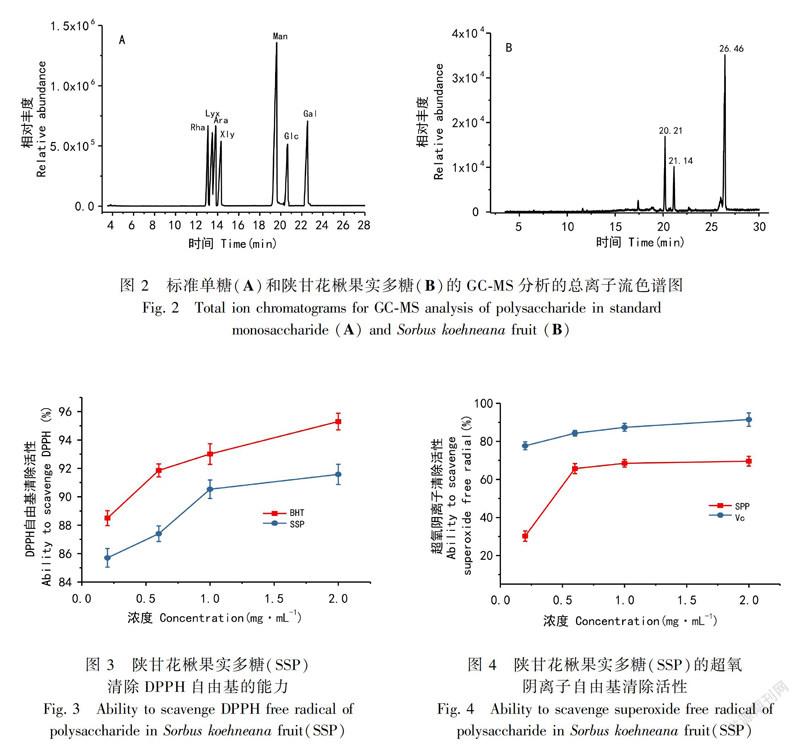
通过对7种标准单糖和SSP样品先后进行气质分析,由图2:B得知,陕甘花楸果实多糖在此色谱下分离完全,有主要的三个峰。与混合标准单糖的色谱图(图2:A)对照,SSP由3种单糖组成,
分别为甘露糖、葡萄糖与未知单糖。26.46 min处的单糖由于缺少相应单糖标品,暂时未分析出来。通过峰面积之比得出,三种单糖的摩尔比为2.2∶1.4∶6.4。
2.5 DPPH自由基清除活性测定
DPPH(二苯代苦味酰自由基)在有机溶剂中是一种稳定的自由基,在517 nm附近有强吸收峰(呈深紫色)。当自由基清除剂存在时,DPPH的孤对电子被配对,其517 nm吸收消失或减弱,通过测定吸收减弱的程度,可评价自由基清除剂的活性。
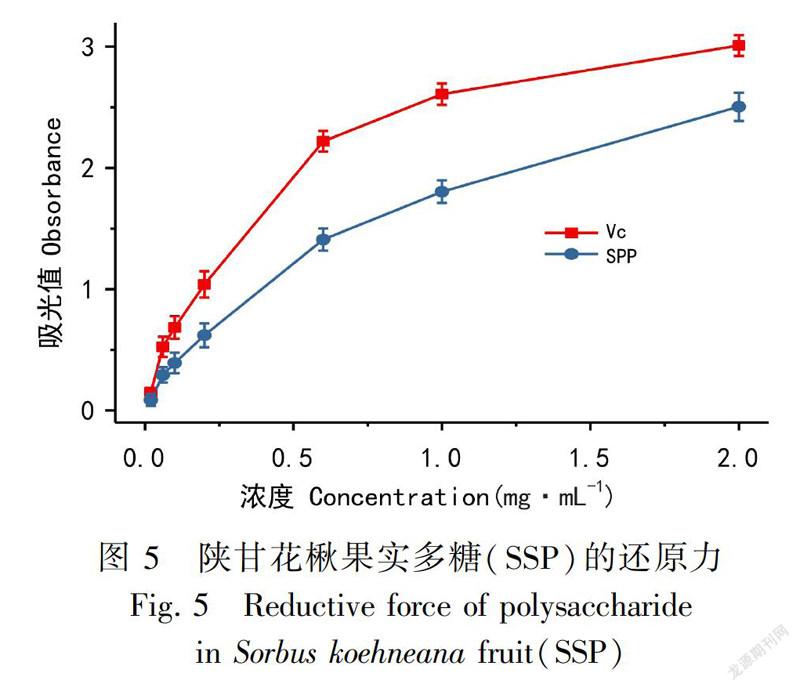
SSP对DPPH自由基的清除作用见图3。加入SSP后可以显著作用于DPPH自由基的清除,并且这种清除能力随着SSP浓度的升高(0.2~2 mg·mL-1)而增强,呈现一定的量效关系。以BHT
对DPPH自由基的清除能力为参考,对应的每个浓度下,SSP对DPPH自由基的清除能力均小于BHT。但当浓度为2 mg·mL-1时,SSP对DPPH自由基的清除能力相当于BHT的96%。结果表明SSP是一种可以有效清除DPPH自由基的抗氧化剂。
2.6 超氧阴离子自由基清除活性测定
超氧阴离子自由基是活性氧的一种,在体内由过氧化物歧化酶清除。在自氧化体系当中释放出的高毒性超氧阴离子经过一系列反应生成其他氧自由基,通过损伤重要的生物大分子来诱发许多疾病。
SSP对超氧阴离子自由基的清除作用见图4,加入SSP处理后可以显著作用于超氧阴离子自由基的清除,且清除活性随SSP浓度的升高(0.2~2 mg·mL-1)而增强。以Vc对超氧阴离子自由基的清除能力为参照,对应的每个浓度下,SSP对超氧阴离子自由基的清除活性均低于Vc,但在2 mg·mL-1的浓度下,SSP对超氧阴离子自由基的清除活性相当于Vc的76.07%。结果表明,SSP有较强的超氧阴离子自由基清除活性,且活性随着浓度的增加而增加。
2.7 还原力测定
还原力是测定抗氧化剂活性的重要指标之一,通过测定体系中Fe3+-Fe2+的转化程度来确定多糖的还原能力强弱。
SSP的還原力可由图5得出,在0.02~2 mg·mL-1范围内,SSP随浓度变大,还原能力呈上升趋势。以Vc的还原力强弱作为对照,在对应的每个浓度梯度下,SSP的还原能力均低于Vc。当浓度为2 mg·mL-1时,SSP的还原能力为Vc的92%。结果表明,SSP有较好的还原力,其还原力随着浓度的增大而增大。
3 讨论与结论
本研究结合西北特有且研究较少的特色资源,研究了陕甘花楸(Sorbus koehneana)果实多糖的化学结构(单糖组成及其摩尔比、分子量、官能团的种类),并从体外水平考察花楸多糖对氧化损伤的保护能力。
花楸果实多糖(SSP)主要经超声辅助水提醇沉法提取,石油醚索氏提取法脱脂,Sevage法脱蛋白纯化,苯酚-硫酸法测纯度为65.8%。FT-IR检测3 420.47 cm-1、2 929.51 cm-1及1 733.57 cm-1处有显著的多糖特征吸收峰,1 100.49 cm-1处吸收峰表明SSP具有吡喃类多糖;GC-MS及GPC结果表明SSP是由甘露糖、葡萄糖及另外一种未知单糖组成,摩尔比为2.2∶1.4∶6.4,重均分子量(Mw)为1.739×105的一种杂多糖。
研究指出,机体的许多功能障碍和疾病的发生都与氧化损伤有关,例如神经退行性疾病(neurodegenerative disease)、肿瘤(tumour)、心血管疾病(cardiovascular diseases)和炎症(inflammation)等。因此,开发研究高效低毒的天然抗氧化剂用于这些疾病的预防和治疗是国内外研究的热点。多糖是生物体内的一种生物活性大分子,在抗氧化、抗肿瘤、免疫调节和防辐射等方面发挥着重要的作用。多糖一般通过两个途径发挥其抗氧化活性:一是直接清除体内的自由基;二是通过增强生物体内抗氧化酶的活性,从而达到清除自由基的作用(刘孝平等,2019;张伟豪等,2018)。常以DPPH自由基清除活性、超氧阴离子自由基清除活性和还原力测定来评定其抗氧化能力。因此,本研究探究了以上几个指标测定SSP的抗氧化能力强弱。体外抗氧化实验结果表明当SSP浓度为2 mg·mL-1时,SSP对DPPH自由基的清除能力相当于BHT的96%,对超氧阴离子自由基清除能力为Vc的76.07%,还原能力等价于Vc的92%。以上结果均证实SSP具有较强的抗氧化活性,是一种优良的天然抗氧化剂。
陕甘花楸作为西北地区特有的植物资源,对其研究开发仍然不够,其中有效成分得不到很好的开发利用,因此本研究立足于陕甘花楸,对其果实中生物活性物质多糖进行了结构表征及抗氧化活性的研究。 通过本研究,可以为陕甘花楸的进一步开发利用提供理论指导,并为抗氧化新型制剂的开发提供了一定的科学依据。陕甘花楸不仅可作为观赏植物和制作家具,还可提取开发其中的有效成分,如多糖、蛋白质、黄酮和生物碱等生物活性物质,根据其所具有的生物活性进行天然抗氧化、抗肿瘤等药物和保健产品的开发;而在抗氧化新型制剂的开发中,不仅可以将陕甘花楸多糖以滴丸、压片和颗粒的形式制备成抗氧化药物,也可与丝素蛋白结合制作成面膜等抗氧化产品,以达到预防氧化损伤疾病的目的。
参考文献:
CHEN C, YOU LJ, ABBASI AM, et al., 2015. Optimization for ultrasound extraction of polysaccharides from mulberry fruits with antioxidant and hyperglycemic activity in vitro[J]. Carbohyd Polym, 130:122-132.
CHEN Y, JIANG X, XIE H, et al., 2018. Structural characte-rization and antitumor activity of a polysaccharide from Ramulus mori[J]. Carbohyd Polym, 190:232-239
CHENG, KAN J, 2017. Characterization of a novel polysaccharide isolated from Rosa roxburghii Tratt fruit and assessment of its antioxidant in vitro and in vivo[J]. Int J Biol Macromol, 107:166-174.
DONG CG, 2016. Study on isolation, pupitication, structure and antioxidant activity of watersoluble polysaccharide from Moringa seed[D]. Harbin:Harbin Institute of Technology.[董成国, 2016. 辣木籽水溶性多糖的分离纯化、结构表征及其抗氧化活性研究[D]. 哈尔滨:哈尔滨工业大学.]
FENG Y, GONG XH, WEI DQ, et al., 2016. Antioxidant activity and preliminary structure analysis of polysaccharides from Cordyceps cicadas[J]. Food Sci, 37(13):19-24.[封燕, 贡小辉, 韦德群, 等, 2016. 金蝉花多糖的抗氧化活性及结构分析[J]. 食品科学, 37(13):19-24.]
GUO YH, ZHANG LJ, CAO LL, et al., 2018. Recent advances in analytical techniques for monosaccharide composition of plant polysaccharides[J]. Food Sci, 39(1):326-332.[郭元亨, 张利军, 曹丽丽, 等, 2018. 植物多糖中单糖组成分析技术的研究进展[J]. 食品科学, 39(1):326-332.]
HU TT, DAN L, YAN C, et al., 2010. Antioxidant activity of sulfated polysaccharide fractions extracted from Undaria pinnitafida in vitro[J]. Intern J Biol Macromol, 46(2):193-198.
LI B, 2011. Study on chemical constitents and biological activity of Sorbus keissleri(Schneid.) Rehd.[D]. Hangzhou:Zhejiang Gongshang University.[李波, 2011. 毛序花楸化学成分的提取分离及其生物活性研究[D]. 杭州:浙江工商大学.]
LI H, MATSUURA M, LI W, et al., 2012. Chemical consti-tuents from the fruits of Sorbus pohuashanensis[J]. Biochem Syst Ecol, 43(4):166-168.
LI XL, ZHOU AG, HAN Y, 2006. Anti-oxidation and anti-microorganism activities of purification polysaccharide from Lygodium japonicum in vitro[J]. Carbohyd Polym, 66(1):34-42.
LIU Q, SONG S, YIN ZX, et al., 2014. Study on preparation, chemical structure and antioxidant activity of polysaccharide sulfate from watermelon[J]. Food Ind Sci Technol, 35(14):107-113.[劉琴, 宋珅, 殷振雄, 等, 2014. 籽瓜多糖硫酸酯的制备工艺、化学结构及其抗氧化活性研究[J]. 食品工业科技, 35(14):107-113.]
LIU XP,ZOU YK,LIU L,et al., 2019. Comparison of structure and antioxidant activity of fruit and
seed polysaccharides from different varieties of tamarind[J]. J S Agric, 50(8):1807-1817.[刘孝平, 邹雨珂, 刘路, 等, 2019. 不同品种罗望子果肉和种子多糖结构及抗氧化活性比较[J]. 南方农业学报, 50(8):1807-1817.]
LIU Y, HUANG G, HU J, 2018. Extraction, characterisation and antioxidant activity of polysaccharides from Chinese watermelon[J]. Int J Biol Macromol, 111:1304-1307.
LIU Y, SUN Y, HUANG G, 2018. Preparation and antioxidant activities of important traditional plant polysaccharides[J]. Int J Biol Macromol, 111:780-786
TERMENTZI A, KEFALAS P, KOKKALOU E, 2006. Antioxidant activities of various extracts and fractions of Sorbus domestica fruits at different maturity stages[J]. Food Chem, 98(4):599-608.
WANG YQ, 2009.Study on the structure and biological activity of pumpkin water-soluble polysaccharides[D]. Wuhan:Huazhong Agricultural University.[王运强, 2009. 南瓜水溶性多糖的结构表征及生物活性的研究[D]. 武汉:华中农业大学.]
WANG XJ, SHAN XD, HU MH, et al., 2017. Structural cha-racterization of polysaccharide from Cyclocarya paliurus leaves and its α-glucosidase inhibitory effect[J]. Chin Trad Herb Drugs, 48(8):1524-1528.[王小江, 单鑫迪, 胡明华, 等, 2017. 青钱柳叶多糖的结构表征及其抑制α-葡萄糖苷酶活性研究[J]. 中草药, 48(8):1524-1528.]
WANG Y, WEI X, WANG F, et al., 2018. Structural characterization and antioxidant activity of polysaccharide from ginger[J]. Int J Biol Macromol, 111:862-869.
XU YQ, WANG YP, NIU XJ, et al., 2017. Preparation, structural identification and bioactivities of polysaccharides from black currant fruits[J]. Food Sci, 38(15):7-13.[徐雅琴, 王跃鹏, 牛小杰, 等, 2017. 黑穗醋栗果实多糖的制备、结构鉴定及生物活性研究[J]. 食品科学, 38(15):7-13.]
YIN J, 2013. Extraction and purification, structure analysis and study active of bamboo leaf polysaccharide[D]. Hangzhou:Zhejiang Sci-Tech University.[殷軍, 2013. 竹叶多糖的提取纯化、结构分析及活性研究[D]. 杭州:浙江理工大学.]
YU XH, LI BC, MENG YX, et al., 2014. Antioxidation activity in vitro of flavonoid glycoside extracted from Xanthoceras sorbifolia Bunge episperm[J]Food Ind,(1):199-202.[于学海, 李葆春, 孟亚雄, 等, 2014. 文冠果种皮黄酮苷的体外抗氧化活性研究[J]. 食品工业,(1):199-202.]
ZHANG WH, WENG DY, SONG HY, et al., 2018. Identification on antibacterial activity and antioxidant activity of nine Apocynaceae and Euphorbiaceae plants[J]. J S Agric, 49(1):85-90.[张伟豪,翁道玥,宋慧云,等, 2018. 9种夹竹桃科和大戟科植物抗菌和抗氧化活性测定[J]. 南方农业学报, 49(1):85-90.]
ZHANG Y, WANG W, CAI Y, et al., 2017. Purification, structural characterization and immunomodulatory and antitumor activities of a polysaccharide isolated from Mo-mordica charantia L.[J]. J Nanjing Univ Trad Chin Med, 33(1):33-39.[张逸, 王旺, 蔡寅, 等, 2017. 苦瓜多糖的纯化、结构解析及其免疫调节和抗肿瘤活性研究[J]. 南京中医药大学学报, 33(1):33-39.]
