樟子松针叶化学成分研究
2019-09-10张文治韩松王剑付美玲庞婧慧白丽明
张文治 韩松 王剑 付美玲 庞婧慧 白丽明
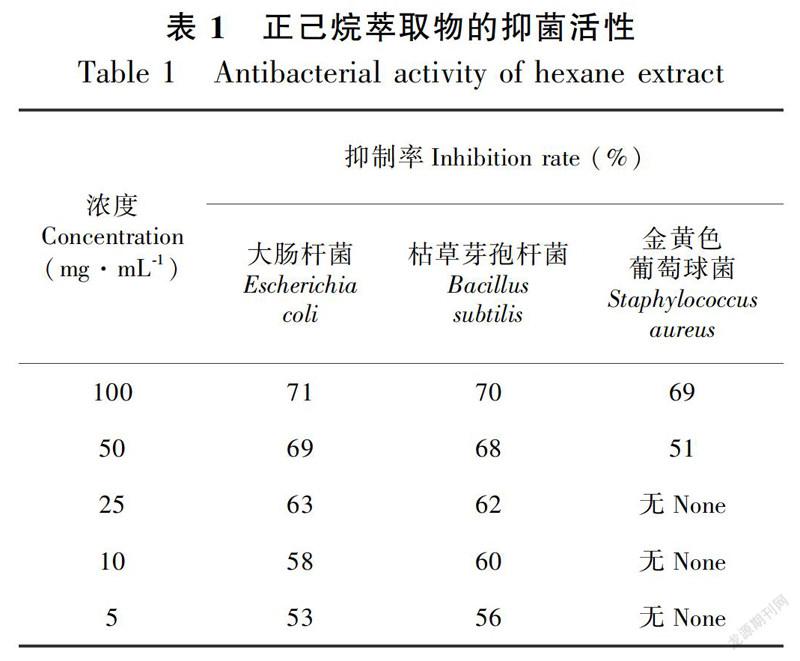


摘 要:该研究以采自黑龙江省齐齐哈尔市的樟子松(Pinus sylvestris) 针叶为对象,采用溶剂提取法对樟子松针叶中的化学成分进行提取,应用硅胶柱色谱、制备薄层色谱和高效液相色谱等现代色谱技术对提取浸膏中的化学成分进行分离和纯化,运用质谱,核磁(1H-NMR和13C-NMR) 等波谱技术,鉴定了化合物结构,并对提取浸膏的抑菌活性进行了测试。结果表明:从樟子松针叶提取物中分离得到15个化合物,分别鉴定为松叶酸(1)、松叶酸甲酯(2)、18α-acetoxylabd-8(17)-en-15-oic acid(3)、4-eplimbricataloic acid(4)、15-乙基-18-松叶酸甲酯(5)、15-acetoxy-labda-8(17),13E-dien-18-al(6)、7β-羟基脱氢枞酸(7)、7α-羟基脱氢枞酸(8)、endo-peroxide(9)、α-杜松醇(10)、β-谷甾醇(11)、邻苯二甲酸二丁酯(12)、7R,11R-phytol(13)、正二十四烷醇(14)、N-octacosan7β-ol(15)。其中,化合物9,13,14和15为首次从该属植物中分离得到。抑菌活性结果表明,正己烷萃取浸膏在浓度为5~100 mg·mL-1时对大肠杆菌和枯草芽孢菌的抑菌率分别为53%~71%和56%~70%,在浓度为50 mg·mL-1和100 mg·mL-1时对金黄色葡萄球菌的抑菌率分别为51%和69%。该研究课题进一步明确了樟子松针叶中的化学成分,为其活性测试及应用研究提供依据。
关键词:樟子松针叶, 化学成分, 抑菌活性, 松叶酸, 7-羟基脱氢枞酸, 杜松醇
中图分类号:Q946.91
文獻标识码:A
文章编号:1000-3142(2019)11-1496-09
Abstract:The chemical constituents of Pinus sylvestris needles collected from Qiqihar City in Heilongjiang Province were studied. The chemical components in the needles were extracted by solvent method. The use of column chromatography, prepared TLC, and HPLC technique led to the separation and purification of the chemical constituents in the extract. The structures for the isolated pure compounds were elucidated by analysis of spectroscopic of MS and NMR(1H-NMR and 13C-NMR). The antibacterial activity of the extract was also scanned. The results were as follows:15 compounds were isolated and identified as pinifolic acid(1), monomethyl pinifolate(2), 18α-acetoxylabd-8(17)-en-15-oic acid(3), 4-eplimbricataloic acid(4), 15-ethyl-18-methyl pinifolate(5), 15-acetoxy-labda-8(17), 13E-dien-18-al(6), 7β-hydroxydehydroabietic acid(7), 7α-hydroxydehydroabietic acid(8), endo-peroxide(9), α-cadinol(10), β-sitosterol(11), dibutyl phthalate(12), 7R,11R-phytol(13), tetracosanol(14), and N-octacosan7β-ol(15). Compounds 9, 13, 14, and 15 were isolated from the genus Pinus for the first time. The result of antibacterial activity indicated that the inhibition rate of hexane extract to Escherichia coli and Bacillus subtilis was 53%-71% and 56%-70%, respectively, on the concentration range of 5-100 mg·mL-1. And the inhibition rate to Staphylococcus aureus was 51% and 69% on the concentration of 50 mg·mL-1 and 100 mg·mL-1, respectively. This research reported the isolated chemical constituents from Pinus sylvestris needles which will provide theoretical basis for the further investigation of active components and application of drugs.
Key words:Pinus sylvestris needles, chemical constituents, antibacterial activity, pinifolic acid, 7-hydroxydehydroabietic acid, cadinol
樟子松(Pinus sylvestris var.mongholica) 又称海拉尔松,系松科松属多年生高大常绿乔木,集中分布于我国东北及内蒙古地区(中国植物志编辑委员会,1996)。其针叶部分主要含有单萜、倍半萜类挥发油(潘宁等,1992;由晓峰等,2010;薄采颖等,2010;刘敏莉等,2011)和二萜类成分(张蓉等,2006)。针叶油具有抗肿瘤(张蓉等,2006;Chen et al.,2014)、抗氧化(Ka et al.,2005;Jeong et al.,2009)、抗衰老(陈长武等,2005)、抗炎(Karonen et al.,2004)、抑菌(曾维才等,2009)、抗甲型流感病毒(魏凤香等,2008)、抗突变(孔志明等,1995)等生物活性;治疗风寒痹症(陈英等,2012)、免疫力低下(董朱等,2018)、缓解高血压(桑育黎等,2018)、改善心功能(李从阳等,2006)等药理作用,是一种具有潜在应用价值的中药材。
为深入了解樟子松针叶的化学成分,进一步探讨该植物的药理活性作用,本课题组对樟子松针叶正己烷萃取物的化学成分及抑菌活性进行研究,从中分离得到15个单体化合物,分别鉴定为松叶酸(1)、松叶酸甲酯(2)、18α-acetoxylabd-8(17)-en-15-oic acid(3)、4-eplimbricataloic acid(4)、15-乙基-18-松叶酸甲酯(5)、15-acetoxy-labda-8(17),13E-dien-18-al(6)、7β-羟基脱氢枞酸(7)、7α-羟基脱氢枞酸(8)、endo-peroxide(9)、α-杜松醇(10)、β-谷甾醇(11)、邻苯二甲酸二丁酯(12)、7R,11R-phytol(13)、正二十四烷醇(14)、N-octacosan7β-ol(15)。其中,化合物9,13,14和15为首次从该属植物中分离得到。不同浓度正己烷萃取物对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌均表现出不同程度的抑菌活性。本文报道樟子松针叶正己烷萃取物化学成分的分离和结构鉴定及抑菌活性。
1 材料与方法
1.1 供试材料、试剂和仪器
1.1.1 供试材料 樟子松针叶,于2016 年 9 月采集于黑龙江省齐齐哈尔市,经齐齐哈尔大学张树军教授鉴定为樟子松(Pinus sylvestris var. mongholica)针叶。
1.1.2 供试菌种 大肠杆菌(Escherichia coli)、枯草芽孢菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aureus),供试菌种由齐齐哈尔大学生命科学学院提供。
1.1.3 供试试剂 胰蛋白胨(北京奥博星生物技術有限责任公司)、酵母浸粉(北京奥博星生物技术有限责任公司)、氯化钠(天津市凯通化学试剂有限公司)、琼脂粉(北京奥博星生物技术有限责任公司),除高效液相色谱使用的溶剂为色谱纯(天津市科密欧化学试剂有限公司)外,其他溶剂均为分析纯(天津市凯通化学试剂有限公司)。
1.1.4 主要实验仪器 Bruker AV-600核磁共振仪(美国Bruker公司);Agilent 5988A质谱仪(美国Agilent公司);Waters 2489高效液相色谱系统(Waters科技上海有限公司);200~300目硅胶及薄层色谱板(青岛海洋化工厂);Yanako熔点仪(北京泰克仪器有限公司);YXQ-LS-50S11型立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂);SW-CJ-LED型超净工作台(上海锦屏仪器仪表有限公司通州分公司);MIR-253型恒温培养箱(上海精宏实验设备有限公司)。
1.2 实验方法
1.2.1 提取和萃取 取干燥樟子松针叶11 kg,用无水乙醇浸泡3次,合并提取液,减压蒸馏回收乙醇,得到浸膏304 g。将浸膏溶于水中形成混悬溶液,依次用正己烷、乙酸乙酯和正丁醇各萃取3次。分别合并各部位萃取液,减压蒸馏回收溶剂,得到正己烷萃取物(85 g)、乙酸乙酯萃取物(82 g)和正丁醇萃取物(44 g)。
1.2.2 分离纯化 正己烷萃取物(85 g)经硅胶柱色谱进行梯度洗脱(正己烷∶乙酸乙酯=100∶0~0∶100),经薄层色谱监测得到5个流分(Fr.1-5),Fr.3经硅胶柱色谱分离(正己烷∶乙酸乙酯=7∶3,4∶6,2∶8),得到3个流分(Fr.3.1-3.3),Fr.3.2经HPLC[Cosmosil 5C18 AR-II(10 mm × 250 mm),水∶甲醇=5∶95,流速2 mL·min-1]得到化合物1(12.5 mg),化合物2(9.6 mg)和化合物3(9.4 mg),Fr.2经硅胶柱色谱分离(正己烷∶乙酸乙酯=8∶2,6∶4,4∶6,2∶8)得到化合物4(7.4 mg)、化合物5(7.8 mg)和化合物6(32.4 mg),Fr.4经硅胶柱色谱分离(正己烷∶乙酸乙酯=6∶4,4∶6,2∶8),得到3个流分(Fr.4.1-4.3),Fr.4.2经重结晶(乙酸乙酯)得到化合物7(12.4 mg)和化合物8(32.4 mg),Fr.4.3经HPLC[Cosmosil 5C18 AR-II(10 mm × 250 mm),水∶甲醇=15∶85,流速2 mL·min-1]得到化合物9(23.6 mg),Fr.1经硅胶柱色谱分离(正己烷∶乙酸乙酯=1∶9,2∶8,3∶7,4∶6,2∶8),得到5个流分(Fr.1.1-1.5),Fr.1.2经HPLC[Cosmosil 5C18 AR-II(10 mm × 250 mm),水∶甲醇=5∶95,流速2 mL·min-1]得到化合物10(23.6 mg),Fr.1.3经过重结晶(乙酸乙酯)得到化合物11(17.5 mg),Fr.1.4经过重结晶(乙酸乙酯)得到化合物12(7.4 mg),Fr.1.5经HPLC[Cosmosil 5C18 AR-II(10 mm × 250 mm),水∶甲醇=5∶95,流速2 mL·min-1]得到化合物13(15.2 mg),化合物14(12.3 mg)和化合物15(15.2 mg)。
1.2.3 抑菌活性实验 将正己烷萃取物以丙酮为溶剂,配制浓度分别为100、50、25、10、5 mg·mL-1溶液,用于抑菌活性测定。采用LB培养基,通过平板培养皿培养法,对上述不同浓度萃取物药液进行抑菌活性实验测定,以丙酮作对照,每组3次平行实验。当对照组的菌落直径长至培养皿底部的3/4时,用十字交叉法(於祥和陈娅芳,2018;郑锋等,2016)测量菌落直径,并通过以下公式计算抑菌率。
菌落直径(cm)=直径平均数-0.4(菌饼的直径);
抑制率(%)=对照菌落直径-处理菌落直径对照菌落直径×100。
2 结果与分析
2.1 结构鉴定
化合物1 黄色无定型粉末(乙酸乙酯),mp=246 ~ 268 ℃, EI-MS m/z:336[M]+, 分子式为C20H32O4, 1H-NMR(600 MHz, CDCl3) δ:0.71(3H, s, H-20), 0.98(3H, d, J= 6.6 HZ, H-16), 1.15(3H, s, H-19), 4.50(1H, br s, H-17a), 4.82(1H, br s, H-17b); 13C-NMR(150 MHz, CDCl3) δ:14.7(q, C-20), 16.3(q, C-19), 18.4(t, C-2), 20.0(q, C-16), 20.7(t, C-11), 26.8(t, C-6), 30.8(d, C-13), 35.6(t, C-12), 37.1(t, C-3), 37.8(t, C-7), 38.0(t, C-1), 39.0(s, C-10), 41.1(t, C-14), 47.5(s, C-4), 49.6(d, C-5), 57.0(d, C-9), 107.0(t, C-17), 147.9(s, C-8), 178.6(s, C-15), 184.4(s, C-18)。与文献(Carreras et al.,1998) 数据基本一致,因此,鉴定化合物1为松叶酸。
化合物2 白色粉末(乙酸乙酯),mp=216~218 ℃, EI-MS m/z:350[M]+, 分子式为C21H34O4, 1H-NMR(600 MHz, CDCl3) δ:0.98(3H, d, J= 7.1 Hz, H-16), 1.14(3H, s, H-19), 2.72(3H, s, H-20), 3.66(3H, s, H-21), 4.49(1H, br s, H-17a), 4.82(1H, br s, H-17b); 13C-NMR(150 MHz, CDCl3) δ:14.7(q, C-20), 16.6(q, C-19), 18.5(t, C-2), 19.9(q, C-16), 20.8(t, C-11), 26.8(t, C-6), 31.0(d, C-13), 35.8(t, C-12), 37.0(t, C-7), 37.9(t, C-1), 38.1(t, C-3), 39.1(s, C-10), 41.6(t, C-14), 47.8(s, C-4), 49.9(d, C-5), 51.9(q, C-21), 57.1(d, C-9), 106.9(t, C-17), 148.0(s, C-8), 179.35(s, C-15), 179.4(s, C-18)。與文献(Zinkel et al.,1985)报道的数据基本一致,故鉴定化合物2为monomethyl pinifolate。
化合物3 白色无定形粉末(乙酸乙酯),mp=217 ~ 219 ℃, EI-MS m/z:364[M]+, 分子式为C22H36O4, 1H-NMR(600 MHz, CDC13) δ:0.72(3H, s, H-20), 0.88(3H, s, H-19), 0.97(3H, J= 6.3 Hz, H-16), 2.04(3H, s, H-22), 3.71(1H, d, J= 10.9 Hz, H-18a), 3.82(1H, d, J= 10.9 Hz, H-18b), 4.49(1H, br s, H-17a), 4.82(1H, br s, H-17b); 13C-NMR(150 MHz, CDCl3) δ:14.9(q, C-20), 17.5(q, C-19), 18.5(t, C-2), 19.9(q, C-16), 21.0(q, C-22), 21.1(t, C-11), 24.3(t, C-6), 30.9(d, C-13), 35.8(t, C-12), 35.9(t, C-3), 36.9(s, C-4), 38.0(t, C-7), 38.5(t, C-1), 39.6(s, C-10), 41.4(t, C-14), 49.5(d, C-5), 57.2(d, C-9), 73.0(t, C-18), 106.7(t, C-17), 148.1(s, C-8), 171.3(s, C-21), 179.2(s, C-15)。与文献(Francesca et al.,1999)报道的基本一致,因此,鉴定化合物3为18α-acetoxylabd-8(17)-en-15-oic acid。
化合物4 黄色无定型粉末(乙酸乙酯),mp=224 ~ 226 ℃, EI-MS m/z:320[M]+, 分子式为C20H32O3, 1H-NMR(600 MHz, CDCl3) δ:0.71(3H, s, H-20), 0.98(3H, d, J= 6.6 HZ, H-16), 1.14(3H, s, H-19), 4.49(1H, br s, H-17a), 4.83(1H, br s, H-17b), 9.76(1H, s, H-15); 13C-NMR(150 MHz, CDCl3) δ:14.7(q, C-20), 16.4(q, C-19), 18.4(t, C-2), 20.18(t, C-11), 20.2(q, C-16), 26.8(t, C-6), 28.9(d, C-13), 36.0(t, C-12), 37.1(t, C-7), 37.15(t, C-3), 38.0(t, C-1), 39.0(s, C-10), 47.5(s, C-4), 49.6(d, C-5), 50.9(t, C-14), 57.1(d, C-9), 107.0(t, C-17), 147.9(s, C-8), 183.9(s, C-18), 203.1(d, C-15)。与文献(Zinkel et al.,1985)数据基本一致,因此,鉴定化合物4为4-eplimbricataloic acid。
化合物5 黄色无定型粉末(乙酸乙酯),mp=209 ~ 211 ℃, EI-MS m/z:378[M]+, 分子式为C23H38O4, 1H-NMR(600 MHz, CDCl3) δ:1.26(3H, d, J= 7.1 Hz, H-22), 3.66(3H, s, H-23), 4.13(2H, t, J= 7.1 Hz, H-21), 4.49(1H, br s, H-17a), 4.81(1H, br s, H-17b); 13C-NMR(150 MHz, CDCl3) δ:14.3(q, C-22), 14.7(q, C-20), 16.6(q, C-19), 18.5(t, C-2), 20.0(q, C-16), 20.8(t, C-11), 26.8(t, C-6), 31.0(d, C-13), 35.8(t, C-12), 37.0(t, C-3), 37.1(t, C-7), 38.1(t, C-1), 39.1(s, C-10), 41.7(t, C-14), 47.8(s, C-4), 49.9(d, C-5), 51.9(q, C-23), 57.1(d, C-9), 60.1(t, C-21), 106.9(t, C-17), 148.0(s, C-8), 173.3(s, C-15), 179.4(s, C-18)。與文献(张蓉等,2006)数据基本一致,故鉴定化合物5为15-乙基-18-松叶酸甲酯。
化合物6 淡黄色无定型粉末(乙酸乙酯),mp=233 ~ 234 ℃, EI-MS m/z:346[M]+, 分子式为C22H34O3, 1H-NMR(600 MHz, CDCl3) δ:0.70(3H, s, H-20), 0.97(3H, d, J= 6.6 HZ, H-16), 1.04(3H, s, H-19), 4.59(1H, br s, H-17a), 4.86(1H, br s, H-17b), 9.24(1H, s, H-18); 13C-NMR(150 MHz, CDCl3) δ:14.2(q, C-19), 14.7(q, C-20), 16.5(q, C-16), 17.7(t, C-2), 21.1(q, C-22), 21.1(t, C-11), 26.7(t, C-6), 32.3(t, C-3), 37.5(t, C-7), 37.8(t, C-12), 38.2(t, C-1), 38.4(s, C-10), 47.6(d, C-5), 49.9(s, C-4), 56.2(d, C-9), 61.4(t, C-15), 107.4(t, C-17), 118.2(d, C-14), 142.6(s, C-13), 147.2(s, C-8), 171.1(s, C-21), 206.4(d, C-18)。与文献(张蓉等,2006)数据基本一致,故鉴定化合物6为15-acetoxy-labda-8(17),13E-dien-18-al。
化合物7 无色针晶(乙酸乙酯),mp=105 ~ 107 ℃, EI-MS m/z:316[M]+, 分子式为C20H28O3, 1H-NMR(600 MHz, CDCl3) δ:1.23(2 × 3H, d, J=6.9 Hz, H-16/17), 1.29(2 × 3H, s, H-19/20), 2.88(1H, m, H-15), 4.91(1H, dd, J=7.5, 2.0 Hz, H-7), 7.10(1H, dd, J=8.2, 1.5 Hz, H-12), 7.16(1H, d, J=8.2 Hz, H-11), 7.38(1H, d, J=1.5 Hz, H-14); 13C-NMR(150 MHz, CDCl3) δ:15.7(q, C-19), 17.8(t, C-2), 23.3(q, C-16), 23.5(q, C-17), 24.9(q, C-20), 32.2(t, C-6), 33.1(d, C-15), 35.7(t, C-3), 37.0(s, C-10), 37.4(t, C-1), 42.8(d, C-5), 46.5(s, C-4), 70.1(d, C-7), 123.6(d, C-11), 124.6(d, C-12), 125.3(d, C-14), 136.8(s, C-8), 146.0(s, C-13), 146.4(s, C-9), 183.3(s, C-18) 。与文献(芦毅和华燕,2011)数据基本一致,因此,鉴定化合物7为7β-羟基脱氢枞酸。
化合物8 无定形粉末(乙酸乙酯),mp=107 ~ 110 ℃, EI-MS m/z:316[M]+, 分子式为C20H28O3, 1H-NMR(600 MHz, CDCl3) δ:1.16(3H, s, H-20), 1.23(2 × 3H, d, J=7.0 Hz, H-16/17), 1.26(3H, s, H-19), 2.87(1H, m, H-15), 4.53(1H, br s, H-7), 7.13(1H, dd, J=8.2, 1.8 Hz, H-12), 7.18(1H, d, J=1.8 Hz, H-14), 7.19(1H, d, J=8.2 Hz, H-11); 13C-NMR(150 MHz, CDCl3) δ:16.6(q, C-19), 18.6(t, C-2), 23.9(q, C-17), 24.1(q, C-16), 24.2(q, C-20), 30.9(t, C-6), 33.5(d, C-15), 36.3(t, C-3), 37.4(s, C-10), 37.7(t, C-1), 39.8(d, C-5), 47.0(s, C-4), 68.3(d, C-7), 124.2(d, C-12), 126.7(d, C-11), 128.3(d, C-14), 135.6(s, C-8), 146.6(s, C-9), 146.7(s, C-13), 182.8(s, C-18)。与文献(张蓉等,2006)基本一致,因此,鉴定化合物8为7α-羟基脱氢枞酸。
化合物9 黄色油状物,EI-MS m/z:334[M]+, 分子式为C20H30O4, 1H-NMR(600 MHz, CDCl3) δ:0.58(3H, s, H-19), 0.99-2.49(15H, m), 1.04-1.13(2 × 3H, d, J= 7.0 Hz, H-16/H-17), 1.16(3H, s, H-18), 2.51(1H, qd, J= 7.0 Hz, H-15), 4.60(1H, br s, H-12)5.84(1H, s, H-14); 13C-NMR(150 MHz, CDCl3) δ:15.1(q, C-16), 16.3(q, C-17), 17.0(CH2), 20.1(q, C-20), 20.4(q, C-19), 21.6(CH2), 25.0(CH2), 31.0(CH), 32.1(CH2), 36.2(CH2), 36.6(CH2), 36.8(CH), 43.2(CH), 48.8(C), 50.0(C), 74.6(s, C-8), 76.9(d, C-12), 124.6(d, C-14), 149.1(s, C-13), 184.2(s, C-18)。与文献(Ayer & Macaulay,1987)基本一致,因此,鉴定化合物9为endo-peroxide。
化合物10 黄色油状物,EI-MS m/z:222[M]+, 分子式为C15H26O, 1H-NMR(600 MHz, CDCl3) δ:0.77(3H, d, J= 6.9 Hz, H-14), 0.92(3H, d, J= 7.2 Hz, H-13), 1.05(1H, m, H-7), 1.11(3H, s, H-15), 1.22(1H, m, H-9), 1.24(1H, m, H-1), 1.41(1H, m, H-9), 1.59(2H, m, H-2), 1.67(3H, s, H-11), 1.72(1H, m, H-6), 1.79(1H, m, H-10), 1.98(2H, m, H-3), 2.00(2H, m, H-9), 2.18(1H, m, H-12), 5.50(1H, br s, H-5); 13C-NMR(150 MHz, CDCl3) δ:15.8(q, C-14), 21.0(q, C-15), 21.7(q, C-13), 22.0(t, C-2), 22.8(t, C-8), 23.2(d, C-11), 29.9(d, C-6), 30.7(t, C-3), 37.2(q, C-12), 42.0(t, C-9), 46.1(d, C-7), 50.8(d, C-1), 72.1(s, C-10), 122.1(d, C-5), 133.8(s, C-4)。与文献(Bottini et al.,1987;Tanaka et al.,1997)基本一致,因此,鉴定化合物10为α-杜松醇。
化合物11 白色晶体(乙酸乙酯),mp=139 ~ 142 ℃, EI-MS m/z:414[M]+, 分子式为C29H50O, 1H-NMR(600 MHz, CDCl3) δ:0.68(3H, s, H-18), 0.82(3H, d, J= 7.0 Hz, H-27), 0.83(3H, d, J= 7.0 Hz, H-26), 0.84(3H, d, J= 7.0 Hz, H-29), 0.93(3H, d, J= 6.8 Hz, H-21), 1.01(3H, s, H-19), 3.54(1H, m, H-3), 5.35(1H, br d, J= 3.6 Hz, H-6); 13C-NMR(150 MHz, CDCl3) δ:11.9(q, C-29), 12.0(q, C-19), 18.8(q, C-21), 19.0(q, C-26), 19.4(q, C-18), 19.8(t, C-1), 21.1(t, C-2), 23.1(q, C-27), 24.3(d, C-14), 26.1(t, C-15), 28.2(t, C-11), 29.2(t, C-12), 30.5(t, C-28), 31.7(t, C-16), 31.9(t, C-22), 34.0(d, C-25), 36.2(d, C-24), 36.5(d, C-23), 37.3(d, C-20), 39.8(d, C-17), 42.3(s, C-13), 42.32(s, C-10), 45.8(t, C-7), 50.1(d, C-8), 56.1(d, C-9), 56.8(t, C-4), 71.8(d, C-3), 121.7(d, C-6), 140.8(s, C-5)。與文献(康淑荷等,2008;张博等,2009)基本一致,因此,鉴定化合物11为β-谷甾醇。
化合物12 黄色油状物,EI-MS m/z:278[M]+, 分子式为C16H22O4, 1H-NMR(600 MHz, CDCl3) δ:0.70(3H, d, J=6.8 Hz, H-4′), 1.19(2H, m, H-3′), 1.45(2H, m, H-2′), 4.06(2H, m, H-1′), 7.25(1H, d, J=7.2 Hz, H-4), 7.47(1H, d, J=7.2 Hz, H-3); 13C-NMR(150 MHz, CDCl3) δ:12.7(q, C-4′), 18.3(t, C-3′), 29.7(t, C-2′), 64.3(t, C-1′), 127.9(d, C-3), 130.0(d, C-4), 131.6(s, C-2), 166.4(s, C-1)。与文献(Hoang et al.,2008)基本一致,因此,鉴定化合物12为邻苯二甲酸二丁酯。
化合物13 淡黄色油状物,EI-MS m/z:296[M]+, 分子式为C20H40O, 1H-NMR(600 MHz, CDCl3) δ:0.84(3H, d, J=6.8 Hz, H-19), 0.86(3H, J=6.5 Hz, H-18), 0.88(2 × 3H, d, J=6.5 Hz, H-16/H-17), 1.25(8H, m, H-6, 8, 10, 12), 1.14(2H, m, H-14), 1.28(4H, m, H-9, 13), 1.37(2H, m, H-7, 11), 1.39(2H, m, H-5), 1.53(1H, m, H-15), 1.67(3H, s, H-20), 2.00(2H, m, H-4), 4.16(2H, m, H-1), 5.41(1H, m, H-2); 13C-NMR(150 MHz, CDCl3) δ:16.2(q, C-16), 19.7(q, C-17), 19.8(q, C-18), 22.7(q, C-19), 23.7(q, C-20), 24.5(t, C-9), 24.8(t, C-13), 25.1(t, C-5), 28.0(d, C-15), 32.7(d, C-7), 32.8(d, C-11), 36.7(t, C-6), 37.3(t, C-12), 37.4(t, C-10), 37.42(t, C-8), 39.4(t, C-14), 39.9(t, C-4), 59.5(t, C-1), 123.1(d, C-2), 140.4(s, C-3)。与文献(Brown et al.,2003)基本一致,因此,鉴定化合物13为7R,11R-phytol。
化合物14 白色粉末(乙酸乙酯),mp=75 ~ 77 ℃, EI-MS m/z:340[M]+, 分子式为C24H50O, 1H-NMR(600 MHz, CDCl3) δ:0.88(3H, d, J=6.8 Hz, H-24)为末端甲基氢信号, 1.30~1.62(CH2), 3.64(2H, m, H-1) 为与氧相连的氢质子信号;13C-NMR(150 MHz, CDCl3) δ:14.1为末端甲基碳信号, 22.7~33.2(22 × CH2), 63.1为与氧相连的碳信号。与文献(张倩等,2004)基本一致,因此,鉴定化合物14为正二十四烷醇。
化合物15 白色晶体(乙酸乙酯),mp=74 ~ 75 ℃, EI-MS m/z:410[M]+, 分子式为C28H58O, 1H-NMR(600 MHz, CDCl3) δ:0.95(3H, d, J= 6.8 Hz, H-28), 0.98(3H, d, J= 6.8 Hz, H-1), 1.34(34H, m, 17 × CH2), 1.51(8H, m, 4 × CH2), 1.70(4H, m, 2 × CH2), 2.14(2H, m, H-8), 2.36(2H, m, H-6), 3.66(1H, br m, H-7α); 13C-NMR(150 MHz, CDCl3) δ:14.1(C-1, C-28), 22.7(CH2), 25.7(CH2), 29.3(CH2), 29.4(CH2), 29.6(5 × CH2), 29.7(13 × CH2), 31.9(2 × CH2), 37.5(CH2), 72.0(d, C-7)。与文献(Jameel et al.,2014)基本一致,因此,鉴定化合物15为N-octacosan7β-ol。
2.2 抑菌活性实验结果
不同浓度正己烷萃取物对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌的抑菌活性实验结果如表1所示。结果表明,正己烷萃取物对上述三种病原菌均显示不同程度的抑制效果,其中,在测试浓度范围内,正己烷萃取物对大肠杆菌和枯草芽孢杆菌的抑制率均大于50%,浓度在50 mg·mL-1和100 mg·mL-1时对金黄色葡萄球菌的抑制率分别是51%和69%,浓度范围在5~25 mg·mL-1时,对金黄色葡萄球菌没有抑菌作用。
3 讨论与结论
樟子松作为一种松属植物,目前国内外对其针叶的研究报道主要集中于挥发油和精油的GC-MS分析,主要采取水蒸氣蒸馏法,针叶油药理作用研究主要集中于抗肿瘤(张蓉等,2006; Chen et al.,2014)、抗氧化(Ka et al.,2005;Jeong et al.,2009)、抗炎(Karonen et al.,2004)、抑菌(曾维才等,2009)和抗病毒(魏凤香等,2008)等方面,除了张蓉课题组报道了松针中化学成分的分离,此外,对松针中单体化合物的分离及抗细菌作用研究却少有报道。本研究采用溶剂提取法,以无水乙醇为溶剂,对樟子松针叶中的化学成分进行提取,并对提取浸膏进行了梯度萃取,得到不同极性的正己烷、乙酸乙酯和正丁醇萃取物。采用柱色谱、薄层色谱和高效液相色谱对正己烷萃取物中的化学成分进行分离纯化,运用核磁、质谱等波谱技术,经波谱数据分析对分离得到的化合物进行了结构鉴定。抑菌活性实验研究表明,正己烷萃取物在浓度为5、10、25、50、100 mg·mL-1时,对大肠杆菌的抑制率分别为53%、58%、63%、69%和71%;对枯草芽孢杆菌的抑制率分别为56%、60%、62%、68%和70%;在浓度为50 mg·mL-1和100 mg·mL-1时,对金黄色葡萄球菌的抑制率分别为51%和69%。
本研究结果表明,通过对正己烷萃取物化学成分的分离和纯化,并经过结构鉴定得到15个化合物,其中有4个化合物为首次从该属植物中分离得到。樟子松针叶正己烷萃取物在一定浓度范围内对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌具有不同程度的抑制作用,本研究结果可为樟子松针叶作为植物源药物的进一步研究和开发提供理论及实验依据。
参考文献:
AYER WA, MACAULAY JB, 1987. Metabolites of the honey mushroom Armillaria mellea[J]. Can J Chem, 65(65):7-14.
BOTTINI AT, GARFAGNOLI DJ, DELGADO LS, et al., 1987. Sesquiterpene alcohols from Hedychium spicatum var. acuminatum[J]. J Nat Prod, 50(4):732-734.
BROWN GD, LIANG GY, SY LK, 2003. Terpenoids from the seeds of Artemisia annua[J]. Phytochemistry, 64(1):303-323.
CARRERAS CR, ROSSOMANDO PC, GIORDANO OS, 1998. Ent-labdanes in eupatorium buniifolium[J]. Phytochemistry, 48(6):1031-1034.
CHEN CW, CHANG YQ, QU HG, et al., 2005. Experimental study of pine needle on anti-aging[J]. Food Science, 26(9):465-467.[陈长武, 昌友权, 曲红光, 等, 2005. 松针提取物抗衰老氧化作用研究[J].食品科学, 26(9):465-467.]
CHEN W, XU B, MAO J, et al., 2014. Inhibitory effects of apinene on Hepatoma carcinoma cell proliferation[J]. Asian Pac J Canc P, 15(7):3293-3297.
CHEN Y, LIU CG, ZHAO YZ, et al., 2012. Advances in functional components of pine needles and its application[J]. J Anhui Agric Sci, 40(10):5994-5996.[陈英, 刘成国, 赵毓芝, 等, 2012. 松针功能性成分及应用研究进展[J]. 安徽农业科学, 40(10) :5994-5996.]
DONG Z, FAN H, WANG LP, 2018. Advances in anti-tumor mechanisms of pine needles[J]. Chin J Trad Med Sci Technol, 25(2):307-309.[董朱, 范辉, 王良萍, 2018. 松针抗肿瘤作用机制的研究进展[J]. 中国中医药科技, 25(2): 307-309.]
Editorial Committee of Flora Reipublicae Popularis Sinicae, 1996. Flora Reipublicae Popularis Sinicae[M]. Beijing:Science Press:152-153.[中国科学院中国植物志编辑委员会, 1996. 中国植物志[M]. 北京:科学出版社:152-153.]
FRANCESCA F, CECILIA L, REN T, et al., 1999. Diterpenes from Haplopappus chrysanthemifolius[J]. Phyto-chemistry, 52(8):1547-1550.
HOANG VL, LI Y, KIM SK, 2008. Cathepsin B inhibitory activities of phthalates isolated from a marine Pseudomonas strain[J]. Bioorg Med Chem Lett, 18(6):2083-2088.
JAMEEL M, ISLAMUDDIN M, ALI A, et al., 2014. Isolation, characterization and antimicrobial evaluation of a novel compound N-octacosan 7β ol, from Fumaria parviflora Lam[J]. Evid-based Compl Altern, 14(98):1-9.
JEONG JB, SEO EW, JEONG HJ, 2009. Effect of extracts from pine needle against oxidative DNA damage and apoptosis induced by hydroxyl radical via antioxidant activity[J]. Food Chem Toxico, 47(8):2135-2141.
KANG SH, SHI YQ, YANG CX, et al., 2008. Triterpenoids and steroids of root of Rubus biflorus[J]. J Chin Med Mat, 31(11):1669-1671.[康淑荷, 师永清, 杨彩霞, 等, 2008. 粉枝莓根中的三萜及甾体化合物[J]. 中药材, 31(11):1669-1671.]
KONG ZM, QIAO QR, XU YJ, et al., 1995. The suppressing effect of pine needle extracts on micronuclei and SCEs in human peripheral blood lymphocyte induced by cyclophosphamide[J]. Teratogen Carcin Mut, 17(7):349-351.[孔志明, 喬全荣, 徐玉军, 等, 1995. 松针提取物拮抗环磷酞胺诱发人外周血淋巴细胞微核及SCE的研究[J]. 癌变·畸变·突变, 17(7):349-351.]
LI CY, MIAO WN, SHAN HM, 2006. Effects of essential oils in pine needles for the blood pressure and LVH in 2k1c hypertensive rats[J]. Chin J Pract Chin Mod Med, 19(4):369-370.[李从阳, 苗维纳, 单红梅, 2006. 松针挥发油对双肾一夹高血压大鼠血压及左心室肥大的影响[J]. 中华实用中西医杂志, 19(4):369-370.]
LU Y, HUA Y, 2011. Abietane diterpenes from Callicarpa pedunculata[J]. Nat Prod Res Dev, 23(1):66-68.[芦毅, 华燕, 2011. 紫珠的松香烷型二萜成分研究[J]. 天然产物研究与开发, 23(1):66-68.]
MAARIT K, MARI H, RIINA N, et al., 2004. Phenolic extractives from the bark of Pinus sylvestris L. and their effects on inflammatory mediators nitric oxide and prostaglandin E2[J]. J Agric Food Chem, 52:7532-7540.
PAN N, YAN ZM, NIU ZD, 1992. GC-MS analysis of essential oils in needles of Pinus in northeastern China[J]. J Chin Mat Med, 17(3):166-168.[潘宁, 严仲铭, 牛志多, 1992. 中国东北松属植物叶中精油的气一质谱分析[J]. 中国中药杂志, 17(3):166-168.]
SANG YL, ZHANG YJ,GAO TX, et al., 2018. Research advance on pine needle oil[J]. J Liaoning Univ, 45(2):162-169.[桑育黎, 张芸嘉, 高天祥, 等, 2018. 松针挥发油研究进展[J]. 辽宁大学学报, 45(2):162-169.]
TANAKA R, OHTSU H, MATSUNAGA S, 1997. Abietane diterpene acids and other constituents from the leaves of Larix kaempferi[J]. Phytochemistry, 46(6):1051-1057.
WEI FX, LI MY, WANG X, et al., 2008. Experimental study on the anti-influenza A virus effect of pine needle oil[J]. Chin J Geront, 28(8):1584-1586.[魏凤香, 李美玉, 王昕, 等, 2008. 松针油抗甲型流感病毒的实验研究[J]. 中国老年学杂志, 28(8):1584-1586.]
YOU XF, FANG HZ, SUN CH, 2010. Study on chemical components of the volatile oil in pine needles of scotch pine from different months[J]. Chin J Pharm Anal, 30(7):1199-1204.[由晓峰, 方洪壯, 孙长海, 2010. 不同月份樟子松针叶挥发油的成分分析[J]. 药物分析杂志, 30(7):1199-1204.]
YU X, CHEN YF, 2018. Evaluation of 2,3-diphenyl-4-thiazolidinone derivatives as antifungal agents[J]. Chem Bull, 81(8): 759-762.
ZHANG B, SUN JM, CHANG RL, et al., 2009. Studies on the chemical constituents of the root and rhizome of Ligusticum jeholense[J]. J Chin Med Mat, 32(5):710-712.[张博, 孙佳明, 常仁龙, 等, 2009. 辽藁本化学成分研究[J]. 中药材, 32(5):710-712.]
ZENG WC, JIA LR, 2009.Antimicrobial activities of pine needle extracts[J]. Food Sci, 30(7):87-90.[曾维才, 贾利蓉, 2009. 松针提取物抑菌作用的研究[J]. 食品科学, 30(7):87-90.]
ZHANG Q, QU GR, GUO HM, et al., 2004. Study on the chemical constituents from Broussonetia papyrifera inflorenscence[J]. J Chin Med Mat, 27(3):182-183.[张倩, 渠桂荣, 郭海明, 等, 2004. 雄构树花序化学成分研究[J]. 中药材, 27(3):182-183.]
ZHANG R, DUAN HQ, YAO Z, et al., 2006. Study on diterpenes in needles of Pinus sylvestris[J]. J Chin Mat Med, 31(23):1956-1959.[张蓉, 段宏泉, 姚智, 等, 2006. 樟子松针叶中二萜类成分研究[J]. 中国中药杂志, 31(23):1956-1959.]
ZHENG F, WANG YF, ZHANG YB, et al., 2016. Antimicrobialactivity of cinnamon oil in foods based on Modified Gompertz model[J]. Mod Food Sci Technol, 32(6):188-193.[郑锋, 王一非, 张赟彬, 等, 2016. 基于Modified Gompertz研究食品模型中肉桂精油的抑菌活性[J]. 现代食品科技, 32(6):188-193.]
ZINKEL DF, MAGEE TV, WALTER J, 1985. Major resin acids of Pinus nigra needles[J]. Phytochemistry, 24(6):1273-1277.
