売寡糖降脂活性概述
2019-09-10沈欣赵梦瑶赵黎明
沈欣 赵梦瑶 赵黎明
壳寡糖是自然界中唯一的天然阳离子化合物,因其水溶性好、生物活性高、易被吸收等特点被广泛应用在食品、药物、农业和环境等各个领域,具有较高的研究潜力和应用价值本文归纳了壳寡糖的主要生理活性,聚焦壳寡糖的降脂功能,对国内外有关壳寡糖降脂作用效果及机制的一些研究进展进行了综述,为相关保健食品的开发提供理论依据。
甲壳素(壳聚糖)是自然界丰富存在的一种天然含氮多糖,其生物产生量仅次于纤维素,是甲壳动物(如螃蟹和昆虫)壳的主要成分,由于其糖单元的2位碳原子上连接一个乙酰氨基或氨基,因此具备十分丰富的生理活性作为甲壳素的降解产物,壳寡糖(chito-oligosaccharides,COS)是由2〜10个D-氨基葡萄糖或少量N-乙酰-D-氨基葡萄糖通过β-1,4糖苷键连接而成的低聚糖,具有水溶性好、低细胞毒性、易于被肠道吸收等特点。随着人们对壳寡糖研究的深入,有关壳寡糖的生理活性及其应用的认知也越来越丰富,如免疫调节、抗肿瘤、辅助治疗II型糖尿病、抗炎、抗氧化等,目前,壳寡糖已广泛应用于食品、药品及农业等领域。
壳寡糖的多种生物活性,例如抗氧化、抗菌、抗癌和免疫调协作用,都取决于其本身的分子结构和物化学性质,如聚合度、脱乙酰度、电荷分布和化学修饰壳寡糖的脱乙酰度越高,分子中含有的游离氨基数量越多,因此脱乙酰度是决定壳寡糖溶解度和生理活性的关键参数与高聚合度的壳聚糖不同,较低聚合度或分子量的壳寡糖易被肠道吸收,进入血液并在生物体内发挥生理活性,且研究已经证实,不同聚合度的壳寡糖的生理活性也不同。因此,聚合度及分子量也被认为是壳寡糖的主要特征,并与其生理活性高度相关。
壳寡糖的主要生理活性
抗氧化活性
氧化损伤已被证实是多种慢性疾病的潜在原因,预防性抗氧化剂作为自由基的清除剂可以在不同水平上破坏氧化进程。对此,人们越来越注重从天然物质中寻找天然抗氧化剂以克服生物体内过多自由基造成的损伤。目前包括碳水化合物、寡肽和一些酚类化合物在内的许多功能因子,已被确认为有效的由基清除剂。其中,壳寡糖已被证明在体外和体内都具有优异的抗氧化活性。
抗炎活性
目前,大多数研究采用脂多糖(lipopolysaccharides,LPS)或其他刺激物诱导细胞和动物产生炎症反应,采用壳寡糖处理后,发现其可显著抑制巨噬细胞中LPS诱导的炎症反应,预防LPS诱导的脓毒症小鼠死亡,并且其抗炎活性随着脱乙酰度的增加呈现递增趋势。
机体免疫调节
免疫系统包括先天性免疫和适应性免疫两个部分,其在消除病原体和外來物质方面起着非常重要的作用。通过建立体内外模型进行研究,壳寡糖已被证明可以刺激巨噬细胞分泌TNF-α和IL-1,有望促进先天性免疫和适应性免疫。
肿瘤细胞抑制
壳寡糖已被报道可以利用其免疫增强作用来抑制肿瘤细胞的生长,一些相关研究的结果表明,壳寡糖可促进淋巴因子的产生,通过细胞溶解性T淋巴细胞的增殖达到抗肿瘤作用。同时,壳寡糖可以抑制癌细胞的生长、转移和侵袭,从多维度阻断癌症恶化,但目前对壳寡糖抗肿瘤活性的作用机制尚不十分明确,且不同聚合度和脱乙酰度的壳寡糖对于不同肿瘤细胞的作用也显著不同。
降血糖作用
糖尿病是以由不适当的胰岛素分泌(I型糖尿病)或出现胰岛素抵抗(II型糖尿病)导致的血糖代谢障碍。一些初步的研究表明,壳寡糖可以著改善糖尿病前期受试者的餐后血清葡萄糖、糖化血红蛋白(HbAlc)、促炎细胞因子(如IL-6,TNF-α)和脂联素水平。另外,壳寡糖被证明可以抑制碳水化合物水解酶,以此降低糖尿病小鼠血浆中的葡萄糖和HbAlc水平。这些结果都表明壳寡糖具有较好的降血糖作用。
非酒精性脂肪肝病
非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)及其亚型非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)正在成为全球慢性肝病的主要病因。由于日益城市化的生活方式和饮食变化,肥胖人群不断增多,NAFLD的患病率在过去10年中逐年递增。在美国,NAFLD发病率远远超过丙型肝炎或酒精性肝病,占据欧美等发达国家中慢性肝病的首位,其病程包括单纯性脂肪肝以及由此演变的NASH和肝硬化。NAFLD的病理学涉及环境、遗传、代谢因素以及肠道微生物群和其产物的改变。NAFLD的主要临床指标为引起肝脏脂积累≥5%的肝重,根据发病缘由,其可以分为原发性和继发性。原发性的非酒精性脂肪肝相对常见,多与肥胖、II型糖尿病、高脂血症等与胰岛素抵抗相关的代谢综合征相关。继发性非酒精性脂肪肝则可由病毒性肝炎、药物以及环境毒素引起。
长期以来,医学界广泛采用自然界的动植物衍生物来缓解或治疗NAFLD,这不仅充分利用了自然资源,而且采用天然产物来防治该病可以缓解患者的心理压力。据报道,2015年天然产物来源降血脂药物,如鱼油等,在降血脂药物中的销售额排行第四,达9.7亿美元。目前,针对预防或治疗NAFLD的天然产物,主要分为以下几类:脂肪酸类(n-3脂肪酸)、植物甾醇(主要是谷甾醇和菜油甾醇)、生物碱类(主要是荷叶生物碱和小檗碱)、酚类化合物(主要是儿茶酚和白藜芦醇)、壳聚糖和壳寡糖。
壳寡糖降脂作用及机制的研究进展
目前,壳寡糖及其衍生物在医药领域的应用引起了广泛的关注。除以上所涉及的生理活性外,壳寡糖还常被用来治疗血脂异常、调节血脂平衡和保护肝脏。早期研究发现,壳聚糖能抑制胰腺分泌,增强脂肪酶的活性,并通过结合脂肪和胆汁酸阳离子,进而增加粪便中脂肪的排泄量。但其实壳寡糖具有更高的水溶性和更低的粘度,更容易被肠道吸收。近年来,动物(大鼠、肉鸡、猪)和人的临床试验证明了壳寡糖及其衍生物在减少体重和控制血脂水平方面的功效。一方面,壳寡糖作为自然界中唯一存在的带正电荷的低聚糖,能够通过带正电荷的碱性氨基结合脂肪,使其不易被机体消化吸收进而被排出体外。另一方面,壳寡糖可以降低对胆固醇的吸收量,从而减少脂肪的沉积。
真保住吉(Maho Sumiyoshi)等研究者选用3种不同分子量的壳聚糖来分别测定其降脂活性,结果表明,46 kDa的水溶性壳聚糖通过增加粪便内脂肪和胆汁酸含量所达到的降脂作用最好,其可能的作用机制是由于壳聚糖与胆汁酸的结合,导致胰脂肪酶活性受到抑制,从而减少了肠道对脂肪的吸收。随后,他们又通过对分子量较小的壳寡糖进行研究,发现其仍具有通过抑制体重增加、降低血清中甘油三酯(triglyceride,TG)和胆固醇(total cholesterol,TC)的含量以改善肥胖小鼠模型中肝脏和脂肪组织中的脂质积累的作用。在前脂肪细胞3T3-L1中,壳寡糖可通过抑制瘦素蛋白基因启动子的去甲基化来抑制脂肪细胞的分化。拉赫曼(Md Atiar Rahman)等经研究发现,壳寡糖抑制脂肪细胞分化的机制是通过C/EBPa和过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptorγ,PPARγ)途径,其中PPARγ的下调在刺激脂肪细胞分化中起重要作用。此外在ob/ob小鼠(肥胖小鼠)模型中,壳寡糖通过上调脂联素水平抑制了脂肪细胞的分化和生成,可以显著下调脂肪组织特异分泌因子TNF-α和IL-6等的含量,这表明壳寡糖可以有效下调某些与肥胖相关的基因表达量。综上所述,壳寡糖可通过抑制脂肪的分化和积累来改善血脂平衡。
还有研究者曾从豆天蛾(Clanis bilineata)的外壳中制备壳寡糖,并用大鼠来建立高脂模型以研究壳寡糖的降血脂活性。结果表明,与高脂饮食组相比,壳寡糖干预组的大鼠体重减轻了,其血浆中TG、TC和血浆低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-c)的水平也降低了。此外,壳寡糖干预组的大鼠粪便中脂肪含量高于高脂饮食组和正常饮食组,这表明壳寡糖可能是适合人类的降脂药物。基于上述的一些研究,还有一些研究者提出了一种新的饮食疗法,即使用鱼精蛋白和壳寡糖的混合物来治疗超重和肥胖。在动物实验中,喂食高脂饮食的斯普拉格-道利(Sprague Dawley,SD)大鼠的肝脏组织中脂质积聚,粪便中TG和TC的含量增加;而鱼精蛋白和壳寡糖的混合物显著降低了其血清中TG、TC和LDL-c的水平。因此,该研究认为服用鱼精蛋白和壳寡糖的混合物可以预防肥胖以及与高脂血症相关的心血管疾病。
为了深入探究壳寡糖的降脂机制,有研究者选用氨基葡萄糖(数均分子量≤1000)和壳寡糖(数均分子量≤3000)来探究其對高脂饮食诱导的肥胖大鼠的减肥效果。结果表明,氨基葡萄糖和壳寡糖均显著降低了白色脂肪组织中PPARγ和LXRα的mRNA表达水平,由此推测氨基葡萄糖和壳寡糖可能通过抑制高脂饮食诱导的肥胖大鼠的脂肪细胞分化,从而改善血脂异常,并有效防止其体重的增加。周中凯等人分别研究了壳寡糖、抗性淀粉及其复合物对高脂饮食大鼠粪便中脂质成分的差异以及脂代谢和肠道菌群的影响。结果显示,抗性淀粉具有抗消化的特性,不能被小肠吸收,但有助于脂质的排出。而通过前期研究表明,壳寡糖和抗性淀粉交联后,由于壳寡糖具有更好的分散性,从而增加了其与血液中脂类物质的接触,增强了它的吸附能力。实验中采用高脂饮食造成大鼠的血清和粪便中TC、TG含量增加,而壳寡糖一抗性淀粉复合物有效抑制了肠道内脂类的吸收,提高了肠道内不饱和脂肪酸(unsaturated fatty acid,UFA)的含量,从而使得血液中TG、TC含量降低,粪便中TG、TC含量增加。随后,研究人员通过分析粪便中的UFA组成,发现高脂饮食会使UFA的含量降低,由此推测复合物增加了机体对多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)的吸收,改变了血液中脂肪酸的比例,从而影响机体的脂质代谢能力。此外研究还发现,在壳寡糖—抗性淀粉复合物干预后,大鼠肠道内乳酸菌和乳杆菌等益生菌的数量显著增加,而梭菌属和埃希氏杆菌属等腐败菌属的数量下降。所以,壳寡糖和抗性淀粉交联,充分发挥了两者的生物活性,使其改善肠道微环境、调节脂代谢的功效更加显著。这些研究为高脂血症的饮食干预提供了一条新的思路。
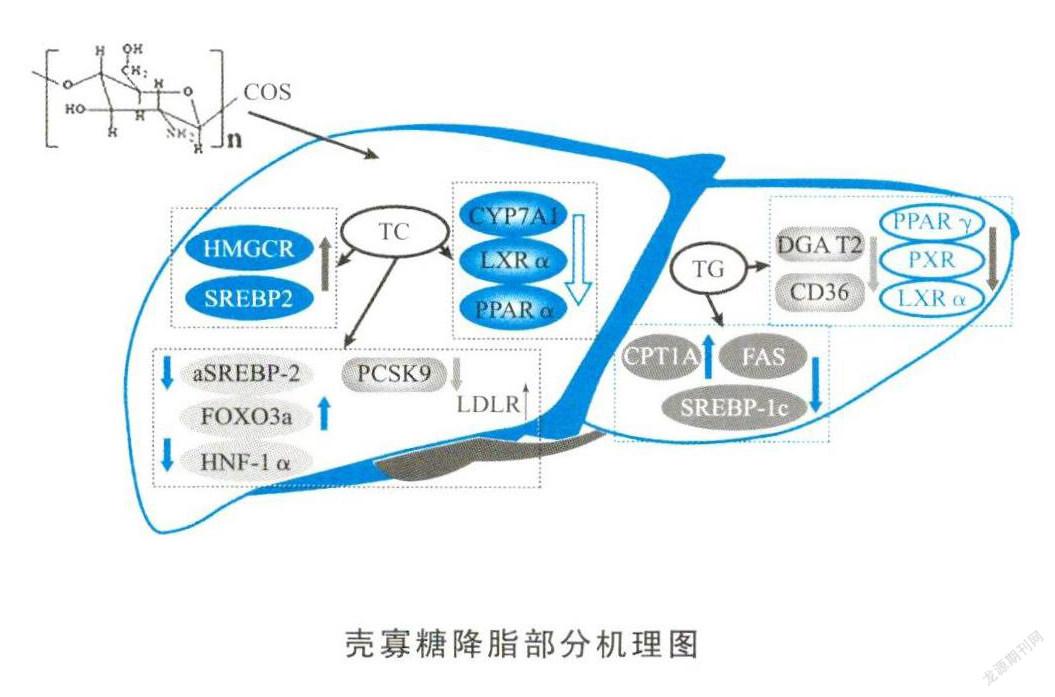
肝脏作为脂肪运输的枢纽,能够调节脂代谢,是体内甘油三酯、胆固醇、磷脂等合成的主要器官之一。若各种酯酶相互调控出现紊乱,则会促使肝脏内脂肪堆积,形成“脂肪肝”。其中,肝脂酶(Hepatic lipase,HL)是肝脏中最重要的脂酶之一,可防止过量的胆固醇积累,从而调节血清中的TG水平。通过高脂饮食诱导建立高脂血症(Hyperlipoproteinemia,HLP)大鼠模型,选用平均分子量小于1000Da的壳寡糖研究其降血脂活性,已得出以下结论:壳寡糖可以显著降低大鼠体重,抑制脂肪细胞生长,干预效果呈剂量依赖;壳寡糖显著降低血清中TC、TG和LDL-c的含量,减轻肝脏内的脂质负荷,降低脂肪肝的发生概率;壳寡糖增强肝脏的抗氧化能力,减少肝脏损伤,维持正常的脂质代谢;壳寡糖促进PPARα的表达,上调HL基因的表达,改善肝脏脂质代谢。由此说明,负责PPARα转录调控的HL基因表达可能是壳寡糖改善肝脏脂质代谢的一个重要靶点。
王健等研究了壳寡糖对肝脏中TG代谢的影响及其相关机制,用壳寡糖进行干预,可以显著降低非酒精性脂肪肝细胞模型组和高脂肪饮食小鼠肝脏中TG的含量。推测其可能的机制是通过:1)抑制脂质合成相关基因SREBP-lc及其下游FAS基因的表达,减少肝脏中TG合成;2)增加CPT1A基因的表达,加速TG的分解。其团队的另一研究选用PNPLA3 I148M转基因小鼠来研究壳寡糖对肝脏脂质代谢的影响,模型组小鼠肝脏HE染色后显示出明显的脂肪变性,而壳寡糖组小鼠肝细胞染色后未见明显脂肪变性。油红O染色显示出壳寡糖可显著降低转基因小鼠肝细胞内脂滴的数量及体积。另外壳寡糖可抑制细胞内TG含量增高,而对TC含量、ALT和AST水平则无显著性影响。基于以上结果,该研究认为壳寡糖能减轻PNPLA3 I148M转基因小鼠肝脏中脂质的沉积,这为研究NAFLD提供了新的思路。
另外,高膽固醇血症也是引起NAFLD的主要原因之一,有研究者选用壳寡糖治疗ApoE-/-雄性小鼠的血脂异常,发现其主动脉脂质沉积明显减少,前蛋白转化酶枯草溶菌素9(PCSK9)蛋白水平显著降低。通过HepG2细胞建立体外模型,发现壳寡糖可增加细胞表面低密度脂蛋白受体(LDLR)和脂滴的数量,并降低PCSK9的mRNA水平。然而,LDLR和HMG-CoA的mRNA水平没有变化。此外,反应元件结合蛋白SREBP-2和HNF-1α在总蛋白中的表达水平增加,但在核蛋白中SREBP-2的表达水平降低,而FOXO3a的表达水平增加。因此,壳寡糖调节脂质转移的原因可能是上调FOXO3a,导致PCSK9启动子对HNF-1α的结合能力下降,从而抑制了PCSK9基因表达,上调了LDLR水平。另外,壳寡糖通过下调SREBP-2来帮助降低PCSK9基因的表达。研究进一步通过RNA干扰沉默HNF-1α和SREBP-2,证实了壳寡糖对PCSK9表达的影响。同年,其他研究者对壳寡糖的降胆固醇作用及其可能的作用机制进行了研究。壳寡糖降低胆固醇的作用可能与以下两种途径有关:一是通过上调胆固醇7α-羟化酶(CYP7A1)、肝X受体α(LXRα)和过氧化物酶体增殖物激活受体-α(PPARα)的表达来促进胆固醇向胆汁酸的转化;二是通过下调3-羟基-3-甲基戊二酰辅酶A还原酶(HMGCR)和SREBP-2的基因表达来减少胆固醇的合成。
目前,大多数研究选用具有不同分子量和脱乙酰度的壳寡糖混合物进行试验,而分子量、聚合度和脱乙酰度与壳寡糖的生物活性密切相关。故筛选产生降脂效果的有效成分,探究其降脂机理,对于促进其在食品、医药等领域的广泛应用具有重要意义。琚洋洋等人利用柱层析对壳寡糖进行分离纯化,获得了高纯度、单一聚合度的壳寡糖,并通过建立体外模型来研究单一聚合度壳寡糖的降血脂和抗氧化活性,明确了其在降血脂和抗氧化活性中起重要作用的成分。此外,他们选用人肝癌细胞HepG2建立高胆固醇和高甘油三酯模型,探究不同浓度的壳二-五糖对细胞内胆固醇和甘油三酯的影响。结果显示,聚合度会显著影响其降低胆固醇和甘油三酯的作用。
尽管如此,对于是哪一个或哪几个聚合度的壳寡糖分子主要发挥降脂作用及其机理仍未知。为对其进行更深入的研究,笔者课题组已从动物和细胞水平探讨了单一聚合度壳寡糖的降脂活性及不同聚合度的差异,结果表明,壳寡糖对胞内脂积累的抑制效果与其聚合度呈现负相关。通过分析细胞内的脂质水平、小鼠的生理和病理指标的变化以及体内外参与脂质代谢的基因和蛋白的表达水平,证明壳寡糖显著下调PPARγ、LXRα、DGAT2、PXR,CD36的表达,并通过介导甘油三酯合成和脂肪酸吸收通路抑制肝脏中过度的脂肪积累。这为NAFLD等代谢疾病治疗药物的研发提供了有力的理论支持。
壳寡糖作为壳聚糖的降解产物,水溶性好且易被人体吸收,因其具有多种生理功能而被广泛应用于多个领域。但该领域仍存在亟待解决的问题,比如目前关于壳寡糖的研究大多使用的是混合组分的壳寡糖,由于其组分复杂,很难探究其发挥作用的分子机理。而且目前规模化生产高纯度、特定聚合度、脱乙酰度的壳寡糖难度较大,无法保证每批次制备的壳寡糖理化特性完全一致,且单一聚合物样品价格昂贵。因此,获取组分单一、效果稳定的产品可为研究壳寡糖生理活性及机理提供有效保障。此外,有关壳寡糖的研究缺乏长期临床安全性的评估数据,这对其日后发展将产生重大影响,故相关科研工作者仍需不懈努力进一步阐明壳寡糖的安全性及有效性。
[1]Zou P,Yang X,Huang W,et al.Characterization and bioactivity of polysaccharides obtained from pine cones of Pinus koraiensis by graded ethanol precipitation.Molecules,2013,18(8):9933-9948.
[2]Qiao Y,Bai X,Du Y.Chitosan oligosaccharides protect mice from LPS challenge by attenuation of inflammation and oxidative stress.International Immunopharmacology,2011,11(1):121-127.
[3]Feng J,Zhao L,Yu Q.Receptor-mediated stimulatory effect of oligochitosan in macrophages.Biochemical&Biophysical Research Communications,2004,317(2):414-420.
[4]Park J,Mi J,Choi H,et al.Effects of the Molecular Weight and the Degree of Deacetylation of Chitosan Oligosaccharides on Antitumor Activity.International Journal of Molecular Sciences,2011,12(1):266-277.
[5]Kim J,Jo S,Ha K,et al.Effect of long-term supplementation of low molecular weight chitosan oligosaccharide(GO2KA1)on fasting blood glucose and HbAlc in db/db mice model and eluc idation of mechanism of action.BMC Complement Altern Med,2014,14(1):272-278.
[6]Maho S,Yoshiyuki K.Low molecular weight chitosan inhibits obesity induced by feeding a high-fat diet long-term in mice.Journal of Pharmacy and Pharmacology,2006,58(2):201-207.
[7]Bahar B,O'Doherty J V,O'Doherty A M,et al.Chito-Oligosaccharide Inhibits the De-Methylation of a'CpG'Island within the Leptin(LEP)Promoter during Adipogenesis of 3T3-L1 Cells.PLoS One,2013,(3):1-7.
[8]Xu Q S,Dou J,Wei P,et al.Chitooligosaccharides inducc apoptosis of human hepatocellular carcinoma cells via up-regulation of Bax.Carbohydrate Polymers,2008,71(4):509-514.
[9]Xu Q S,Ma P,Yu T W,et al.Chitooligosaccharides Protect Human Embryonic Hepatocytes Against Oxidative Stress Induced by Hydrogen Peroxide.Marine Biotechnology,2010,12(3):292-298.
[10]Zhang J L,Zhang W,Mamadouba B,et al.A comparative study on hypolipidemic activities of high and low molecular weight chitosan in rats.International Journal Of Biological Macromolecules,2012,51(4):504-508.
[11]Kang NH,Lee WK,Yi BR,et al.Modulation of lipid metabolism by mixtures of protamine and chitooligosaccharide through pancreatic lipase inhibitory activity in a rat model.Laboratory animal research,2012,28(1):31-38.
[12]Huang LL,Chen J,Cao PQ.Anti-Obese Effect of Glucosamine and Chitosan Oligosaccharide in High-Fat Diet-Induced Obese Rats.Marine Drugs,2015,13(5):2732-2756.
[13]周中凯,李莹,王俊轩.壳寡糖、抗性淀粉及其复合物对高脂饮食大鼠粪便中脂质成分的差异性.食品科技,2016,41(08):79-83.
[14]潘海涛.COST颗粒体内降血脂活性与机制研究.广东药学院,2015.
[15]王健.壳寡糖降低体内外非酒精性脂肪肝模型甘油三酯的作用及机制研究(硕士学位论文).山东:青岛大学,2015.
[16]王健,姜曼,辛永宁.壳寡糖对PNPLA3 I148M转基因小鼠肝脏脂质代谢的影响.中国肝脏病杂志,2015,7(01):6-9.
[17]Yang X,Zhang J,Chen LM.Chitosan oligosaccharides enhance lipid droplets via down-regulation of PCSK9 gene expression in HepG2cells.Experimental Cell Research,2018,366(2):152-160.
[18]Jiang Y,Fu CH,Liu GH.Cholesterol-lowering effects and potential mechanisms of chitooligosaccharide capsules in hyperlipidemic rats.Food&Nutrition Research,2018,62:1-15.
[19]琚洋洋。殼寡糖的制备、分离纯化及生物活性研究(硕士学位论文).福建:华侨大学,2016.
[20]Li XD,Zhao MY,Fan LQ,et al.Chitobiose alleviates oleic acid-induced lipid accumulation by decreasing fatty acid uptake andtriglyceride synthesis in HepG2 cells.Journal of Functional Foods,2018,46:202-211.
关键词:壳寡糖 生理活性 降脂
