短暂性脑缺血发作患者颅内动脉斑块特征的高分辨率磁共振研究
2019-09-07肖嘉昱蒋涛杨旗刘潇贾秀琴郭佳翔
肖嘉昱,蒋涛*,杨旗,刘潇,贾秀琴,郭佳翔
1.首都医科大学附属北京朝阳医院放射科,北京 100020;2.首都医科大学宣武医院放射科,北京 100053;3.首都医科大学附属北京朝阳医院神经内科,北京 100020;*通讯作者 蒋涛 jiangtao@bjcyh.com
短暂性脑缺血发作(transient ischemic attack,TIA)指脑、脊髓或视网膜局灶性缺血所致的、不伴急性梗死的短暂性神经功能障碍。由于TIA症状多较轻且持续时间短,发病率往往被低估,但短期复发卒中风险高,因此TIA的早期诊断和干预非常重要[1-3]。我国约有50%的TIA由颅内动脉粥样硬化性疾病引起[4]。
由于TIA患者难以在常规头颅MRI检查中发现异常,而磁共振血管成像(MRA)、CT血管成像(CTA)等传统的管腔成像仅能获得血管狭窄程度的信息。因此,临床医师迫切需要更多检查方法帮助确定TIA患者的病因及危险分层。高分辨率磁共振成像(high resolution magnetic resonance imaging,HR-MRI)是一种无创的评价颅内血管壁的影像学检查,近年多项研究证实其对于分析缺血性卒中患者颅内动脉粥样硬化斑块的价值[5]。本研究使用3D可变翻转角度快速自旋回波 T1加权(inversion recovery sampling perfection with application optimized contrast using different flip angle evolution,IR-SPACE)序列评价TIA患者双侧前循环颅内大动脉中存在的所有斑块,总结TIA患者颅内易损斑块的影像学特征。
1 资料与方法
1.1 研究对象 前瞻性纳入2015年10月—2017年12月经我院神经内科确诊的TIA患者,纳入标准:①过去30 d内出现短暂发作的一侧肢体麻木、无力;②经MRA、CTA或数字减影血管造影(DSA)证实支配症状侧肢体的前循环颅内动脉存在至少1处狭窄(≥30%);③至少存在1种动脉粥样硬化危险因素,如高血压、糖尿病、血脂异常、吸烟等。排除标准:①扩散加权成像(DWI)证实存在急性脑梗死;②存在增强MRI检查禁忌证;③既往有脑梗死、脑出血、脑部手术及脑血管介入治疗病史;④合并颅外颈动脉、椎-基底动脉中度以上狭窄(≥50%);⑤本次TIA发作考虑非动脉粥样硬化性疾病所致,如夹层、血管炎、烟雾病、心源性栓塞等。本研究经我院伦理委员会批准[临研审(2016)002号],所有入组患者均签署知情同意书。
在入组并完成扫描的48例患者中,6例由于配合不佳,导致增强前或增强后的HR-MRI图像运动伪影严重并影响分析而被排除。最终纳入42例患者,男27例,女15例;平均年龄(49.4±12.7)岁。患者最近一次TIA症状发作距离进行影像学检查之间的中位时间为5.0(6.5,17.8)d。42例患者中,合并高血压21例(50.0%),糖尿病11例(26.2%),血脂异常19例(45.2%),吸烟24例(57.1%)。
1.2 扫描序列及参数 使用西门子3.0T MR扫描仪与配备的64通道头颈联合线圈进行检查。扫描序列包括常规头颅DWI、3D TOF MRA和增强前IRSPACE。DWI采用SE-EPI序列,b值取1000 s/mm2,层厚6 mm,层间距1 mm。IR-SPACE扫描参数:TR 900 ms,TE 15 ms,视野170 mm×170 mm,层数240,体素大小0.53 mm×0.53 mm×0.53 mm,层间距0,扫描时间8 min。经肘正中静脉注射双倍剂量(0.2 mmol/kg)钆喷酸葡胺5 min后,进行增强后IR-SPACE扫描,增强扫描前后IR-SPACE序列定位完全一致。
1.3 图像分析 使用软件Osirix MD(Pixmeo SARL)进行定性和定量分析。由2位经验丰富的放射科医师在对患者临床资料不知情的情况下共同评估HR-MRI图像。分析范围包括双侧前循环的颅内大动脉,即双侧颈内动脉颅内段(internal carotid artery,ICA)、大脑中动脉M1~M3段(middle cerebral artery,MCA)和大脑前动脉A1段(anterior cerebral artery,ACA)的所有斑块。动脉粥样硬化斑块定义为局限性偏心性动脉管壁增厚[6],以其相邻的近侧、远侧或对侧相同位置的血管段作为参考管壁。分析方法参照既往研究[7-9]。
管壁的增厚/强化模式通过视觉评估分为Ⅰ型(≤50%管壁横截面受累/强化)和Ⅱ型(>50%管壁横截面受累/强化)。斑块表面如出现不光整、不连续或锯齿样改变视为斑块表面不规则。手动绘制感兴趣区定量测量平均信号强度(signal intensity,SI),在平扫图像上分别测量每个斑块中信号最高的区域和其参考管壁的SI值,两者比值如>200%,则认为此斑块具有“T1高信号”特征。此外,在每个斑块横截面的最厚处、参考管壁和垂体漏斗分别于增强前后图像的同一位置定量测量SI。与脑灰质增强前后SI进行标准化后代入增强后SI/增强前SI×100%计算强化比值(enhancement ratio,ER)。斑块强化程度分为:0级,斑块ER≤参考管壁ER;1级,参考管壁ER<斑块ER<垂体漏斗ER;2级,斑块ER≥垂体漏斗ER。在血管横截面水平评价管腔狭窄程度,分为轻度狭窄(0~29%)、中度狭窄(30%~69%)和重度狭窄(70%~99%)。
本研究纳入的每例患者的所有斑块位置均提供给1名独立的神经内科医师,结合患者临床症状、血管造影(MRA、CTA或DSA)图像将所有斑块进一步分为支配侧斑块和非支配侧斑块。支配侧定义为血管分布区所支配肢体出现症状。
1.4 统计学方法 采用SPSS 22.0软件,正态分布的计量资料以表示,计数资料以总数(%)表示。支配侧与非支配侧斑块之间增厚模式、斑块表面不规则、T1高信号、强化程度、强化模式及管腔狭窄程度比较采用χ2检验。通过Logistic回归分析得到支配侧斑块(比非支配侧斑块)相应的比值比(odd ratio,OR)。P<0.05表示差异有统计学意义。
2 结果
2.1 斑块位置和分类 42例患者共发现146处颅内动脉粥样硬化斑块,其中40例(95.2%)存在至少2处斑块。在所有斑块中,位于颈内动脉颅内段26处(17.8%),位于大脑中动脉115处(78.8%),位于大脑前动脉5处(3.4%)(表1)。
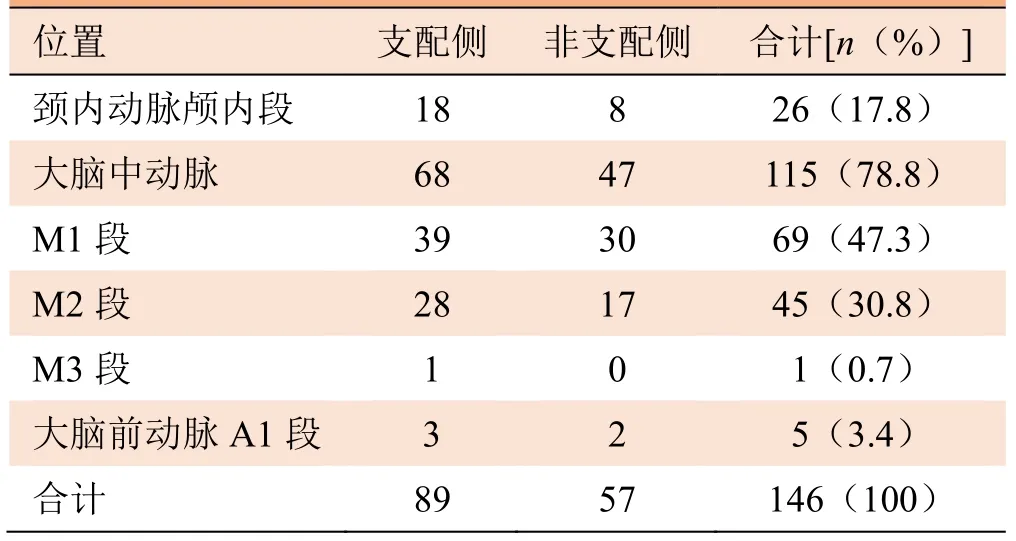
表1 42例TIA患者146处颅内动脉粥样斑块分布
2.2 不同侧别的斑块特征 支配侧和非支配侧斑块特征见表2。支配侧发现斑块87处,非支配侧发现斑块59处(图1)。在支配侧(Ⅰ型72.4%,Ⅱ型27.6%)和非支配侧(Ⅰ型96.6%,Ⅱ型3.4%)之间,管壁增厚模式差异有统计学意义(P<0.001)。支配侧斑块表面不规则率高于非支配侧(40.2%比5.1%,P<0.001)。在支配侧,T1高信号的发生率(19.5%比5.1%,P=0.013)更高。支配侧强化程度高于非支配侧(P<0.001),支配侧(Ⅰ型67.8%,Ⅱ型32.2%)和非支配侧(Ⅰ型98.1%,Ⅱ型1.9%)的强化模式差异有统计学意义(P<0.001)。支配侧斑块狭窄程度较非支配侧重(P=0.004)。将以上特征进行Logistic回归分析,在调整其他影响因素后,表面不规则(OR=5.46,95%CI1.35~22.03)和管腔重度狭窄(OR=7.63,95%CI1.57~37.56)与支配侧斑块相关(表3)。图2、图3为斑块特征比较的示例。
3 讨论
本研究评估了近期出现前循环TIA患者颅内动脉粥样硬化斑块的形态学、信号及强化特征,并对不同血管分布区斑块特征进行比较,在既往研究中鲜有报道。
本研究发现,Ⅱ型增厚模式和Ⅱ型强化模式在支配侧斑块中更为多见,Ⅱ型增厚模式可能是斑块更广泛并处于进展期的标志,Ⅱ型强化模式可能反映出广泛的新生血管形成或炎症细胞浸润,一定程度上提示支配侧斑块的易损性,与Dieleman等[10]的研究结果一致。
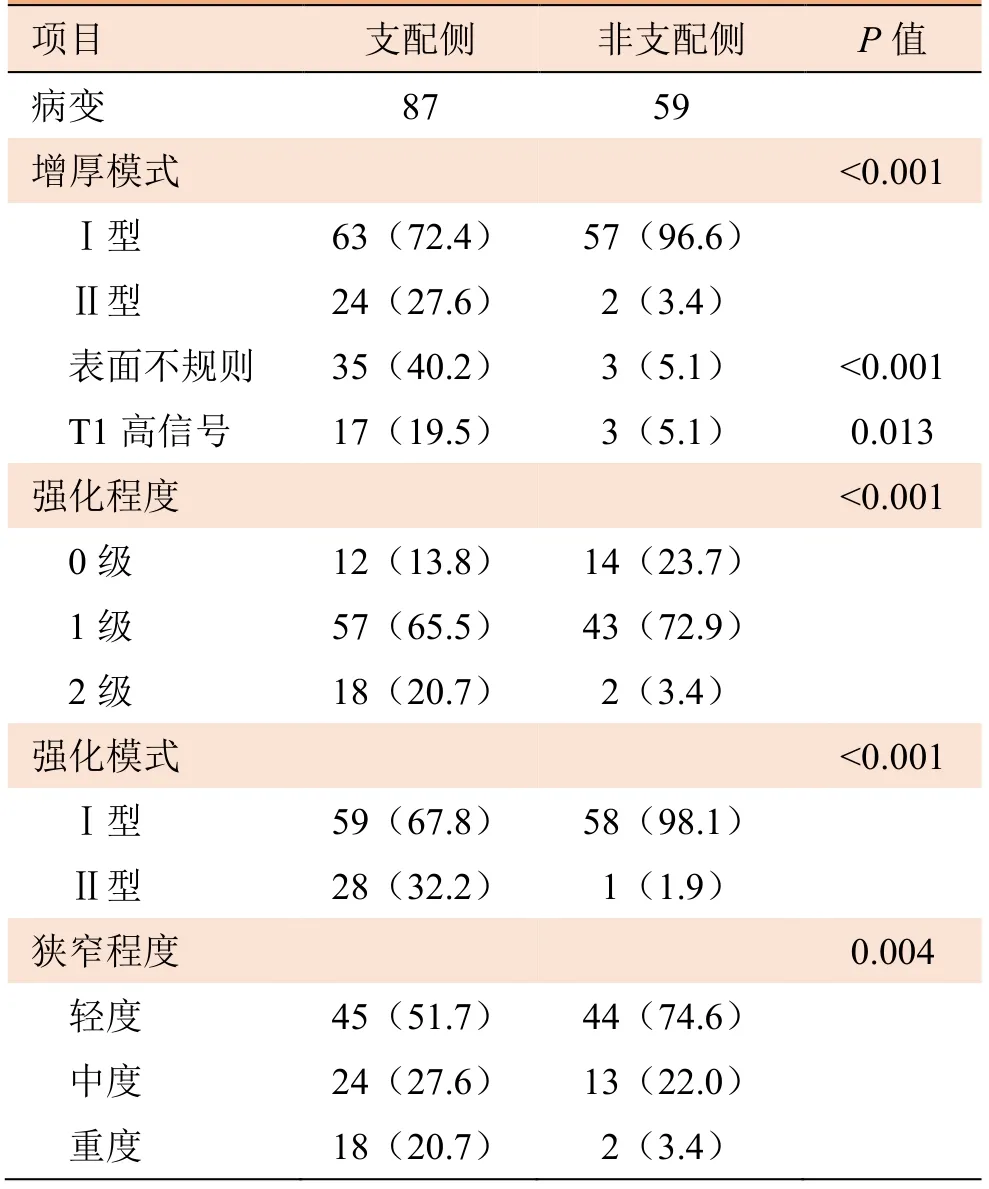
表2 支配侧和非支配侧的斑块特征比较[n(%)]
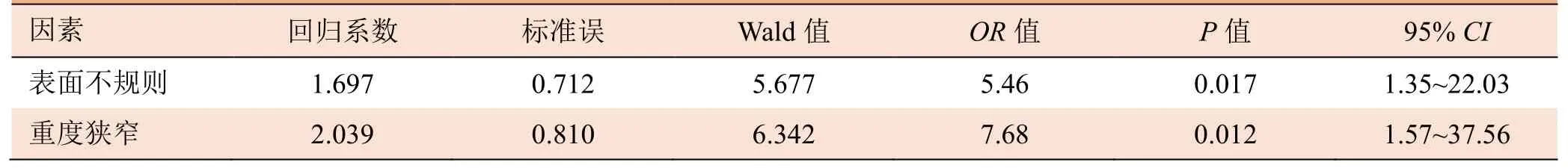
表3 Logistic回归分析与支配侧斑块的相关因素

图2 女,71岁,TIA,表现为阵发性右侧肢体麻木、无力。A.增强前HR-MRI图像示左侧(支配侧)大脑中动脉M1段斑块(星号)呈Ⅱ型增厚模式,管腔中度狭窄;同侧M2段可见一Ⅱ型增厚模式斑块(箭),管腔轻度狭窄;右侧(非支配侧)大脑中动脉M2段可见Ⅰ型增厚模式斑块(箭头),管腔轻度狭窄。B.增强后HR-MRI图像示左侧(支配侧)大脑中动脉M1段斑块(星号)呈Ⅱ型强化模式,强化程度为2级;同侧M2段斑块(箭)呈Ⅱ型强化模式,强化程度为1级;右侧(非支配侧)大脑中动脉M2段斑块(箭头)呈Ⅰ型强化模式,强化程度为1级

图3 男,60岁,TIA,表现为反复发作性右肢麻木。A.DWI未见急性脑梗死病灶;B.MRA示左侧大脑中动脉M1段中度狭窄(箭);C、D.增强前HR-MRI图像示斑块表面不规则,平扫斑块内可见点状T1高信号(箭头);E、F.增强后HR-MRI图像示斑块强化程度为2级(星号)。此斑块为支配侧斑块
本研究显示,斑块表面不规则是与支配侧斑块相关的特征,这一发现与既往研究结果一致[11]。Troyer等[12]的一项颈动脉斑块研究显示,斑块表面不规则(>2 mm)可能会导致栓子脱落,进而造成缺血性卒中。本研究推测颅内斑块表面不规则也可能与斑块内侧面微血栓形成并脱落或斑块表面溃疡有关。
既往关于颅内血管壁成像的研究已将T1高信号与斑块内出血相关联[13-14]。本研究显示T1高信号更多见于支配侧斑块,支持T1高信号与近期TIA的关系。同时发现非支配侧斑块也有小部分出现T1高信号,可能表明这些斑块处于积累高铁血红蛋白和(或)脂质的阶段,其斑块的转归也非常值得随访研究。
颈动脉粥样硬化斑块研究表明,斑块强化是新血管形成和炎症的标志[15-16]。另外,一项尸检研究发现颅内动脉粥样硬化斑块的新生血管与梗死有关。多项关于颅内血管壁成像的研究报道斑块强化与急性、亚急性,甚至是慢性梗死相关[6,17-19]。本研究发现,与非支配侧斑块(3.4%)相比,支配侧斑块(20.7%)中更多见明显强化(2级)的斑块,可能提示这些病变具有更多的新生血管形成和(或)处于炎症活动期。
本研究中,支配侧斑块造成的管腔狭窄较非支配侧更显著,这可能与入组患者支配侧至少有1处轻度以上狭窄有关。另外,尸检研究表明,近90%的动脉粥样硬化血栓性梗死患者发现颅内斑块,并且比狭窄性变化更频繁[20]。既往研究认为评估斑块状况比仅测量管腔狭窄更重要[21]。传统的管腔成像仅能显示管腔狭窄与否,有时难以区分动脉粥样硬化造成的管腔狭窄与血管炎、动脉夹层等疾病造成的狭窄,通过HRMRI则能有效地鉴别诊断[22]。
对于TIA的发病机制,仍然存在一些假设,包括微栓子、血液动力学异常、血管痉挛、血液成分异常和动脉曲折变异等,斑块形成和破裂可能是TIA的病因之一。具有破裂风险的动脉粥样硬化斑块,形成微栓子脱落进入远端血管,如果远端皮质分支的边界区或侧支循环仍然正常,或微栓子的形成较少,不超出脑组织清除微栓子的阈值,则表现为TIA的症状。然而,这些高危斑块的存在仍然是复发性TIA和继发缺血性卒中的危险因素。在这种动脉粥样硬化的血管背景下,动脉内膜受损,血栓更容易形成,同时清除血栓的能力下降,进而导致病情恶化[23]。
本研究发现表面不规则和重度狭窄,这些以往用于评价缺血性卒中患者动脉粥样硬化斑块易损性的影像学特征在TIA患者中同样适用,对TIA患者寻找病因、制订精准治疗方案以及后续随访提供了有力支持,针对高危病灶的早期干预措施可能会减少TIA再发和缺血性卒中的发生。
读者·作者·编者
医学科技论文摘要撰写要求:摘要应具有独立性和自含性,即不阅读论文全文就能获得必要的信息。结构式摘要由目的、资料与方法、结果、结论4个要素组成。目的中需简要交代研究的前提(问题的提出)、研究目的及其重要性;资料与方法中需简述研究类型(如回顾性研究、前瞻性研究)、人口学(研究对象)或材料、分组、采用的研究方法及观察指标,摘要方法中不需要指明具体使用的统计学方法;结果中针对研究方法及观察指标简要列出主要的、有意义的或新发现的研究结果,指出临床与统计学的意义和价值;结论是针对结果的分析、评价和应用,肯定经过科学分析的研究结果及其获得的某些结论,但不能超出研究结果的范围而过度推论,同时指出这些结论的理论或实用价值。摘要中不列图表,不引用参考文献,英文缩略语首次出现需注明中文全称。中文摘要以350字左右为宜,英文摘要需与中文摘要对应。
