链霉菌KIB-H1556次级代谢产物抗植物真菌活性研究
2019-09-05董庭邦黄胜雄王福生
董庭邦,王 磊,桂 潇,苏 灿,李 洁,黄胜雄*,王福生*
1大理大学药学与化学学院,大理 671000;2中国科学院昆明植物研究所 植物化学与西部植物资源持续利用国家重点实验室,昆明 650201
放线菌(Actinomycetes)广泛分布于土壤、海洋和湖泊等不同地自然生境中,它们与人类生活息息相关,在医疗、农业、食品、化工和环保等领域具有重要的应用价值[1]。迄今为止,近万种被发现的天然抗生素中,约 70% 由放线菌产生,其中,链霉菌产生的抗生素约占52%[2]。Bafilomycins是具有16元内酯环的大环内酯类抗生素,首次从灰色链霉菌的培养物中分离得到[3]。目前,从链霉菌中得到的Bafilomycins类化合物有Bafilomycin A~J及其衍生物,该大环内酯类抗生素对革兰氏阳性菌具有广谱的杀菌活性,并且具有抗寄生虫的作用[4,5]。
在我国,玉米是仅次于水稻和小麦的第三大粮食作物以及多种农副产品的原料,并且种植面积较大。近年来,玉米病虫害日益严重,不仅影响了玉米的质量和产量,而且玉米病害的不断进化和变异,加大了其防治难度和效果。为了寻找新的抗植物病原菌天然活性物质,本课题组对多株链霉菌的发酵产物进行活性筛选,发现一株链霉菌KIB-H1556的粗提物对植物病原真菌显示出较好的抑制活性。本实验对该菌株进行摇瓶发酵,采用活性追踪的方法,对其次级代谢产物进行分离纯化,得到3个化合物。首次发现化合物2和3对玉米大斑病菌、小斑病菌和玉米弯孢病菌等植物病原菌显示有抑制活性,其具有作为抗植物病原真菌药物的研究价值。

图1 化合物1~3的化学结构Fig.1 Chemical structures of compounds 1-3
1 材料与方法
1.1 仪器与材料
Bruker Avance Ⅲ-600型核磁共振仪(TMS作为内标,δ为ppm),Agilent UPLC/Q-Tof液质联用仪(Agilent 1290UPLC/6540 Q-TOF),Hitachi Chromaster高效液相色谱仪(日立),YMC-Triat C18型液相色谱柱(250 × 10 mm I.D.),ZQZY-HC恒温摇床(上海知楚仪器),薄层色谱硅胶板和200~300目柱色谱硅胶(青岛海洋化工厂),Sephadex LH-20(瑞典AIRTECH生物化学试剂公司),YXQ-LS-18SI高压蒸汽灭菌锅(上海博迅实业有限公司医疗设备厂)。其他试剂为国产分析纯试剂(天津市大茂化学试剂厂,广东环凯微生物科技有限公司)。
1.2 菌种及来源
发酵菌株:Streptomycessp.KIB-H1556分离自曼陀罗(DaturastramoniumL.)根际土壤,通过对其16S rRNA基因进行测序,发现其序列与Streptomycesgriseobrunneusstrain NBRC 12775的序列相似度是99.9%。菌株KIB-H1556保藏于昆明植物研究所植物化学与西部植物资源可持续利用国家重点实验室。
测试菌株:番茄灰霉病菌(Botrytiscinerea)、小麦赤霉病菌(Gibberellazeae)、玉米小斑病菌(HelminthosporiummaydisNisik & Miy)、棉花枯萎病菌(FusariumoxysporumSchl.f.sp.Vasinfectum)、玉米大斑病菌(Exserohilumturcicum(Pass.) Leonard et Suggs)、水稻纹枯病菌(RhizoctoniasolaniKühn.)、玉米弯孢病菌(Curvularialunata(Walk) Boed)、黄瓜枯萎病菌(Fusariumoxysporumf.sp.Cucumerinum)和大豆根腐病菌(Fusariumoxysporum)由西北农林科技大学马亚团老师提供。菌株目前保藏于昆明植物研究所植物化学与西部植物资源可持续利用国家重点实验室。
1.3 培养基及培养条件
固体培养基:为MS培养基,大豆粉20.0 g,加入1.0 L水,煮沸15 min,用纱布过滤除去滤渣,滤液定容到1.0 L,加甘露醇20.0 g,技术琼脂粉20.0 g,pH = 7.0。
种子培养基:为TSB培养基,配方为大豆蛋白胨3.0 g/L,胰蛋白胨17.0 g/L,氯化钠5.0 g/L,磷酸氢二钾2.5 g/L,葡萄糖2.5 g/L,pH = 7.3 ± 0.2。
发酵培养基:可溶性淀粉10.0 g/L,葡萄糖10.0 g/L,甘油10.0 g/L,胰蛋白胨5.0 g/L,酵母提取物5.0 g/L,CaCO33.0 g/L,pH =7.0 ± 0.2。
PDA:200.0 g去皮土豆切碎,加入1.0 L水,煮沸30 min,用纱布过滤除去滤渣,滤液定容到1.0 L,加20.0 g葡萄糖,再加20.0 g琼脂粉,搅拌溶解后灭菌待用。
将在MS平板上活化好的菌株接种到装有50 mL种子培养基的250 mL三角瓶中,置于28 ℃,220 rpm摇床上培养2天。将种子液按10%接种量转接到盛有250 mL发酵培养基的1 L三角瓶中,共发酵20 L。置于28 ℃,220 rpm摇床上培养7天。
1.4 提取与分离
Streptomycessp.KIB-H1556发酵7天后,将发酵液于4 000 rpm下离心20 min。上清液用乙酸乙酯萃取3次;菌丝体用丙酮浸泡并超声破碎后,蒸馏除去丙酮,剩余的水相用乙酸乙酯萃取3次,合并乙酸乙酯相得萃取物5.3 g。该萃取物经硅胶柱层析(石油醚-乙酸乙酯50∶1,10∶1,5∶1,1∶1,0∶1)分离,将石油醚-乙酸乙酯(1∶1,0∶1)部分合并得F组分:560 mg。F组分用甲醇溶解后再经过葡聚糖凝胶柱层析分离得到5个组分(F1-5)。F4组分用半制备HPLC分离(90%甲醇洗脱25 min),富集4.58 min的流份得化合物 1(8.2 mg),富集21.17 min的流份得化合物2(10.7 mg),富集23.81 min的流份得化合物3(13.2 mg)。
1.5 活性测试
将九株测试菌分别接种至PDA培养基上活化培养,28 ℃避光培养4天,待其菌落基本长满培养皿为止即可使用。化合物1、2、3、Carbendazim、Cycloheximide和Nystatin均配制成浓度为2.0 mg/mL的甲醇溶液备用。超净条件下,在长满菌落的培养皿中加入无菌水,用灭菌过的竹签把孢子加到离心管中,加入30 mL灭菌后的PDA,翻转摇至均匀后倒入培养皿中。待冷却后,十字线标记。取无菌滤纸片(用打孔器将滤纸片加工成直径为5 mm),滴上5 μL样品溶液,待溶剂挥干后移入已接菌的培养基平板上,培养皿中心到滤纸片中心的距离约为30 mm左右。将菌株放在28 ℃下培养24 h后观察抑菌圈大小,用十字交叉法测量抑菌圈直径。测试时以无菌水和甲醇为阴性对照,以Carbendazim、Cycloheximide和Nystatin为阳性对照,每块平板中都需有阳性对照[6]。重复平行做3次,抑菌圈直径测量3次求其平均值。
2 结果与分析
1.1 化合物结构鉴定
化合物1 白色粉末 (CH3OH);分子式C35H56O8;ESI-MS:m/z627 [M+Na]+;1H NMR (600 MHz,CD3OD)δ:6.92 (1H,dd,J= 16.2,9.0 Hz,H-21),6.68 (1H,s,H-3),6.56 (1H,dd,J= 15.0,9.0 Hz,H-12),6.25 (1H,d,J= 16.2 Hz,H-20),5.87 (1H,br d,J= 9.0 Hz,H-5),5.78 (1H,d,J= 9.0 Hz,H-11),5.18 (1H,J= 15.0,9.0 Hz,H-13),5.15 (1H,dd,J= 9.15 Hz,H-15),3.94 (1H,dd,J= 7.2,16.2 Hz,H-14),3.80 (1H,m,H-17),3.63 (3H,s,2-OCH3),3.30 (1H,d,J= 6.6 Hz H-7),3.27 (1H,m,H-23),3.23 (3H,s,14-OCH3),3.11 (1H,m,H-18),2.42 (1H,m,H-22),2.07 (1H,dd,J= 14.4,12.0 Hz,H-16),2.00 (2H,m,H-9),1.97 (3H,s,H-26),1.83 (3H,s,H-29),1.60 (1H,m,H-24),1.10 (3H,d,J= 7.2 Hz,H-31),1.07 (3H,d,J= 7.2 Hz,H-27),1.05 (3H,d,J= 7.2 Hz,H-32),0.97 (3H,t,J= 7.2 Hz,H-30),0.93 (6H,m,H-25,H-33),0.90 (3H,d,J= 7.2 Hz,H-28);13C NMR (150 MHz,CD3OD)δ:167.2 (C-1),142.5 (C-2),60.6 (2-OCH3),134.4 (C-3),134.0 (C-4),145.1 (C-5),41.1 (C-6),81.2 (C-7),40.5 (C-8),41.4 (C-9),144.4 (C-10),125.6(C-11),133.0 (C-12),126.7 (C-13),85.1 (C-14),56.0 (14-OCH3),77.3 (C-15),38.7 (C-16),73.5 (C-17),47.4 (C-18),204.9 (C-19),130.0 (C-20),151.0 (C-21),42.6 (C-22),80.9 (C-23),32.6 (C-24),19.6 (C-25),14.0 (C-26),19.8 (C-27),22.9 (C-28),19.6 (C-29),11.3 (C-30),9.6 (C-31),17.8 (C-32)。 以上数据和文献[7,8]报道一致,故鉴定为Bafilomycin D。
化合物2 黄色粉末(CH3OH);分子式C44H65NO13;ESI-MS:m/z838 [M+Na]+;1H NMR (600 MHz,CDCl3)δ:7.20 (1H,m,H-2′),6.89 (1H,d,J= 15.0 Hz,H-3′),6.67 (1H,s,H-3),6.49 (1H,dd,J= 15.0,10.8 Hz,H-12),5.81 (1H,d,J= 10.8 Hz,H-11),5.77 (1H,d,J= 9.0 Hz,H-5),5.16 (1H,dd,J= 15.0,9.6 Hz,H-13),4.95 (1H,d,J= 8.4 Hz,H-15),4.12 (1H,d,J= 10.8 Hz,H-17),3.88 (1H,t,J= 9.6 Hz,H-14),3.63 (3H,s,2-OCH3),3.61 (1H,m,H-21),3.29 (1H,d,J= 6.6 Hz,H-23),3.24 (3H,s,14-OCH3),2.61 (2H,m,H-8′),2.52 (1H,m,H-6),2.13 (1H,m,H-16),1.99 (3H,s,H-26),1.93 (3H,s,H-29),1.90 (2H,m,H-8),1.76 (1H,m,H-18),1.62 (1H,m,H-24),1.27 (1H,m,H-22),1.20 (2H,m,H-20),1.06 (3H,d,J= 7.2 Hz,H-27),1.05 (3H,d,J= 7.2 Hz,H-32),1.02 (3H,d,J= 7.2 Hz,H-31),0.92 (3H,d,J= 6.6 Hz,H-28),0.78 (6H,m,H-25,H-33),0.83 (3H,d,J= 6.6 Hz,H-30);13C NMR (150 MHz,CDCl3)δ:167.3 (C-1),141.2 (C-2),59.9 (2-OCH3),133.6 (C-3),133.3 (C-4),143.0 (C-5),37.1 (C-6),81.1 (C-7),40.0 (C-8),42.0 (C-9),142.8 (C-10),125.2 (C-11),133.4 (C-12),127.1 (C-13),82.2 (C-14),55.5 (14-OCH3),76.8 (C-15),36.6 (C-16),70.6 (C-17),41.2 (C-18),98.8 (C-19),39.9 (C-20),75.4 (C-21),38.1 (C-22),75.4 (C-23),27.8 (C-24),21.0 (C-25),14.0 (C-26),17.2 (C-27),21.6 (C-28),20.1 (C-29),9.8 (C-30),7.0 (C-31),12.2 (C-32),14.2 (C-33),164.2 (C-1′),133.1 (C-2′),133.2 (C-3′),163.7 (C-4′),114.9 (C-5′),175.6 (C-6′),26.2 (C-7′),32.6 (C-8′),198.1 (C-9′)。以上数据与文献[9]报道一致,故鉴定为Bafilomycin B1。
化合物3 黄色粉末(CH3OH);分子式C45H67NO13;ESI-MS:m/z852 [M+Na]+;1H NMR (600 MHz,CDCl3)δ:7.20 (1H,m,H-2′),6.89 (1H,d,J= 15.0 Hz,H-3′),6.63 (1H,s,H-3),6.48 (1H,dd,J= 15.0,10.8 Hz,H-12),5.81 (1H,d,J= 10.2 Hz,H-11),5.74 (1H,d,J= 9.0 Hz,H-5),5.18 (1H,dd,J= 15.0,9.6 Hz,H-13),5.07 (2H,m,H-15),3.88 (1H,t,J= 9.0 Hz,H-14),3.63 (3H,s,2-OCH3),3.60 (3H,s,19-OCH3),3.69 (3H,s,H-21),3.46 (1H,m,H-23),3.23 (3H,s,14-OCH3),2.61 (4H,m,H-8′),2.52 (1H,m,H-6),2.28 (1H,dd,J= 13.2,4.8 Hz),2.16 (1H,m,H-16),1.98 (3H,s,H-26),1.94 (3H,m,H-29),1.92 (2H,m,H-8),1.68 -1.60 (1H,m,H-18),1.06 (3H,d,J= 7.2 Hz,H-31),1.05 (3H,d,J= 7.2 Hz,H-32)1.04 (3H,d,J= 7.2 Hz,H-27),0.93 (3H,d,J= 6.0 Hz,H-28),0.83 (6H,H-25,H-33),0.78 (3H,d,J= 6.6 Hz,H-30);13C NMR (150 MHz,CDCl3)δ:166.6 (C-1),141.4 (C-2),60.2 (2-OCH3),133.4 (C-3),133.1 (C-4),142.7 (C-5),37.5 (C-6),81.2 (C-7),38.7 (C-8),41.2 (C-9),142.2 (C-10),125.3 (C-11),133.0 (C-12),127.4 (C-13),82.7 (C-14),55.5 (14-OCH3),76.8 (C-15),35.3 (C-16),69.4 (C-17),39.8 (C-18),102.8 (C-19),46.4 (19-OCH3),38.4 (C-20),75.1 (C-21),36.6 (C-22),76.9 (C-23),28.2 (C-24),21.7 (C-25),14.0 (C-26),17.3 (C-27),20.5 (C-28),20.0 (C-29),10.7 (C-30),7.4 (C-31),12.3 (C-32),14.1 (C-33),164.3 (C-1′),132.8 (C-2′),132.6 (C-3′),163.7 (C-4′),114.9 (C-5′),175.6 (C-6′),26.2 (C-7′),32.6 (C-8′),198.1 (C-9′)。 以上数据与文献[10,11]报道一致,故鉴定为Bafilomycin B2。
1.2 化合物抑菌活性结果
通过对9株病原菌株的测试,发现化合物1对所测试病原菌均无活性,化合物2和3对多种植物病原菌具有抑制活性,包括玉米大斑病菌、玉米小斑病菌、水稻纹枯病菌、玉米弯孢病菌和小麦赤霉病菌。相较于制霉菌素,化合物3对大豆根腐病菌的抑制活性略强(见表1)。
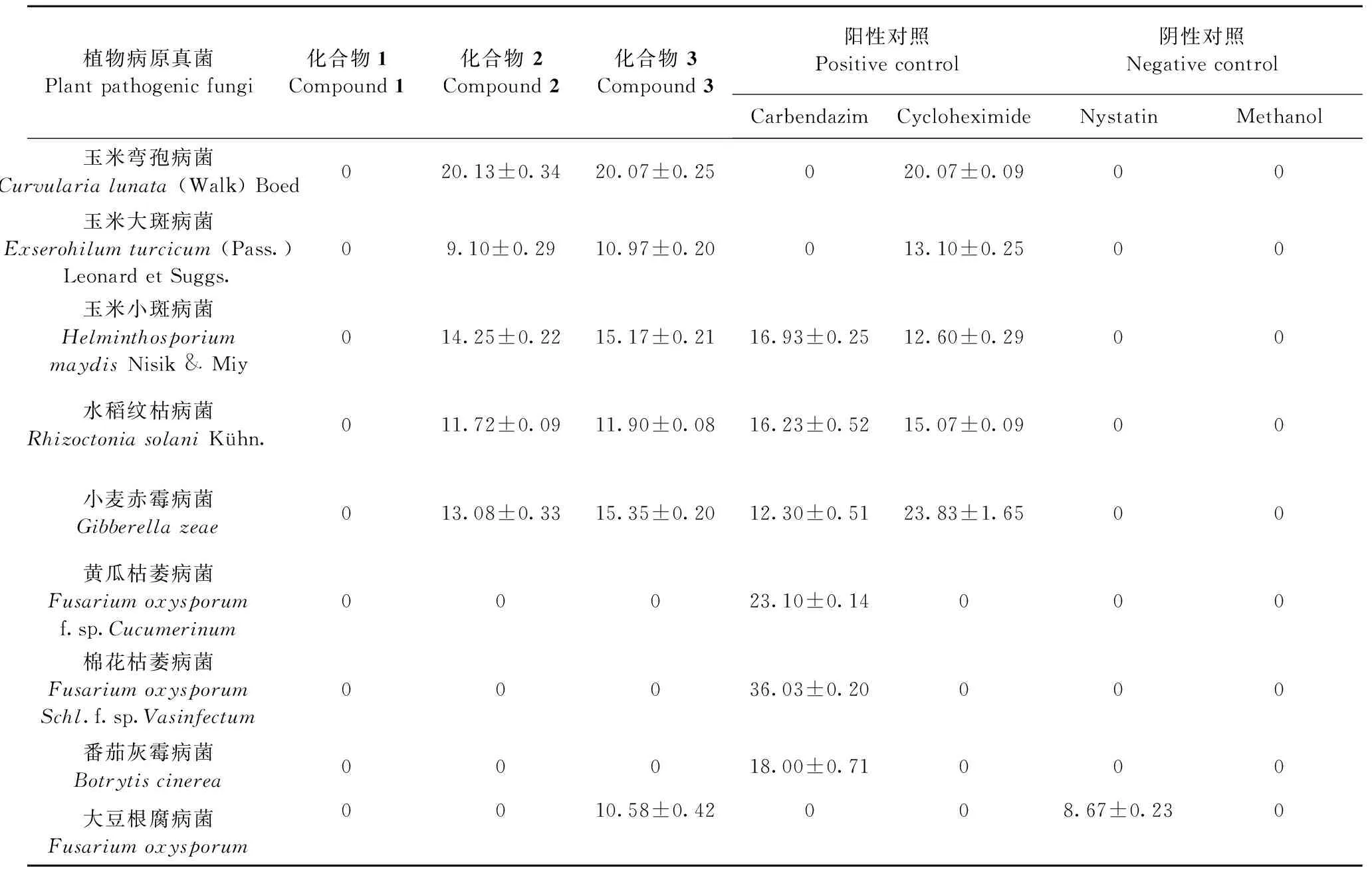
表1 化合物1~3抑菌圈直径(mm)
注:表中数据均为3次重复平均值。
Note:Data given were from 3 duplicates.
3 讨论
本文从链霉菌 KIB-H1556 菌株发酵液中分离得到3个化合物。其中Bafilomycin D通过抑制种子的萌发和生长而表现出除草活性[12],Bafilomycin B1和Bafilomycin B2等类化合物对液泡(V型)H+-ATPase具有抑制作用[13]。Bafilomycins类化合物是从链霉菌中分离得到的16元二烯大环内酯抗生素,由于其具有生物活性,且含有不同的特征侧链,这种独特的大环内酯结构已被广泛研究[14,15]。然而,在寻找新抗生素的同时,针对新的靶标,测试已知生物活性的代谢物对新靶标的生物活性,也显示出有希望的结果[16]。因此,对这些大环内酯类抗生素进行多种病原体的活性测试,可以揭示其具有新的生物活性及潜在用途。本实验首次发现化合物2和3具有广谱抗真菌活性,尤其对玉米病原真菌的抑制活性显著,为进一步研究开发抑制植物病害的生物农药奠定一定的前期基础。
