菊芋粕菊粉的酶法提取、组成及抗氧化活性研究
2019-09-05王晓喜李国强乔亚俊杜玉枝李天才毕宏涛
王晓喜,李 雁,李国强,陈 琦,乔亚俊,杜玉枝,李天才*,毕宏涛*
1中国科学院西北高原生物研究所 青海省藏药药理学与安全性评价研究重点实验室,西宁 810000;2中国科学院大学,北京 100049
菊芋(HelianthustuberosusL.)系菊科向日葵属植物,菊粉是其主要的干物质组成成分,含量占比超过干物质重量的60%[1]。菊芋是我国菊粉工业化生产的主要原料,目前其工业化提取技术以连续热水浸提法为主[2]。菊芋菊粉生产过程产生大量的废弃物——菊芋粕,其湿重约占原料重量的65%,大多作为饲料直接出售[3]。由于菊芋粕中含有大量的糖类物质[4],主要包括果胶和未提取完全的菊粉[5],所以为了充分利用菊芋资源,提高菊芋产品的附加值,菊芋粕的再次利用越来越受到业界的关注。目前,菊芋粕再利用研究主要集中于果胶、果糖和蛋白质等成分的提取技术[6]。由于菊芋粕中含有大量的果胶,而难溶性原果胶所形成的细胞骨架,严重妨碍了菊芋粕中菊粉的提取,所以尚缺少菊芋粕菊粉的高效提取技术,造成菊芋菊粉的整体产率无法有效提升。本研究针对菊芋粕菊粉提取效率低的难题,采用果胶酶辅助提取方法对菊芋粕菊粉的高效提取技术进行研究,并对菊芋粕菊粉的抗氧化能力进行评价,以期为菊芋粕的再利用提供新思路。
1 材料与方法
1.1 材料与试剂
鲜菊芋块茎,甘肃白银熙瑞生物工程有限公司提供;果胶标准品,购自北京索来宝科技有限公司;D-半乳糖醛酸,水溶性维生素E(Trolox)、二苯基苦基苯肼(DPPH),购自美国Sigma-Aldrich公司;蔗果三糖、蔗果四糖、蔗果五糖标准品,购自西宝生物科技(上海)股份有限公司;果胶酶(CAS号:9032-75-1),自南宁东恒华道生物科技有限公司;2,2-联氨基双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS二胺盐),购自生工生物工程(上海)股份有限公司;辣根过氧化物酶(HRP),购自上海源叶生物科技有限公司;菲啰嗪,购自上海玉博生物科技有限公司;二乙氨乙基纤维素(DEAE纤维素),上海恒信化学试剂有限公司;其余试剂均为国产分析纯试剂。
1.2 仪器与设备
SJZX多功能酶标仪,珀金埃尔仪器有限公司;FDU-1100型冷冻干燥机,EYELA东京理化器械株式会社;Mettler Toledo AL104分析天平,瑞士Mettler-Toledo公司;Sigma 3-18KS离心机,德国Sigma公司;Milli-Q Academic A10超纯水系统,美国Millipore公司;IS50傅里叶变换红外近红外-拉曼光谱连用仪,美国thermo公司;LC-10CT液相色谱仪,岛津日本公司。
1.3 菊粉的提取及含量测定
新鲜菊芋块茎切成薄片,按照1∶5(w/w)料液比,沸水中提取1 h,纱布过滤后,分别收集滤液和菊芋粕。滤液浓缩后冷冻干燥,得到初提粗菊粉样品,-20 ℃保存备用。新鲜菊芋粕冷冻干燥后,粉碎、过筛,按照料液比1∶20(w/w),加入含有果胶酶的0.1 mol/L柠檬酸-柠檬酸钠缓冲液,在一定温度范围加热提取。提取液离心后,收集上清液,测定总糖含量和还原糖含量,计算非还原糖得率。
果胶酶酶活按照Zhang等[7]方法进行测定,以果胶酶每分钟分解果胶产生1 μmol半乳糖醛酸定义为1个酶活。总糖含量的测定以果糖为标准品采用苯酚-硫酸法,还原糖含量的测定以葡萄糖为标准品采用二硝基水杨酸(DNS)法,菊粉得率计算公式如下:
非还原糖得率(%)=(总糖含量-还原糖含
量)/菊芋粕重量×100%
1.4 菊芋粕中菊粉的酶法提取工艺优化
以酶加量(U/g)、提取pH、提取温度、提取时间4个因素作为指标,先后进行单因素试验,确定各因素的适宜提取范围,然后以各因素的适宜提取范围作为响应曲面设计试验的不同水平进行响应曲面设计,从而确定最佳提取条件。
1.4.1 pH值对菊粉得率的影响
固定提取条件为提取温度50 ℃、酶底比6.5 U/g、提取时间1.5 h,考察不同pH(3.5、4.0、4.5、5.0、5.5、6.0)对菊粉得率的影响。
1.4.2 提取温度对菊粉得率的影响
固定提取条件为pH4.5、酶底比6.5 U/g、提取时间1.5 h,考察不同提取温度(40、45、50、55、60 ℃)对菊粉得率的影响。
1.4.3 酶底比对菊粉得率的影响
固定提取条件为pH4.5、温度50 ℃、提取时间1.5 h,考察不同酶底比条件(0.315、0.625、1.25、2.5、5、10、15、20、40 U/g)对菊粉得率的影响。
1.4.4 提取时间对菊粉得率的影响
固定条件为pH4.5、温度50 ℃、酶底比10 U/g,考察不同提取时间(0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 h)对菊粉提取率的影响。
1.4.5 菊芋粕中菊粉的酶法提取工艺的响应曲面设计实验
在单因素实验基础上,进行4因素3水平的响应曲面设计(Box-Benhnken中心组合法)实验,以菊粉得率为响应值,各因素的3个水平采用-1、0、1进行编码(见表1)。

表1 响应面设计试验因素水平和编码
1.5 菊芋菊粉的纯化及含量测定
菊芋粕酶法提取的粗菊粉提取液,沸水浴灭活果胶酶后离心去除沉淀,上清液经蒸馏水透析(截留分子量500 Da)除盐后冷冻干燥,得到菊芋粕酶法提取粗菊粉。随后,初提粗菊粉和菊芋粕酶法提取粗菊粉,分别采用DEAE-纤维素阴离子交换色谱柱(55 cm×10.5 cm i.d.)进行纯化,收集蒸馏水洗脱部分,凝缩后冷冻干燥,得到纯化菊粉样品,分别命名为初次水提菊粉(primary water-extracted inulin,PWI)和二次酶提菊粉(secondary enzymatic-extracted inulin,SEI)。
纯化后菊粉样品的蛋白质含量采用考马斯亮蓝法测定(牛血清白蛋白为标准品),糖醛酸含量采用间羟基联苯法测定(半乳糖醛酸为标准品),菊粉含量测定方法同1.3所述。
1.6 菊粉聚合度的测定
菊粉样品的聚合度采用疏水相互作用液相色谱法(HILIC)[8]进行测定,应用分析型麦芽糖基键合色谱柱(analytical ‘click’ maltose column,5 μm,100 Å,100× 4.6 mmid,浙江华谱新创科技有限公司),蔗果三糖、蔗果四糖和蔗果五糖为标准品,流动相为65%乙腈水溶液,流速为1.0 mL/min,柱温为30 ℃。
1.7 体外抗氧化活性的测定
总抗氧化能力采用ABTS法测定,样品总抗氧化能力以Trolox当量(TEAC,即每克样品相当于x毫克Trolox,mgTE/g)及ABTS自由基清除率表示[9];有机自由基DPPH清除能力,按照Arise等(2016)方法[10]测定;羟基自由基(·OH)清除能力,按照Halliwell等[11]的方法测定;超氧负离子清除能力,采用NADH-NBT-PMS体系[12]测定;还原力采用FRAP方法[13]测定;二价铁离子螯合能力,采用Dinis等[14]的方法测定,EDTA作为阳性对照物。
1.8 数据处理
每项实验均重复6次,取平均值,数据以平均值±标准差的形式表述。采用Design-Expert 8.0.6软件进行响应面优化实验的作图及分析。采用GraphPad Prism 5.0软件作图及分析数据,one-way ANOVA进行显著性检验,P<0.05为显著性差异。
2 结果分析
2.1 pH值对菊粉得率的影响
从图1A可以看出,pH值对菊粉得率影响显著,菊粉得率随着pH值升高呈先增加后降低的趋势,在pH4.5时,菊粉得率达到最大值33.16%。这可能是由于在pH4.5时果胶酶的酶活最高,其造成的细胞壁中果胶类多糖的破坏促进了菊粉成分溶出。
2.2 温度对菊粉得率的影响
如图1B所示,在40~60 ℃范围,菊粉得率随着温度的升高呈现先上升后下降的趋势,在50 ℃时得率最高,菊粉得率为31.76%。可见,该温度下果胶酶酶活作用与菊粉溶解性共同促进了菊芋粕菊粉的溶出。
2.3 酶底比对菊粉得率的影响
如图1C所示,菊粉得率随着酶底比的增加呈现先增加后下降的趋势。在酶底比0.315~2.5 U/g时,菊粉得率随酶底比增加而显著上升;2.5~20 U/g范围内,菊粉得率变化较小,10 U/g时菊粉得率最高,达到35.08%;酶底比大于20 U/g时,菊粉得率随酶底比增加而显著下降。上述结果可能由于酶底比较低时,果胶酶未能充分破坏细胞壁,而在较高酶底比时,提取液粘度增大造成菊粉不易溶出。
2.4 提取时间对菊粉得率的影响
如图1D所示,当提取时间不足1.5 h时,延长提取时间可以显著增加菊粉得率。提取1.5 h时,菊粉得率为33.1%,继续延长提取时间对菊粉得率的影响较小。
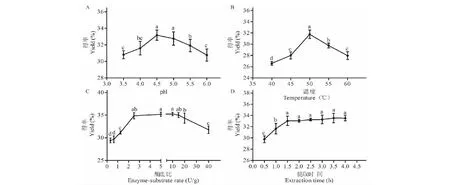
图1 pH值(A)、提取温度(B)、酶底比(C)、提取时间(D)对菊芋粕菊粉得率的影响Fig.1 Effects of pH,extraction temperature,enzyme-substrate ratio and extraction duration on the yield 注:图中小写字母表示单因素实验中具有显著差异的不同处理组(P<0.05)。Note:Lowercase letters mean a significant difference among the different treatments at P<0.05 level in single factor experiment.
2.5 响应曲面设计实验结果
在单因素实验基础上,根据Box-Benhnken中心组合法实验设计原理,以菊粉提取率为响应值,以pH值(A)、温度(B)、酶底比(C)、提取时间(D)为自变量,建立四因素三水平中心组合实验设计,共包括29个实验方案,24个分析试验点,5个中心试验点,用来计算试验误差。菊芋粕菊粉提取的响应面实验设计及结果见表2。

表2 响应面实验设计及结果
续表2(Continued Tab.2)
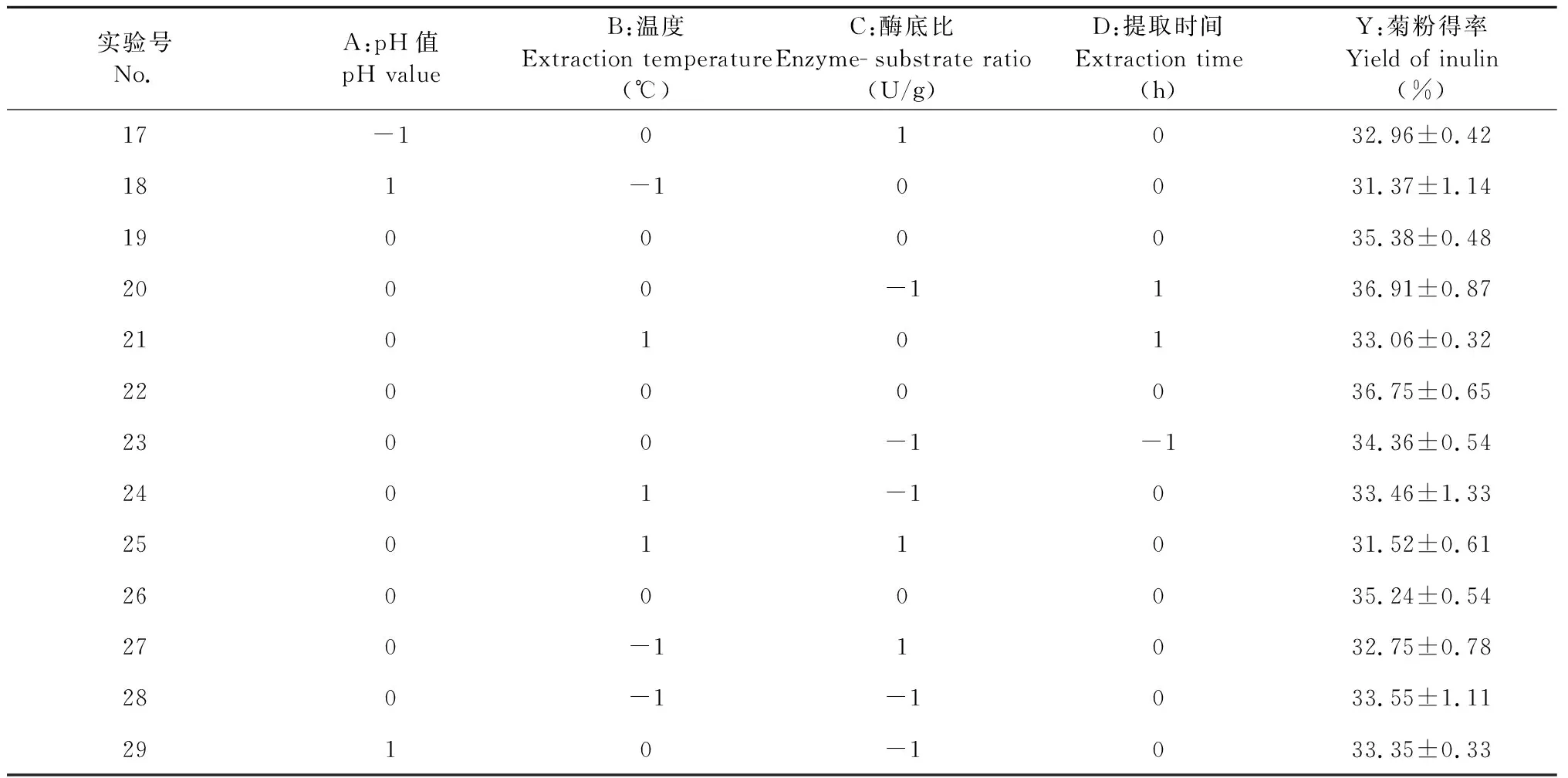
实验号No.A:pH值pH valueB:温度Extraction temperature(℃)C:酶底比Enzyme-substrate ratio(U/g)D:提取时间Extraction time (h)Y:菊粉得率Yield of inulin (%)17-101032.96±0.42181-10031.37±1.1419000035.38±0.482000-1136.91±0.8721010133.06±0.3222000036.75±0.652300-1-134.36±0.542401-1033.46±1.3325011031.52±0.6126000035.24±0.54270-11032.75±0.78280-1-1033.55±1.112910-1033.35±0.33
2.5.1 回归模型的建立
采用Design-Expert 8.0.6对所得数据进行回归分析,对各因素回归拟合后,得到回归方程如下:
Y=35.66-0.077A-0.52B-0.91C+0.59D
+0.79BC+0.79AD-0.76BD-2.05A2
-1.76B2-1.01C2
2.5.2 回归模型的方差分析
为了确定响应面实验设计中4个因素对菊粉提取效果的影响,以及各个因素的交互作用和显著性,进行回归方差分析(表3)。结果表明,失拟项不显著(P>0.05),而模型极显著(P<0.000 1),其中R2=0.901 1,说明预测值和实际值具有高度的相关性。通过模拟系数显著性性检验,得到提取因素的主效应关系:A>D>C>B,即酶底比>pH值>提取温度>提取时间,因素BD、AB、AD和C2对提取效果显著,而因素A、B、C、A2、B2、C2对提取效果具有极显著的影响。
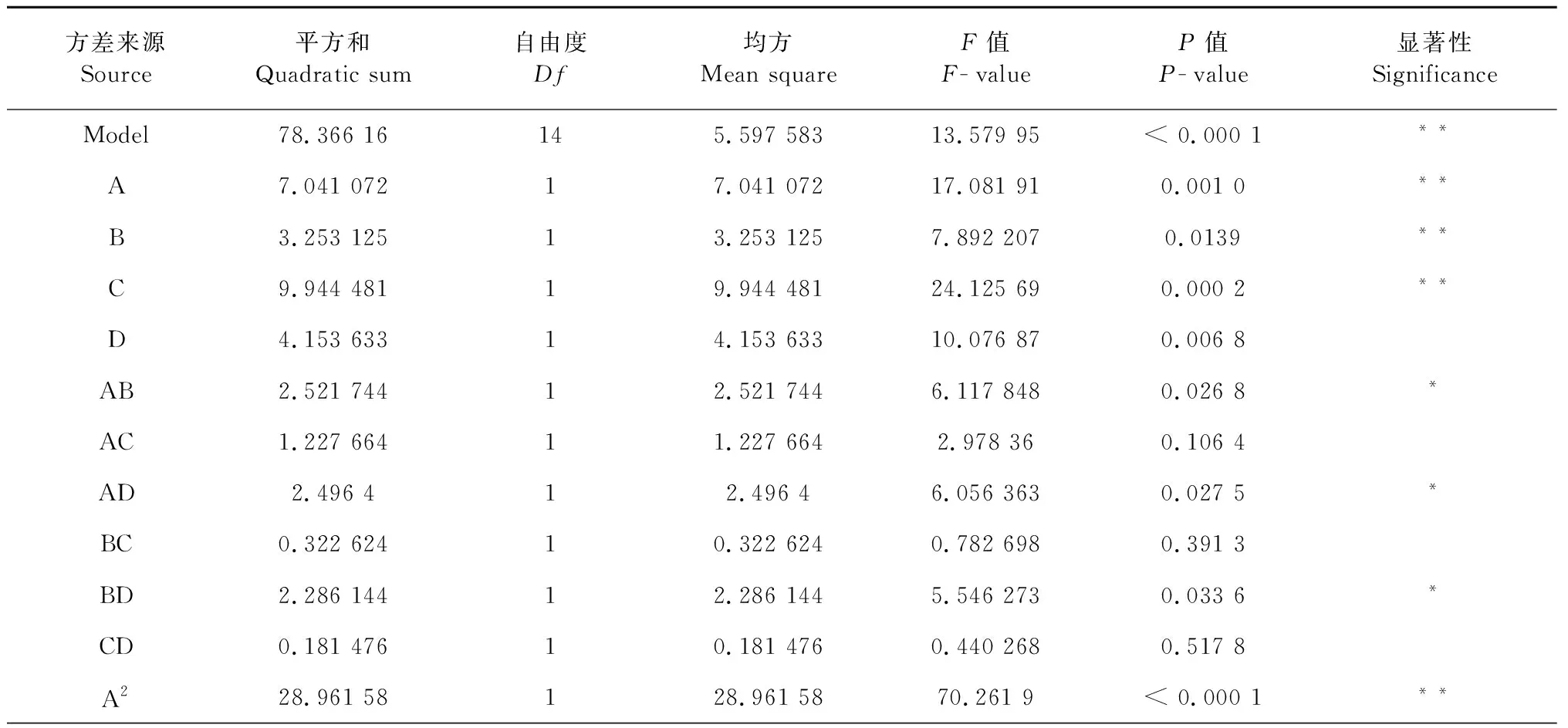
表3 方差分析结果
续表3(Continued Tab.3)
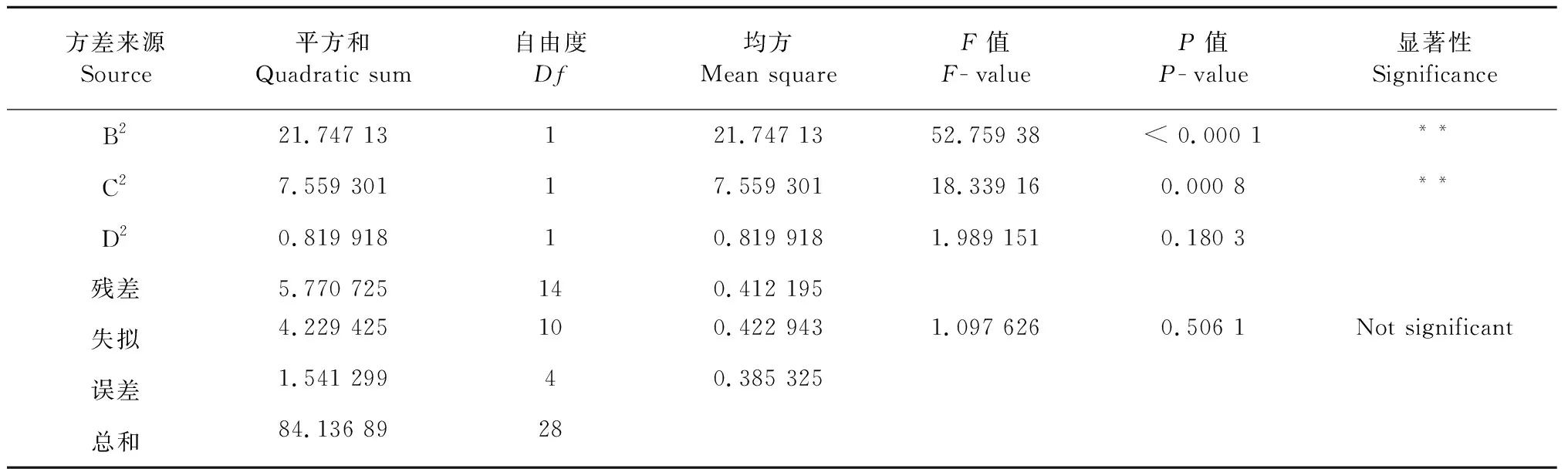
方差来源Source平方和Quadratic sum自由度Df均方Mean square F值F-valueP值P-value显著性SignificanceB221.747 13121.747 1352.759 38< 0.000 1**C27.559 30117.559 30118.339 160.000 8**D20.819 91810.819 9181.989 1510.180 3残差5.770 725140.412 195失拟4.229 425100.422 9431.097 6260.506 1Not significant误差1.541 29940.385 325总和84.136 8928
注:**P<0.01为极显著;*P<0.05为显著。
Note:**P<0.01was considered to be extremely significant;*P<0.05 was considered to be significant.
2.5.3 响应面分析
根据软件Design-Expert获得响应值的3D曲面,分析各因素对菊粉得率的影响及各因素之间的交互作用。图2~7中所示为pH、提取温度、酶底比、提取时间中任意两个因素为零水平时,其余两个因素间的交互作用对菊粉得率的影响。菊粉的得率随其中任意两个变量的增加均呈上升趋势,达到某一定值时,曲面稍下降或趋于平缓。图2、4和6曲面陡峭,说明pH和温度、pH和时间、温度和时间之间交互作用明显,与方差分析结果一致。
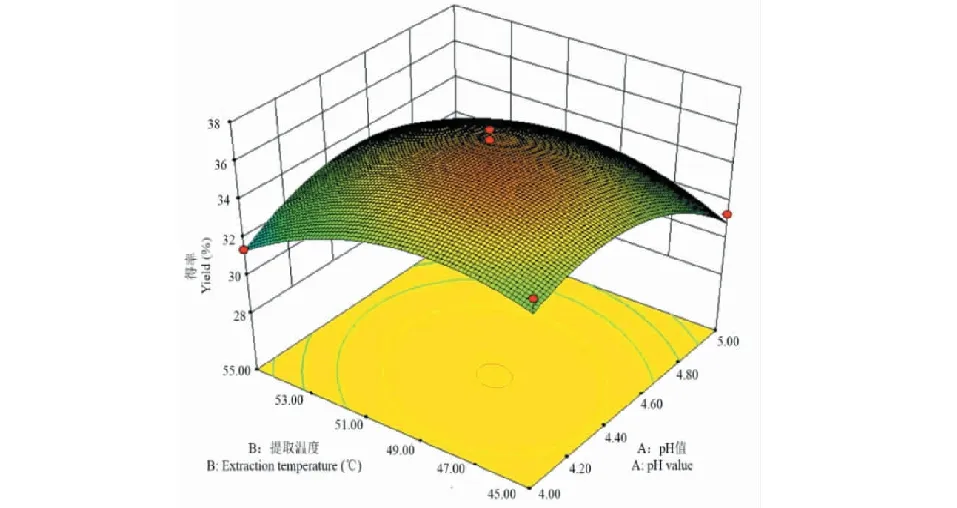
图2 pH值和提取温度对菊粉得率影响的响应面图Fig.2 Response surface plot for pH value and extraction temperature effect on the yield of inulin

图3 pH值和酶底比对菊粉得率影响的响应面图Fig.3 Response surface plot for pH value and enzyme-substrate ratio effect on the yield of inulin
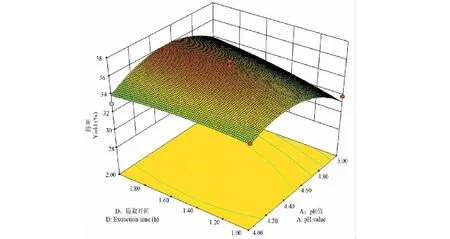
图4 pH值和提取时间对菊粉得率影响的响应面图Fig.4 Response surface plot for pH value and extraction time effect on the yield of inulin
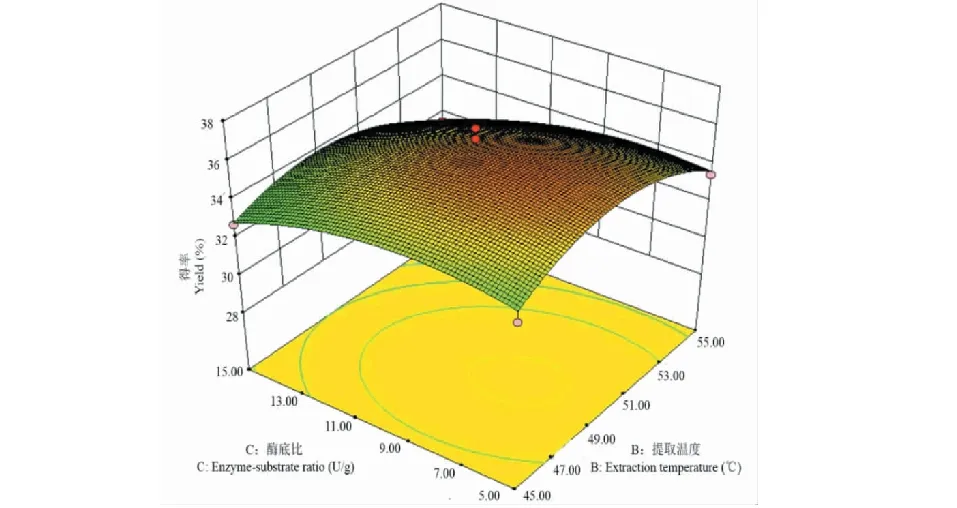
图5 提取温度和酶底比对菊粉得率影响的响应面图Fig.5 Response surface plot for extraction temperature and enzyme-substrate ratio effect on the yield of inulin
2.5.4 参数优化及最优条件的验证
在选取的因素范围内,根据上述回归模型分析得出,SEI的最佳酶法提取条件为:pH值4.51、提取温度48.46 ℃、酶底比7.59 U/g、提取时间2 h。根据最佳条件和实际提取条件可操控性,调整提取条件为:pH4.5、提取温度50 ℃、酶底比7.5 U/g、提取时间2 h。经3次重复实验,测得的SEI得率为35.30%±0.85%,与预测值36.6%无显著差别,说明上述模型与实际情况拟合较好。与传统热水浸提法相比(提取条件:料液比1∶20 w/w、提取时间2 h,提取温度80 ℃,菊粉得率:25.26%±0.50%),SEI得率提高38.16%。

图6 提取温度和提取时间对菊粉得率影响的响应面图Fig.6 Response surface plot for extraction temperature and extraction time effect on the yield of inulin
2.6 初次水提菊粉(PWI)和二次酶提菊粉(SEI)组成成分比较
由于提取顺序和提取方式的不同可能会对菊粉的组成产生影响,我们对PWI和SEI的组成成分进行了测定。结果如表4、表5所示,SEI的总糖和菊粉含量均显著高于PWI(P<0.05)。在菊粉聚合度方面,PWI中蔗果三糖和蔗果四糖含量较高,而SEI中蔗果五糖、蔗果六糖及其以上聚合度菊粉的含量较高。该结果可能是由于低聚合度菊粉溶解度较大而最先被提取,而聚合度较高的菊粉溶解度较小或受限于果胶等细胞壁成分束缚而较难被提取。当采用果胶酶辅助提取时,细胞壁成分被破坏,聚合度较高的菊粉被提取出来。
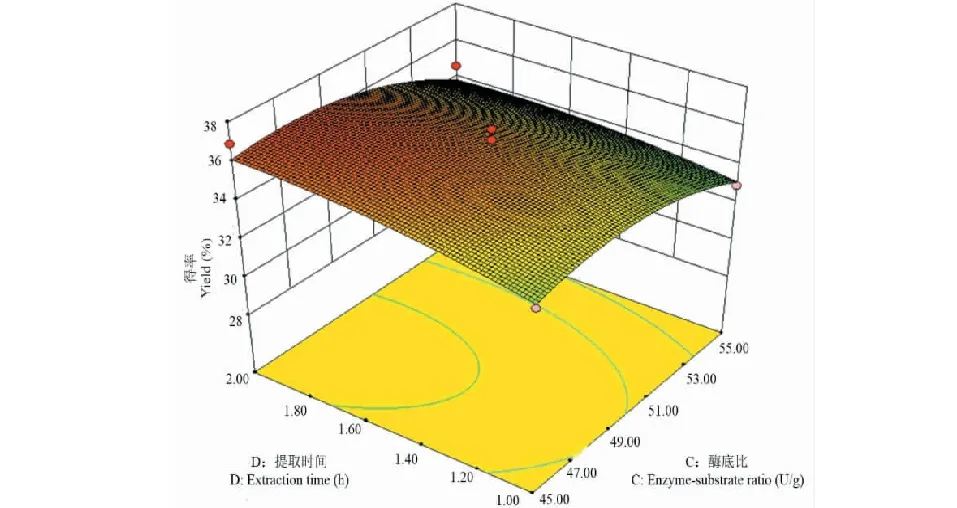
图7 酶底比和提取时间对菊粉得率影响的响应面图Fig.7 Response surface plot for enzyme-substrate ratio and extraction time effect on the yield of inulin

表4 纯化菊粉组分的总糖、菊粉、半乳糖醛酸和蛋白质含量
注:不同小写字母表示PWI和SEI之间具有显著性差异(P<0.05)。
Note:Different lowercase letters indicate a significant difference between PWI and SEI (P<0.05).

表5 纯化菊粉组分的聚合度组成分析结果
注:不同小写字母表示PWI和SEI之间具有显著性差异(P<0.05)。
Note:Different lowercase letters indicate a significant difference between PWI and SEI (P<0.05).
2.7 抗氧化活性测定结果
2.7.1 总抗氧化能力
采用总抗氧化能力法测定ABTS自由基清除能力,Trolox为标准品,标准曲线绘制以Trolox含量X(ng/μL)为横坐标,ABTS自由基清除率Y(%)为纵坐标,回归方程为Y=0.007 5X(R2=0.997 1)。结果如图8所示,PWI和SEI的ABTS自由基清除能力均随着样品浓度增加而上升。当样品浓度为5 mg/mL时,SEI的ABTS自由基清除能力显著优于PWI(P<0.05),二者TEAC值分别为3.93±1.02和2.95±0.47 mg TE/g。
2.7.2 DPPH自由基清除能力
如图9所示,两种菊粉样品的DPPH清除能力均随着剂量浓度的增加而呈上升趋势。在0~0.4 mg/mL浓度范围内,SEI的DPPH清除能力优于PWI,但是在0.4~0.6 mg/mL浓度范围时二者差异发生反转,0.6~1.0 mg/mL时PWI的DPPH清除能力显著优于SEI。1.0 mg/mL浓度时,PWI和SEI的DPPH清除率分别为15.1%±0.139%和10.6%±0.76%。
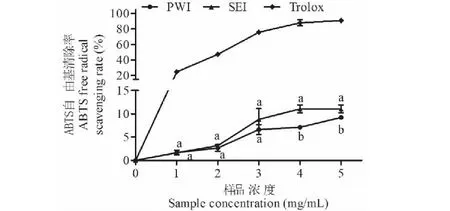
图8 初次水提菊粉(PWI)和二次酶提菊粉(SEI)的总抗氧化能力Fig.8 Total antioxidant capacities of primary water-extracted inulin (PWI) and secondary enzymatic-extracted inulin (SEI).注:不同小写字母表示PWI和SEI之间具有显著性差异(P<0.05)。Note:Different lowercase letters indicate a significant difference between PWI and SEI (P<0.05).
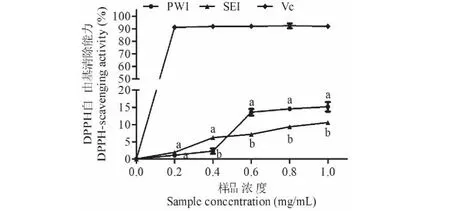
图9 初次水提菊粉(PWI)和二次酶提菊粉(SEI)的DPPH自由基清除率测定结果Fig.9 DPPH-scavenging activities of primary water-extracted inulin (PWI) and secondary enzymatic-extracted inulin (SEI).注:不同小写字母表示PWI和SEI之间具有显著性差异(P<0.05)。Note:Different lowercase letters indicate a significant difference between PWI and SEI (P<0.05).
2.7.3 羟基自由基(·OH)清除能力
如图10所示,两种菊粉样品的·OH清除率均随着浓度的增加而上升。在1~5 mg/mL浓度范围内,PWI的·OH清除率为1.58%~18.01%,SEI的·OH清除率为1.15%~19.32%。在1和4 mg/mL浓度时,PWI清除能力显著高于SEI(P<0.05);5 mg/mL时,SEI清除能力显著高于PWI(P<0.05)。
2.7.4 超氧负离子清除能力
如图11所示,两种菊粉样品的超氧负离子清除能力均随着剂量浓度的增加而增强,但是SEI比PWI的超氧负离子清除能力增强幅度更加显著。在1 mg/mL浓度时,PWI的超氧负离子清除能力显著优于SEI,而3~5 mg/mL浓度时,SEI的超氧负离子清除能力显著优于PWI。5 mg/mL浓度时,PEI和SEI的超氧负离子清除率分别为16.47%±0.25%和20.15%±0.68%(P<0.05)。
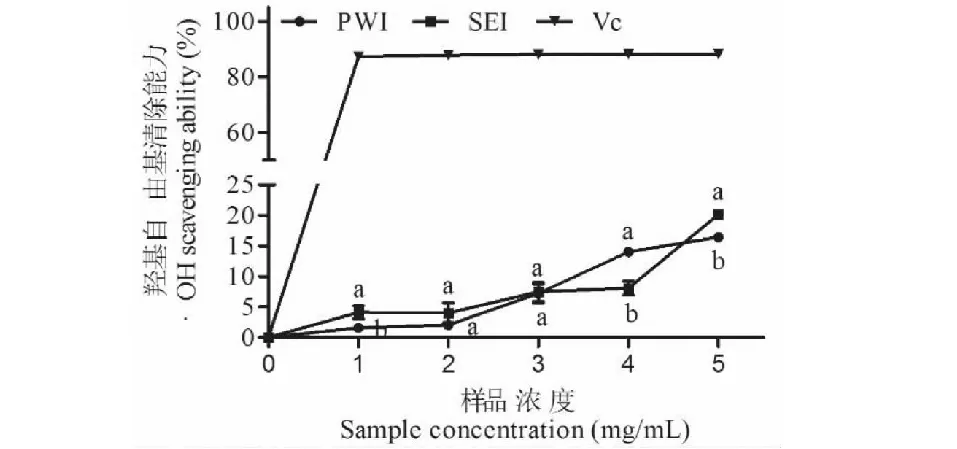
图10 初次水提菊粉(PWI)和二次酶提菊粉(SEI)的·OH清除能力Fig.10 Hydroxyl radical-scavenging activities of primary water-extracted inulin (PWI) and secondary enzymatic-extracted inulin (SEI).注:不同小写字母表示PWI和SEI之间具有显著性差异(P<0.05)。Note:Different lowercase letters indicate a significant difference between PWI and SEI (P<0.05).

图11 初次水提菊粉(PWI)和二次酶提菊粉(SEI)的超氧负离子清除能力Fig.11 Superoxide anion scavenging activities of primary water-extracted inulin (PWI) and secondary enzymatic-extracted inulin (SEI).注:不同小写字母表示PWI和SEI之间具有显著性差异(P<0.05)。Note:Different lowercase letters indicate a significant difference between PWI and SEI (P<0.05).
2.7.5 Fe2+螯合能力
如图12所示,SEI的Fe2+螯合能力呈浓度剂量依赖关系,随着浓度的增加而上升。在5 mg/mL时,其Fe2+螯合率达到15.02±0.50%。然而,PWI未表现出Fe2+螯合能力。
2.7.6 还原力
如图13所示,两种菊粉样品的还原力随浓度增加而增强。在样品浓度为5 mg/mL时,二者的还原力达到了最大值,其中PWI的还原力显著优于SEI,700 nm时二者的吸光度分别为0.129±0.006和0.083±0.006(P<0.05)。
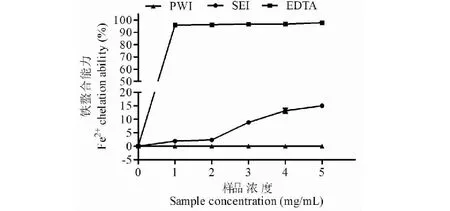
图12 初次水提菊粉(PWI)和二次酶提菊粉(SEI)的Fe2+螯合能力Fig.12 Fe2+chelation abilities of primary water-extracted inulin (PWI) and secondary enzymatic-extracted inulin (SEI)
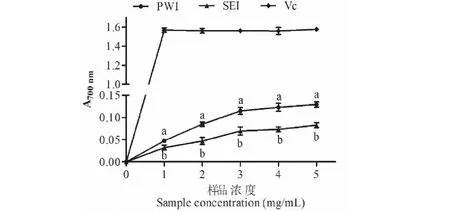
图13 初次水提菊粉(PWI)和二次酶提菊粉(SEI)的还原力Fig.13 Reducing power of primary water-extracted inulin and secondary enzymatic-extracted inulin.注:不同小写字母表示PWI和SEI之间具有显著性差异(P<0.05)。Note:Different lowercase letters indicate a significant difference between PWI and SEI (P<0.05).
3 结论
菊粉是由D-果糖经β-l,2糖苷键连接而成的线性直链状多糖,末端常含一个葡萄糖残基。欧洲的菊粉工业化生产以菊苣为原料,在我国则以菊芋为原料。我国开展菊芋菊粉研究的起步较晚,且无法应用欧洲的菊苣工业化生产技术,因此导致了菊芋菊粉生产工艺相对落后。目前,我国菊芋菊粉的工业生产大多采用甜菜制糖的提取设备和生产工艺。魏凌云等采用响应面法对菊芋菊粉的热水浸提工艺进行了优化,在自然pH值、温度为76.7 ℃、液固比为 10.56∶1(v/w)、提取时间20 min的最佳工艺条件下,菊粉提取率达到83.6%[15]。胡建锋等采用超声波辅助提取技术对菊粉热水提取工艺进行改进,菊粉得率达到 63.37%[16]。上述热水浸提生产菊芋菊粉的过程中,产生了大量的工业废弃物-菊芋粕。菊芋粕中仍含有果胶、菊粉、纤维素/半纤维素等大量糖类化合物,其中菊粉含量最多可达到6%。因此,从菊芋粕中深层提取菊粉,有望在不改变原有菊粉生产工艺的条件下,以较低成本解决国内企业菊芋菊粉提取效率低的产业化瓶颈问题。目前,研究人员已经开始关注菊芋粕的高效利用,已有关于菊芋粕中果胶和单糖的二次利用研究的报道[1,8],但是还没有关于菊芋粕中菊粉提取技术的报道。
本研究以菊芋粕为研究材料,采用酶法提取技术对其中残留菊粉进行深层提取,提高残余菊粉的提取效率,并对PWI和SEI的组成和抗氧化活性进行比较研究,初步探讨提取方式和顺序对菊粉组成和活性的影响。结果表明,采用响应面法优化的果胶酶辅助提取菊粉的最佳工艺(pH值4.5、提取温度50 ℃、酶底比7.5 U/g、提取时间2 h),菊芋粕菊粉的得率比传统热水浸提法提高38.16%。已有研究发现,提取方法能够影响多糖的抗氧化活性,特别是酶法提取多糖较传统热水水提多糖具有更强的抗氧化能力[19,20]。同样,本研究结果表明,SEI的抗氧化活性优于PWI。体外抗氧化活性评价方法涉及到自由基链反应的引发、传递与终止每个环节,并且测得不同体外抗氧化活性评价方法之间的抗氧化活性基本趋势一致。二者产生抗氧化能力差异的原因推测可能有2个方面:(1)SEI羟基等活性基团暴露量较多,易与自由基充分作用,进而能将更多的自由基转变成稳定的物质,终止自由基的链反应;(2)SEI中高聚合度菊粉含量较高,粘度较大,易于结合那些能与H2O2反应的金属离子,形成螯合物,从而遏抑羟基自由基的产生[21]。综上所述,本研究发现果胶酶酶法提取技术能够显著增加菊芋粕菊粉的得率,且酶法提取菊芋粕菊粉(SEI)与热水初次提取菊芋菊粉(PWI)相比抗氧化能力更强。因此,果胶酶辅助提取方法有望为菊芋粕菊粉的高效利用问题提供新的解决思路。
