甲醛对鱿鱼肌原纤维蛋白凝胶特性的影响
2019-09-04李颖畅宋素珍杨钟燕杨贤庆仇长璐励建荣
李颖畅 宋素珍 杨钟燕 杨贤庆 魏 涯 王 晓 仇长璐 沈 琳 励建荣
(1 渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心辽宁锦州121013 2 中国水产科学研究院南海水产研究所 广州510641 3 大连东霖食品股份有限公司 辽宁大连116101)
甲醛 (formaldehyde,FA) 是一种活性反应物质,能够与蛋白质的许多官能团发生反应,尤其是侧链游离氨基酸。理论上一个FA 分子能够与两个氨基反应,通过相邻多肽的亚甲基桥形成分子内和分之间的交联[1],从而使蛋白质溶解度降低,产品质地硬化、纤维化等,降低产品的商业价值和营养价值[2]。据文献[3]报道,当FA 存在时,在一定条件下部分氨基酸(赖氨酸、酪氨酸等)与其发生反应。Chanarat 等[4]研究表明,贮藏过程中狗母鱼鱼糜中FA 含量的增大和蛋白质发生交联,导致鱼糜凝胶形成性变差,鱼糜凝胶的破断力增大,影响其品质。Sikorski 等[5]报道FA 与蛋白反应,导致构象发生改变,蛋白质的溶解性下降。秘鲁鱿鱼,资源丰富且营养价值高,目前已成为我国重要的经济类海产品。因其无骨刺、易加工以及食用比例高(比一般鱼类的可食比例高出20%左右)等优点而日益受到鱼糜生产者的关注,目前主要加工产品为鱿鱼丝、鱿鱼串或者鱼丸。然而,有研究发现,鱿鱼等水产品中含有较高含量的FA 和二甲胺(dimethylamine,DMA)[6]。为此本试验以秘鲁鱿鱼肌原纤维蛋白为研究对象,通过体外模拟向其中加入一定浓度的FA 溶液,热诱导形成凝胶,探讨FA 对鱿鱼肌原纤维蛋白凝胶特性及结构的影响。
1 材料与方法
1.1 材料与试剂
秘鲁鱿鱼,锦州市林西路水产市场;食盐,锦州市新玛特超市;三羟甲基氨基甲烷(Tris)、2-硝基苯甲酸(DTNB),上海阿拉丁生化科技股份有限公司;曲拉通X-100(TritonX-100),北京化学试剂公司;氯化钾、磷酸氢二钠、磷酸二氢钠、无水乙醇、酒石酸钾钠、硫酸铜、氢氧化钠、脲素,天津市风船化学试剂科技有限公司;浓盐酸,锦州市古城化学试剂厂;甲醛溶液,天津市天力化学试剂有限公司;25%戊二醛溶液,天津市福晨化学试剂厂;β-巯基乙醇,山东西亚化学工业有限公司;以上试剂无特殊说明皆为分析纯级。
1.2 仪器与设备
MS105DU 电子分析天平,瑞士METTLER TOLEDO 公司;FE20 型pH 计,美国METTLER TOLEDO 公司;UV-2550 紫外-可见分光光度仪,岛津仪器(苏州)有限公司;CR-400 色彩色差计、S4800 场发射扫描电镜、E-1045 镀金仪,日本Minolta 公司;NM120 低场核磁共振仪,上海纽迈电子科技有限公司;THERMO X1R 冷冻高速离心机,美国Thermo 公司;HH-6 恒温水浴锅,国华电器有限公司。
1.3 方法
1.3.1 肌原纤维蛋白的提取 参照Bertram 等[7]方法,略作修改。将秘鲁鱿鱼自然解冻,去皮,取酮体肉,加3 倍体积A 液 (0.1 mol/L KCl、0.02 mol/L Tris-HCl,pH 7.5)和1 倍体积B 液(1% Triton X-100、0.1 mol/L KCl、0.02 mol/L Tris-HCl 缓冲液,pH 7.5),均质(10 000 r/min,30 s,至少6 次,以防过热),纱布过滤(除去结缔组织),离心(4 ℃,10 000 r/min,10 min),去上清液,沉淀用4 倍体积A 液浸提,重复4 次,所得沉淀即肌原纤维蛋白。用双缩脲法测定其蛋白质含量,所有操作均在4℃条件下进行,贮存在-80 ℃超低温冰箱中,备用。
1.3.2 肌原纤维蛋白凝胶的制备 参考Chanarat等[4]的方法,略作修改。将肌原纤维蛋白从-80 ℃超低温冰箱取出,置4 ℃冰箱内过夜解冻,加3%的氯化钠并分别添加甲醛 (0,1,2,3,4 和5 μL/g蛋白),4 ℃氧化3 h,转入直径为25 mm 的柱形小瓶中,4 000 r/min 离心2 min (除气泡),40 ℃恒温水浴中加热50 min,再90 ℃加热30 min,冰水冷却15 min,取出后置4 ℃冰箱内过夜,待测。
1.3.3 白度的测定 先将样品置室温下30 min,用CR-400 色差计测定蛋白凝胶的L*,a*和b*值,每组样品平行测5 次,取平均值。白度值通过以下公式[8]计算:
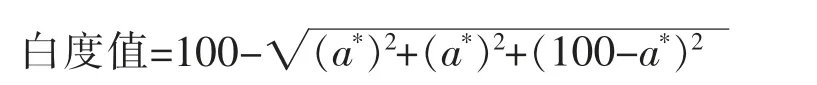
1.3.4 质构(TPA)的测定 采用TA-XTplus 型质构仪测定,探头为P/50,测试前速度2.0 mm/s,测试中速度1.5 mm/s,测试后速度1.5 mm/s,压缩比40%,下压力为5.0 g[9]。
1.3.5 破断力和凹陷距离的测定 利用 TAXTplus 型质构仪的凝胶强度测定模式分析鱼糜凝胶的破断力和凹陷距离。测定条件:探头:P/5S 球形金属探头;测前速度2.0 mm/s,测中速度1.0 mm/s,测后速度1.0 mm/s;测试距离15.0 mm;触发力10.0 g[9]。
1.3.6 持水性和蒸煮损失率的测定 参考Ma等[10]的方法并略作修改。
持水性测定:取制备好的鱼糜凝胶样品切成0.5 cm 的薄片,准确称重(W1),样品用3 层滤纸裹住后装入50 mL 的离心管 (底部垫有适量棉花)中,采用冷冻高速离心机5 000 r/min 离心15 min,立即取出样品并再次称重(W2)。持水性的计算公式:
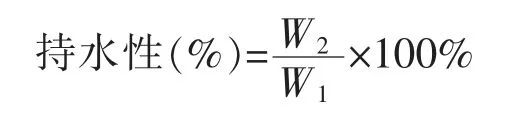
蒸煮损失率测定:取鱼糜凝胶样品切成5.0 mm 的薄片并称重(G1),封于蒸煮袋中,于90 ℃水浴锅中蒸煮20 min,快速取出,擦干表面液体后再次称重(G2)。根据公式计算样品蒸煮损失。
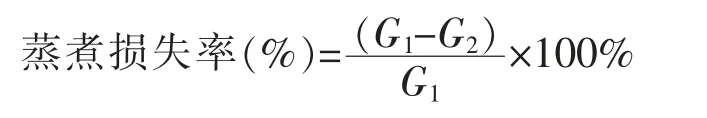
1.3.7 低场核磁共振分析 参考余永名等[11]的方法。测定参数:重复间隔时间TR(ms):3 000;采样间隔时间EchoTime(μs):150;重复扫描次数NS:8;回波个数EchoCnt:3 500。所得CPMG 指数衰减曲线采用仪器自带的MultiExp Inv Analysis 软件进行反演,得到T2值。
1.3.8 总巯基和活性巯基的测定 取绞碎后的蛋白凝胶,加入3 倍体积的20 mmol/L Tris-HCl(含0.6 mol/L KCl,pH 7.5),高速均质,4 500 g 离心20 min(4 ℃),采用双缩脲法测定上清液蛋白质的浓度,备用。
取上述样品蛋白溶液并将其浓度调至适宜浓度,参考Yongsawatdigul[14]方法测定。取1 mL 蛋白溶液,每管中加入9 mL 50 mmol/L 磷酸盐缓冲液(包括0.6 mol/L KCl,10 mmol/L EDTA,8 mol/L 的尿素,pH.0)。充分混合后取5 mL,加入0.5 mL DTNB(79.2 mg 溶于20 mL pH 7.0 的0.1 mol/L 磷酸盐缓冲液中),25 ℃保温25 min,于412 nm 处测定吸光度即总巯基的吸光度。活性巯基的测定是在不含尿素的情况下,将反应混合液在4 ℃反应60 min,于412 nm 处测定其吸光度。使用分子吸光系数13 600 L/(mol·cm) 计算蛋白中总巯基含量。
1.3.9 表面疏水性 参考Chelh 等[15]方法并稍作修改。各取1 mL 肌原纤维蛋白溶液,加入0.2 mL溴酚蓝(1 mg/mL)溶液,室温静置10 min,然后于4 000 r/min 离心15 min,取上清液稀释适当倍数,在波长595 nm 处测定样品的吸光度值,空白用磷酸盐缓冲溶液替代蛋白液。表面疏水性用溴酚蓝可结合的暴露出包埋在蛋白质构象内部的疏水性氨基酸残基的量来表示,计算公式:
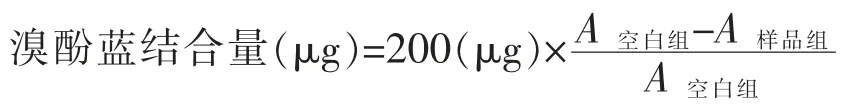
1.3.10 化学作用力 参考Gómez-Guillén 等[12]的方法:取2.0 g 蛋白凝胶样品5 份,分别加入0.05 mol/L NaCl (A 液)、0.6 mol/L NaCl (B 液)、0.6 mol/L NaCl+1.5 mol/L 尿素(C 液)、0.6 mol/L Na-Cl+ 8.0 mol/L 尿素 (D 液)、0.6 mol/L NaCl+ 8.0 mol/L 尿素+ 0.05 mol/L β-巯基乙醇(E 液)5 种溶液共10 mL,经均质混匀,于4 ℃静置60 min,10 000 r/min 离心15 min,取上清液用双缩脲法测定其中的蛋白质含量。
离子键=溶解于B 液中的蛋白质含量-A 液中的蛋白质含量;
氢键=溶解于C 液中的蛋白质含量-B 液中的蛋白质含量;
疏水相互作用=溶解于D 液中的蛋白质含量-C 液中的蛋白质含量;
二硫键=溶解于E 液中的蛋白质含量-D 液中的蛋白质含量。
结果以每升溶液所含溶出蛋白质的量来表示(g/L)。
1.3.11 电镜扫描观察(SEM)
参考Oujifard[13]的方法:鱼糜凝胶样品→切块(3 mm×3 mm×2 mm)→2.5%戊二醛溶液[含50%浓度为0.2 mol/L,pH 7.2 的磷酸盐缓冲液(PBS)]固定24 h→去除固定液→PBS (0.2 mol/L,pH 7.2)漂洗3 次 (15 min/次)→蒸馏水冲洗60 min→50%,70%和90%的乙醇梯度脱水各1 次 (15 min/次)→无水乙醇洗脱3 次 (10 min/次)→真空冷冻干燥→离子溅射镀金→扫描电镜观察。
1.3.12 数据统计分析 试验数据处理及作图采用Origin 9.0,SPSS 19.0 统计分析软件,处理结果均以平均值±标准偏差表示。
2 结果与分析
2.1 肌原纤维蛋白凝胶白度的变化
白度是鱼糜制品品质鉴定的重要指标之一,决定鱼糜制品在感官上被消费者接受的程度。白度与鱼糜制品色泽中的L*值、a*值、b*值密不可分,通过分析L*、a*、b*值来综合评价白度的变化。亮度(L*)值,从0 到100 变化,0 表示黑色,100 表示白色;红/绿(a*)值表示从红到绿的值,正值代表红色程度,负值代表绿色程度;黄/蓝(b*)值表示从黄到蓝的值,正值表示黄色程度,负值表示蓝色程度。表1是甲醛(FA)含量对秘鲁鱿鱼肌原纤维蛋白凝胶白度的影响,由表1可以看出,随着FA 含量的增加,蛋白凝胶的白度值、L*值和b*值显著(P<0.05)增大,a*值显著(P<0.05)减小,而不同浓度的FA 间a*无显著性变化。白度变化可能与蛋白质的聚集程度和聚集速度有关,FA 添加量越多,蛋白聚集速率远远高于蛋白伸展速率,破坏了蛋白凝胶的网络结构,推测蛋白聚集过程中反射更多的光,或者是FA 使蛋白质氧化,导致蛋白凝胶白度增加;其中L*值、b*值增大可能是随着FA含量的增加,蛋白凝胶中水分流失多,水分流动性增强,内部水分向表层迁移[16]。

表1 甲醛对秘鲁鱿鱼肌原纤维蛋白凝胶白度的影响Table 1 Effect of FA on whiteness value of myofibrillar protein gels from Peru squid
2.2 肌原纤维蛋白凝胶破断力和凹陷距离的变化
破断力即探头刺破凝胶时所感应到的力,可反映凝胶制品的硬度;凹陷距离指凝胶在外力作用下即将断裂时所发生的形变量,反映凝胶制品的弹性以及凝胶中蛋白质分子间作用力的强弱[17]。从图1可知,FA 的存在对蛋白凝胶的破断力和凹陷距离影响显著(P<0.05)。当FA 含量为0时,蛋白凝胶破断力为最小,凹陷距离最大,即该组的弹性最好,其凝胶三维网络结构较致密。随着FA 含量的增加,蛋白凝胶破断力显著增大(P<0.05),与硬度变化一致。Sikorski 等[18]发现FA 是蛋白质交联剂,通过亚甲基桥作用于多肽分子间或者分子内部,这些键能促使蛋白凝胶有更大的破断力。Chanarat 等[4]报道FA 的存在可以增加鱼糜凝胶的破断力。随着FA 含量的增加,蛋白凝胶凹陷距离显著降低(P<0.05),这可能是由于FA 含量的增加促使蛋白质过度聚集和蛋白质严重变性的原因。Benjakul 等[19]研究发现,与其它鱼种鱼糜相比,冻藏狗母鱼鱼糜凝胶形成性差,主要原因就是FA 的生成。
2.3 肌原纤维蛋白凝胶质构特性分析
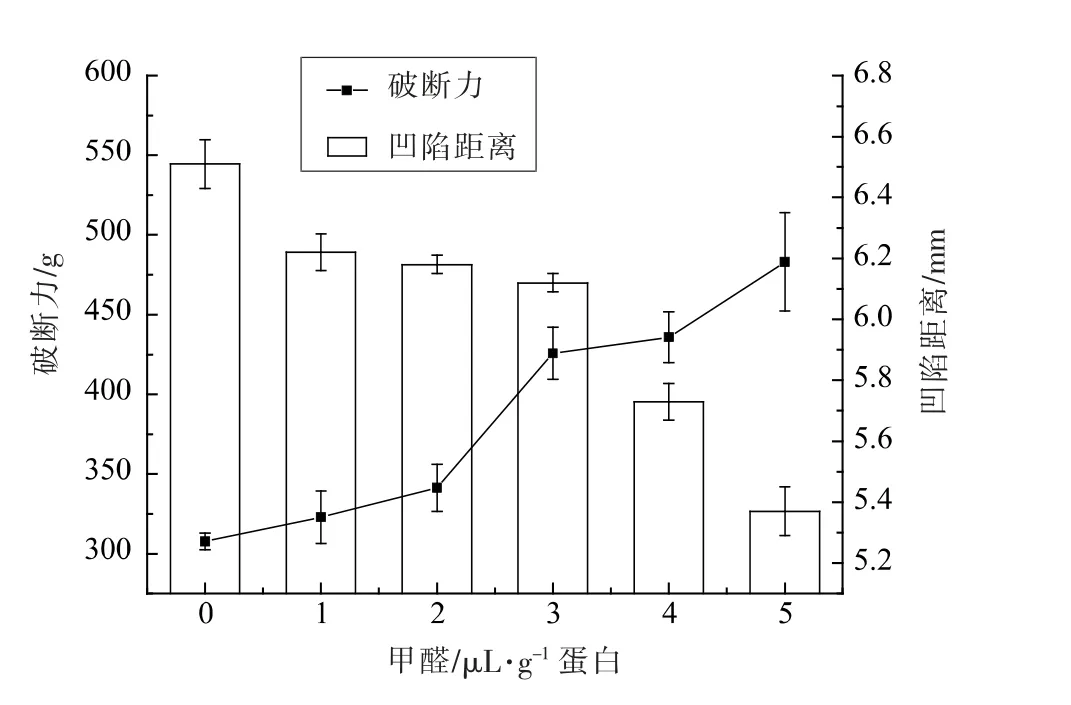
图1 甲醛对鱿鱼肌原纤维蛋白凝胶的破断力(A)和凹陷距离(B)的影响Fig.1 Effect of FA on breaking force (A) and deformation (B) of myofibrillar protein gels from Peru squid
凝胶质构(TPA)主要通过模拟人口腔的两次咀嚼动作,对测试样品进行两次压缩,获得与人感官评定相对应的参数。由表2可以看出,FA 含量为0 时,样品的硬度、弹性和咀嚼度分别是1 357.98 g,0.986 和1 220.53 g·mm;随着FA 含量的增大,蛋白凝胶的硬度和咀嚼度呈现上升的趋势(P<0.05),弹性则有一定程度的减弱,然而无显著性变化(P>0.05);在FA 含量为5.0 μL/g 蛋白时,硬度和咀嚼度分别达到1 830.65 g,1 635.01 g·mm,比FA 含量为0 时分别增大了34.8%,34.00%。FA 能够和肽类、氨基酸残基等小分子质量物质反应,使蛋白质分子间和分子内部交联,溶解度下降,其质地变硬,变脆[2],进而可使鱿鱼肌原纤维蛋白凝胶样品硬度和咀嚼度增大。

表2 甲醛对秘鲁鱿鱼肌原纤维蛋白凝胶质构特性的影响Table 2 Effect of FA on textural properties of myofibrillar protein gels from Peru squid
2.4 肌原纤维蛋白凝胶持水性和蒸煮损失率的变化
持水性是反映蛋白凝胶对其中水分的保持能力,持水性能高的蛋白凝胶,内部水分不易外渗,因而在凝胶受到外力挤压时失水率低。蛋白凝胶的蒸煮损失是指在凝胶蒸煮过程中水分等易流失物质因渗出所造成的质量减少。蒸煮损失率越大,表明蛋白凝胶水分等物质在受热蒸煮时越易流失。持水性和蒸煮损失可间接反映蛋白凝胶微空间三维网络结构的致密程度。持水性越高,蒸煮损失越低,表明鱼糜凝胶的网络结构对水分等物质的束缚能力越强,也就是说蛋白凝胶的空间网络结构越致密。图2反映FA 含量对鱿鱼蛋白凝胶持水性和蒸煮损失的影响。样品蛋白凝胶的持水性随着FA 含量的增加呈下降趋势,而蒸煮损失率则是显著(P<0.05)增大。随着FA 含量的增加,蛋白凝胶样品与未加甲醛的蛋白凝胶样品相比持水性分别下降1.86%,13.81%,20.62%,22.68%,27.22%。凝胶持水性的降低与蛋白结构变化密不可分。秘鲁鱿鱼肌原纤维蛋白经FA 氧化后形成的凝胶结构松散,蛋白网络结构断裂,聚集成块状,这可能是持水性下降的原因。Xiong 等[20]也发现,氧化后的猪肉肌原纤维蛋白形成的凝胶结构多孔,其持水性明显下降。

图2 甲醛对秘鲁鱿鱼肌原纤维蛋白凝胶的持水性和蒸煮损失的影响Fig.2 Effect of FA on water-holding capacity and cooking loss of myofibrillar protein gels from Peru squid
2.5 肌原纤维蛋白凝胶横向弛豫时间T2 的变化
低场NMR 技术可以用来检测样品中水的移动性和分布状态。一般选用T2弛豫时间分析样品中水分的移动及分布[21]。T2值的大小可以反映水分流动性的强弱[22]。从图3得知,鱿鱼肌原纤维蛋白凝胶样品中水分分布主要呈现为4 个状态:T21(0.23~0.76 ms)、T22(0.99~3.05 ms)、T23(43.29~114.98 ms)、T24(305.39~464.16 ms)。其中T21、T22代表蛋白凝胶中的结合水[23]。T21是指与蛋白质等大分子表面的极性基团以氢键相结合的单层水,以及位于大分子固有结构上的质子[24];T22与蛋白质中的酰胺基形成的具有较小键能的氢键的一部分水分,与T21代表的水分群相比,较之结合能力稍弱[25];T23代表蛋白凝胶中可移动的水分群,称为可移动水,位于蛋白质空间网络结构空隙及膜所阻留的那部分水即为束缚水[26],是蛋白凝胶中水分的主要存在形式,占凝胶总水分的90%左右;T24代表自由水,是蛋白凝胶中结合最差的水分,是存在于细胞外的水。
图4显示FA 含量不同的蛋白凝胶弛豫组分峰面积比例变化情况。其中P21、P22、P23、P24分别对应弛豫组分T21、T22、T23、T24的峰面积百分比,即代表各部分水占总水分的比例。根据蛋白凝胶样品弛豫组分峰面积百分比,可以估算氢质子的相对含量,反映不同状态水分群的含量,而根据不同状态水分群含量的变化,可以评估各种状态水分群的迁移情况[27]。由图4可知,P21、P22占蛋白凝胶总水分的比例最小,随着FA 含量的增加,其变化幅度不明显,说明FA 对蛋白凝胶样品中结合水水群影响不显著(P>0.05)。而P23明显是4 个水分群分布状态中比例最高的,是蛋白凝胶中含量最多的水分,其与P24的分布情况将直接关系蛋白凝胶的持水性能。由图4可得知,随着FA 含量的增加,P23和P24二者正好呈现相反的变化趋势,P23显著(P<0.05)降低,P24呈升高的趋势,即蛋白凝胶的保水能力越来越差,表明FA 破坏了蛋白凝胶网络结构,使凝胶网络结构断裂,内部被束缚住的水分流出,自由水所占比例增大,该结果与持水性和蒸煮损失结果一致。内部被束缚的水的流出越多,水的流动性越大,其持水性减弱,蒸煮损失率越大。
2.6 肌原纤维蛋白凝胶总巯基和活性巯基含量的变化
蛋白质中巯基(-SH)和二硫键(-S-S-)是具有最高反应活性的基团,蛋白质的结构稳定性[28]与巯基和二硫键的变化密切相关;蛋白质发生氧化时,巯基可转化为二硫键,并且随着氧化程度的增大还会生成亚砜等氧化产物[29]。巯基含量的变化可作为蛋白质性质变化的一个重要指标。
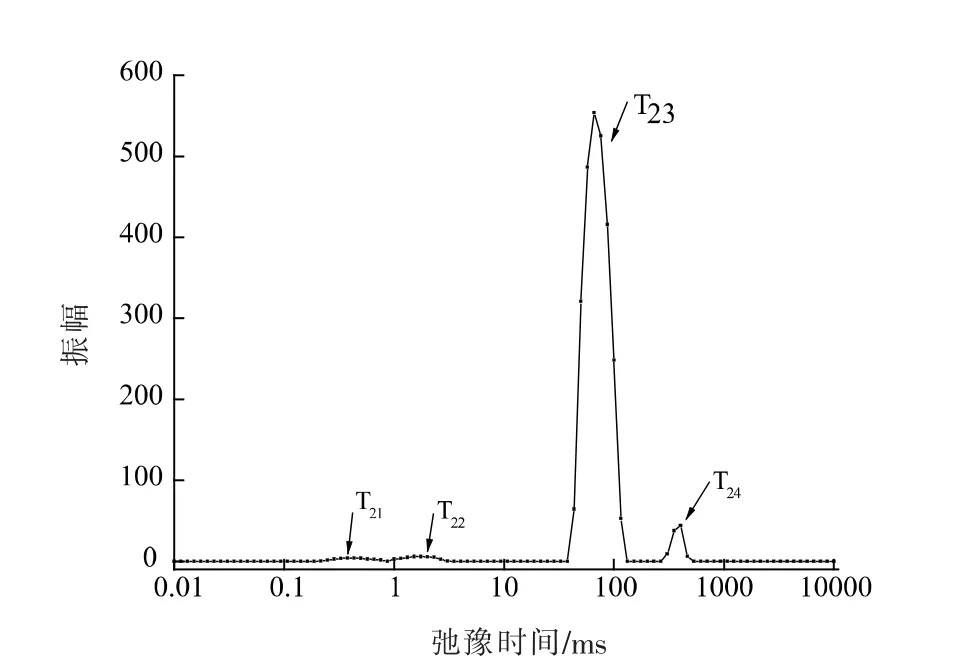
图3 秘鲁鱿鱼肌原纤维蛋白凝胶T2 横向弛豫时间的分布变化Fig.3 Change of distributed T2 transverse relaxation time of myofibrillar protein gel from Peru squid
图5所示FA 含量对肌原纤维蛋白凝胶总巯基和活性巯基含量的影响。随着FA 含量的增加,肌原纤维蛋白凝胶的总巯基和活性巯基含量呈显著(P<0.05)下降趋势。当FA 为0 μL/g 蛋白时,蛋白凝胶总巯基和活性巯基含量分别为29.72,20.53 nmol/mg 蛋白;当FA 为1 μL/g 蛋白时,总巯基和活性巯基分别下降到15.01,13.68 nmol/mg 蛋白,减少率分别达49.5%,33.4%;当FA≥1 μL/g蛋白时蛋白凝胶的总巯基和活性巯基含量减少趋于平缓。蛋白质中的游离巯基包括2 种:暴露在蛋白质表面的巯基和包埋在疏水基团内部的巯基。巯基减少的原因可能是FA 与肽类、氨基酸残基等小分子物质发生反应,使蛋白质分子间交联,破坏了蛋白质的网络结构,导致更多的巯基被氧化成二硫键或是进一步氧化成磺酸类或其它氧化产物,从而使蛋白结构表面巯基含量下降[30]。Lund等[31]研究猪背最长肌在冷藏条件下蛋白质的变化情况,巯基含量的降低在一定程度上代表了蛋白氧化的程度。
2.7 表面疏水性

图4 甲醛处理对秘鲁鱿鱼肌原纤维蛋白凝胶弛豫组分峰面积比例变化的影响Fig.4 Effect of FA on change of peaks area proportion of myofibrillar protein gels from Peru squid
蛋白质表面疏水性可以反映蛋白质分子表面疏水性氨基酸的相对含量,是影响蛋白质理化性质和功能特性的重要指标,可将其用作衡量蛋白质变性程度的一个指标[32]。通常蛋白质的一些疏水性氨基酸残基埋藏于蛋白分子内部,当蛋白质的内部结构发生变化时,这些疏水性氨基酸残基被暴露于分子表面,从而使蛋白质的表面疏水性增加。另外,蛋白质的疏水性还会受到不同氨基酸之间的疏水相互作用以及巯基氧化程度的影响[33]。图6为不同浓度的FA 添加量对鱿鱼肌原纤维蛋白凝胶表面疏水性的影响,从图中可看出,蛋白凝胶的表面疏水性随着FA 浓度的增大而显著增加(P<0.05),当FA 质量浓度高于2 μL/g 蛋白时,表面疏水性变化不明显。疏水相互作用是维持肌原纤维蛋白网络结构稳定的主要化学作用力,结合图7,FA 含量引起鱿鱼肌原纤维蛋白凝胶表面疏水性的变化,FA 的存在促使肌原纤维蛋白快速聚集,蛋白聚集速率显著高于蛋白伸展速率,使蛋白质网络结构构象发生改变,进而蛋白质分子内部疏水性氨基酸残基暴露,导致疏水值的增大。
2.8 化学作用力的变化
蛋白质是一种具有三维空间结构的生物高分子物质,它的结构与功能之间存在密不可分的关系。FA 与蛋白质能够发生交联形成复合物,对蛋白质等生物大分子的结构有影响,会改变分子内和分子间的非共价作用力,使得其功能特性发生相应的变化。离子键、氢键、疏水相互作用、二硫键是维持肌原纤维蛋白三维网络结构的主要化学作用力[34]。
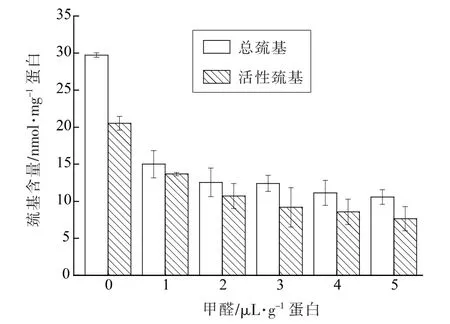
图5 甲醛对秘鲁鱿鱼肌原纤维蛋白凝胶总巯基和活性巯基含量的影响Fig.5 Effect of FA on total sulfhydryl and active sulfhydryl content of myofibrillar protein gels from Peru squid
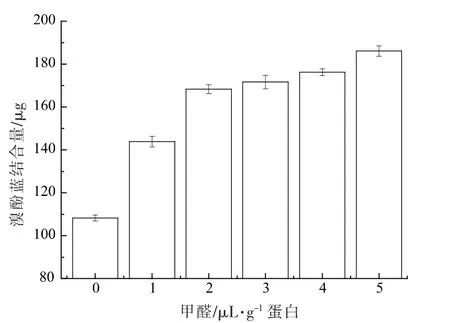
图6 甲醛对秘鲁鱿鱼肌原纤维蛋白凝胶表面疏水性的影响Fig.6 Effect of FA on surface hydrophobicity of myofibrillar protein gels from Peru squid
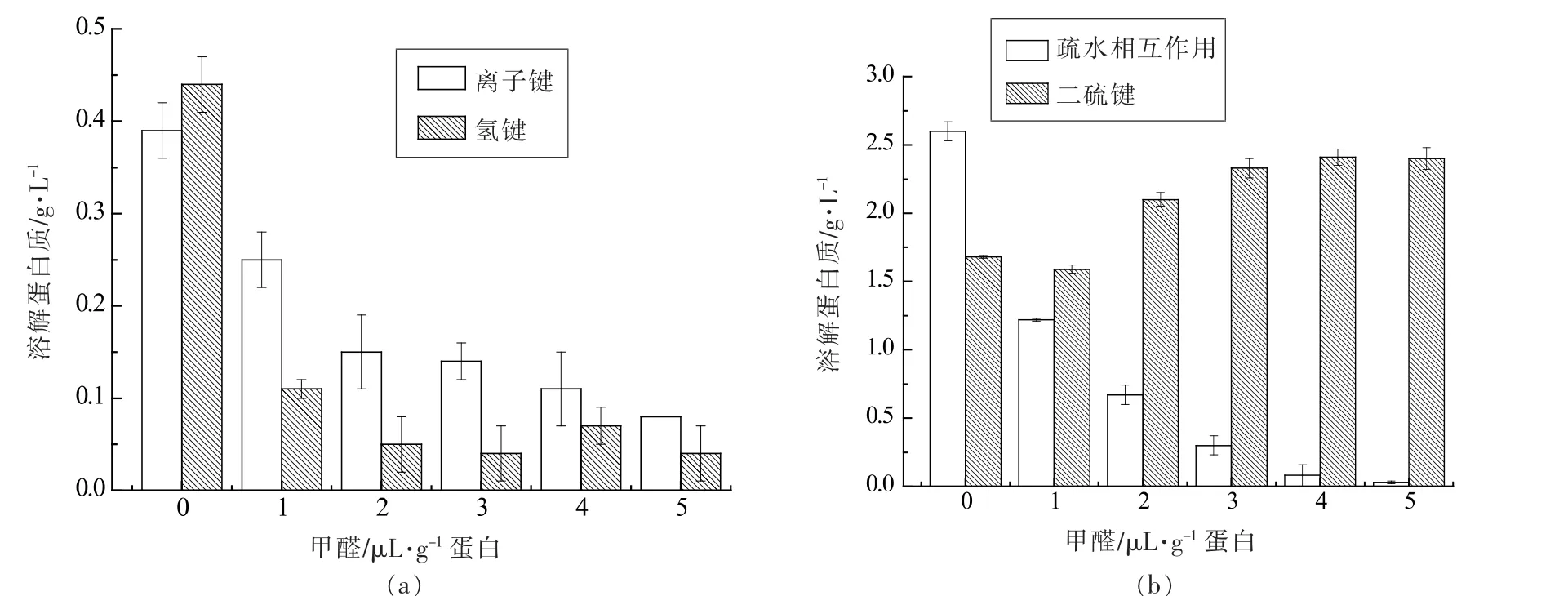
图7 甲醛处理对秘鲁鱿鱼肌原纤维蛋白凝胶化学作用力的影响Fig.7 Effect of FA on the chemical bonds of myofibrillar protein gels from Peru squid
图7显示FA 处理对肌原纤维蛋白凝胶中离子键、氢键、疏水相互作用及二硫键的影响。由图7可知,随着FA 含量的增加,离子键、氢键和疏水相互作用呈现一定的下降趋势(P<0.05),而二硫键则是上升趋势。氢键、疏水相互作用以及蛋白中的共价键对凝胶三维网状结构的形成具有重要的影响;蛋白质的三级、四级结构主要是通过离子键稳定的。疏水相互作用是指蛋白质中的非极性氨基酸残基(疏水残基)之间形成一种弱的、非共价的相互作用,这些疏水残基在水相环境中具有避开水而相互聚集的倾向。疏水相互作用是蛋白质发生折叠时的主要推动力,可使疏水性残基处在蛋白质分子的内部,并且是影响大部分蛋白质结构和性质的关键作用力。通过骨架上的羰基和酰胺基团之间形成的氢键是稳定蛋白质二级结构的主要作用力;二硫键对蛋白质特定分子结构的形成有重要的作用[35]。
图7表明,FA 含量对蛋白凝胶中离子键、氢键、疏水相互作用及二硫键产生影响,相较于对照组,FA 存在时,随着FA 含量的增加,离子键、氢键、疏水相互作用下降剧烈,这可能是因为FA 与蛋白质发生反应,影响蛋白凝胶中蛋白质三维网络结构的构象,使结构发生改变;其次,推测二者的相互作用,使得蛋白质的网络结构不同侧链间相互缔合有所减少,而分子链内部的聚合作用有所加强;当FA 存在时,FA 使蛋白质聚集速率高于蛋白质伸展速率,不利于蛋白凝胶网络结构的形成。另外,二硫键的增加可能是蛋白质氧化导致巯基转化形成。这些化学作用力的改变导致蛋白质空间网状结构的改变,从而影响肌原纤维蛋白凝胶的理化性质。
2.9 组织微观结构的变化
蛋白凝胶的组织微观结构主要是指凝胶网络结构,结构的致密程度、孔径的大小,以及结构的平整程度均与肌原纤维蛋白的凝胶强度、持水性、蒸煮损失等呈现一定的相关性。由图8所示,经FA 添加氧化后蛋白凝胶形成的凝胶网络结构与未添加FA 氧化的蛋白凝胶网络结构存在明显的差异,随着FA 添加量的增大,凝胶微观结构变化更加明显。未添加甲醛的蛋白样品凝胶网络结构相对致密,结构胶平整,分布均匀,结果与持水性、蒸煮损失率结果相一致;经FA 处理的蛋白凝胶表现出结构不平整,粗糙,结构分布不均匀,凝胶网络空隙变大,肌原纤维发生断裂现象。推断是FA 通过蛋白质交联的亚甲基桥,使蛋白质不能与盐充分溶解,从而不能形成较好的凝胶网络结构,甚至是破坏凝胶网络结构的形成[4]。另外,当FA存在时,FA 和一些小分子物质(肽类、氨基酸残基等)发生反应,使得样品纤维化、硬化等。

图8 甲醛处理对秘鲁鱿鱼肌原纤维蛋白凝胶微观结构的影响Fig.8 Effect of FA on microstructure of myofibrillar protein gels from squid
3 结论
FA 对肌原纤维蛋白凝胶特性及结构影响显著,主要表现在破断力、凹陷距离、质构特性、持水性、蒸煮损失率有显著变化,破断力随着FA 浓度的增大而显著增大,凹陷距离显著(P<0.05)降低;持水性显著减弱,蒸煮损失越来越大。经FA 处理,秘鲁鱿鱼肌原纤维蛋白凝胶巯基含量因蛋白构象的改变而显著减少,同时表面疏水性也因蛋白凝胶网络结构的破坏而显著增加;经FA 氧化的肌原纤维蛋白凝胶组织微观结构显示:FA 的存在破坏了肌原纤维蛋白结构网络,蛋白凝胶比对照组微观结构表面粗糙,空隙增大,分布不均匀。
