水华微囊藻衰亡后营养盐释放过程研究
2019-09-03高磊
高磊


摘要:在构建的水-沉积物系统中加入死亡的水华微囊藻细胞(烘箱中杀死),研究其衰亡后营养盐的释放过程及迁移转化规律。结果表明:(1)实验期间,微囊藻碎屑迅速分解释放,上覆水中DO和沉积物中氧化还原电位迅速降低;(2)实验初期上覆水中TN、NH4+-N、NO3--N大幅上升,第4d达到最高水平,分别升高了16.6、13.3、6.4倍;第4d以后TN、NO3--N逐渐降低,主要由于厌氧反硝化作用、向间隙水中迁移及NO3-向NH4+转化,NH4+-N平稳缓慢增加,后期N主要以NH4+的形式存在;(3)由于藻体分解,上覆水中TP、DTP、SRP、DOP的增加较快,第1d即达到较高水平,分别为初始值的4.10、5.29、4.86、8.33倍;(4)沉积物间隙水中TN、NH4+-N增幅较大,NO3--N次之,且NH4+-N持续升高,间隙水中N的形态也主要以NH4+的形式存在,整个实验阶段间隙水中TP、DTP、SRP一直有所升高,DOP先升高后降低;(5)沉积物成为微囊藻衰亡阶段营养盐释放的“汇”。
关键词:水华微囊藻;衰亡;营养盐;释放
Abstract:By adding decomposed Microcystis flos-aquae(killed in the oven) in the water-sediment system,nutrient release and transformation regulation was studied. The results suggested that:(1)The Microcystis fragment in experimental group quickly decomposed,the DO in overlying water and the Oxidation-Reduction Potential in the sediment reduced quickly. (2)TN,[NH+4]-N and NO3--N in the overlying water rose sharply,reaching the peak levels after the fourth day experiment,i.e. increasing by 16.6,13.3,and 6.4 times. Then,TN,[NO-3]-N were gradually fell due to the anoxic denitrification,the removal to interstitial water and [NO-3] transformation to [NH+4],but the [NH+4]-N increased slowly and it was the main form in the overlying water.(3)TP,DTP,SRP,DOP increased quickly in overlying water due to the Microcystis decomposing in the experimental group,reaching a higher level after the first day test,increasing by 4.10,5.29,4.86 and 8.33 times .(4)TN and [NH+4]-N increased more than the [NO-3]-N in the interstitial water,and [NH+4]-N is the mainly form of the nitrogen in the interstitial water owing to [NH+4]-N continuous rising. TP,DTP and SRP increased all the way throughout the experiment,and the DOP rose first,then declined.(5)Sediments were the nutrient release sink during the decay of Microcystis flos-aquae.
Key words:Microcystis flos-aquae;Decay;Nutrient;Release
近年來,水华微囊藻的大规模暴发,虽然可以快速繁殖吸收湖泊水体中的氮、磷等富营养化物质,但暴发后大量的有机体死亡分解又会导致水体富营养化水平升高,造成湖泊内源污染[1]。水华微囊藻暴发后在流泥分布、风场、气温、水位水动力作用下,在沿岸堆积沉降、死亡腐烂分解,造成营养盐释放、水体缺氧及发黑发臭的“湖泛”效应[2,3],使得局部水体中的营养盐水平迅速提升,影响水质,造成二次污染,并对聚集区沿岸带水域生态系统产生明显的影响[4-6]。这些藻类死亡分解产生的营养盐包括有机态、颗粒态、溶解态等[7],将通过迁移、微生物作用转化等进入到间隙水及沉积物中,从而重新进入湖泊的物质循环圈[8-10]。
虽然目前对于藻类堆积腐烂分解实验的研究较多,但其营养盐释放的研究多集中于总氮、总磷和有机质的释放量和释放速率方面[11,12],对于氮磷营养盐形态变化的研究较少,蓝藻在腐烂过程中释放的氮磷营养盐以不同的形态进入水体,在一定条件下可进一步发生迁移转化,同时,对于蓝藻腐烂的研究多偏于上覆水体质量变化,忽略了湖泊沉积物的影响。沉积物在富营养化湖泊中,扮演着“汇”与“源”的角色[13],藻类腐烂释放的营养盐不仅可以进入沉积物间隙水中,腐烂分解的残体有机质可以沉降、吸附在沉积物表层,从而使得沉积物成为湖泊内源污染的“汇”,而藻类死亡分解造成的底部缺氧环境使硝化作用减弱,反硝化作用加强,沉积物中的微生物可以降解矿化这些污染物,转化营养盐氮、磷等物质为无机态向上覆水体释放,从而为水华蓝藻的再次暴发提供了“源”。
因此,本实验在构建的水-沉积物系统中,加入死亡的水华微囊藻(烘箱中杀死),研究其衰亡腐烂释放的不同形态营养盐在水、沉积物中的动态变化及在水-沉积物界面的迁移转化过程,以期对湖泊内源污染状况进行较深入探讨。
1 材料与方法
1.1 实验材料 2018年9月,在永幸河微囊藻暴发区域,用64#浮游生物网捞取水华微囊藻藻浆。将藻浆于水桶中静置分层,用蒸馏水洗涤干净,选取上层藻浆于烘箱中,60℃烘干,碾磨成碎屑过筛后待用。采集原位上覆水过64#筛网去除悬浮物和浮游生物备用,用迈克逊采泥器采集表层0~10cm的沉积物,搅拌至均匀,经孔径2mm的金属筛子过滤去除腐叶和大颗粒物等杂质。
1.2 实验设计 实验准备24个聚乙烯圆柱体(长30cm,直径15cm),一端封堵,设置6组,每组4个,1个对照、3个平行样。圆柱体内添加10cm深经金属筛过滤后的底泥沉积物,沉积物上层添加2L原位上覆水,待沉积物及上覆水稳定后,测定上覆水及沉积物间隙水背景值,测定指标为上覆水中pH、溶解氧(DO)、沉积物氧化还原电位Eh、上覆水与间隙水中的总氮(TN)、氨氮(NH4+-N)、硝态氮(NO3--N)、总磷(TP)、可溶性总磷(DTP)、可溶性磷(SRP)、溶解性有机磷(DOP)。而后向实验组平行样中添加2g水华微囊藻碎屑,在实验第1、4、7、10、15d对实验组上述数据进行测定,实验用水初始指标如表1。
1.3 测定方法 上覆水中pH采用酸碱测定仪(上海佑科,pHS-3C)进行测定,溶解氧采用上海雷磁(JPB-607A)测定、Eh采用上海雷磁(JPB-607A、ORP复合电极)测定。上覆水经过滤后进行测定,用注射器改装成的微型柱状采样器采集表层0~5cm的沉积物,经离心(3000r·min-1,10min)获得间隙水测定。分别测定其总氮(TN)、氨氮(NH4+-N)、硝态氮([NO-3]-N)、总磷(TP)、可溶性总磷(DTP)、可溶性磷(SRP)、溶解性有机磷(DOP),测定方法依次为:总氮:碱性过硫酸钾消解紫外分光光度法;氨氮:纳氏试剂分光光度法;硝酸盐氮:紫外分光光度法[14];总磷:过硫酸钾消解后钼锑抗分光光度法测定;可溶性总磷:水样过滤后过硫酸钾消解,钼锑抗分光光度法测定;可溶性磷:水样过滤后钼锑抗分光光度法测定;溶解性有机磷;可溶性总磷与可溶性磷含量之差[15]。
2 结果与分析
2.1 上覆水中pH的变化 经测定实验组和对照组上覆水中pH均保持在7.25~7.68之间,没有显著差异,呈现为中性,微囊藻碎屑腐烂对水体pH值贡献不大。
2.2 上覆水中DO的变化 图1为微囊藻碎屑腐烂分解后上覆水体中DO含量变化。从图1可以看出,对照组中DO一直保持在4.30~5.10mg/L的稳定状态。而实验组微囊藻腐烂分解后上覆水体中DO呈现明显下降,第1d即从4.80mg/L下降至0.54mg/L,此后一直保持在0.33mg/L以下,呈明显缺氧状态。其原因可能主要为:一方面,微囊藻碎屑进行分解,上覆水体及沉积物表面的微生物活动加剧,迅速消耗水体中的溶解氧;另一方面,在藻类分解过程中,上覆水体上层表面形成一层白色的粘着性隔膜,阻断了空气中氧气的溶解[15]。
2.3 上覆水中氮的变化
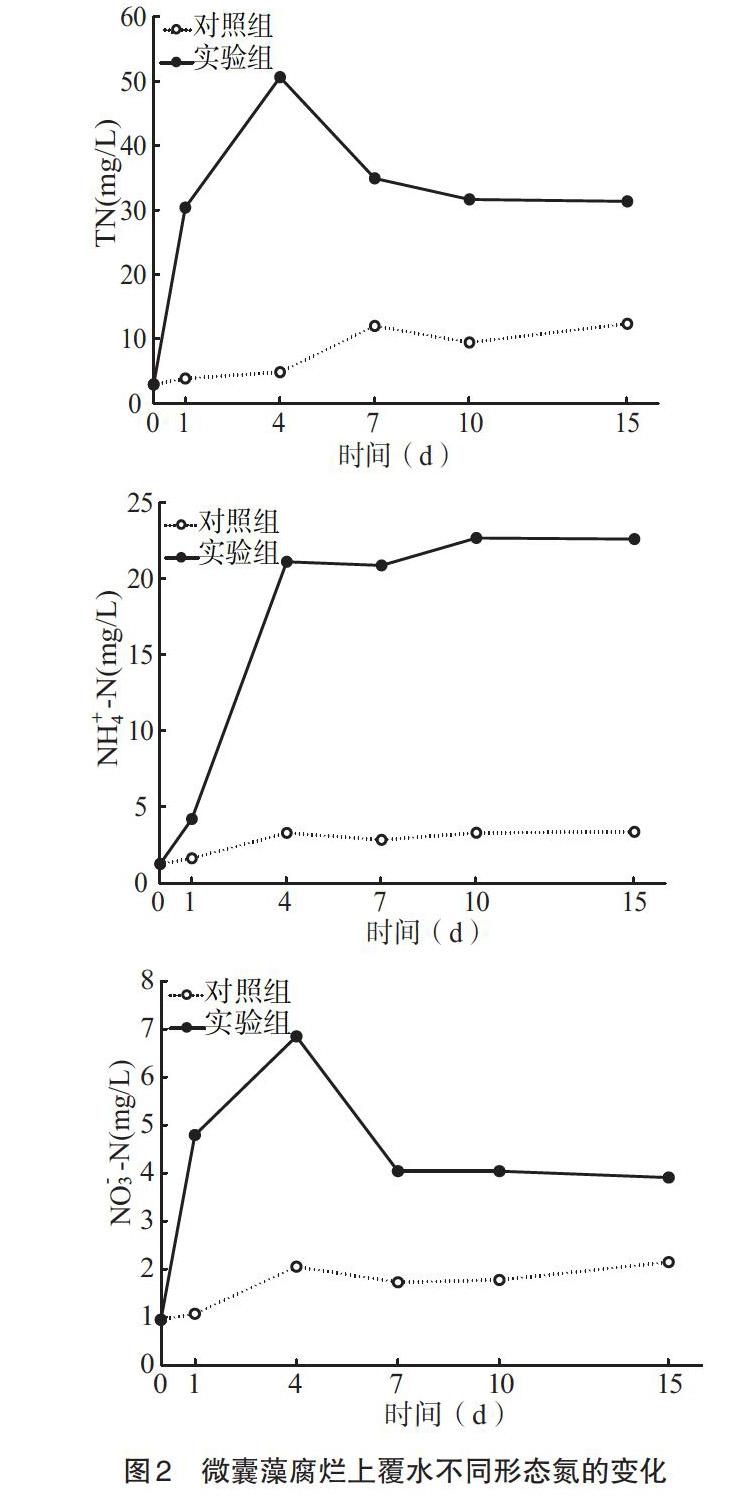
2.3.1 上覆水各形态氮的含量 图2为微囊藻腐烂上覆水各形态氮含量的变化。由图2可以看出,实验组添加微囊藻碎屑后微囊藻迅速分解释放,上覆水中TN、[NH+4]-N、[NO-3]-N第1d即大幅上升,分别从3.05、1.58、1.07mg/L升高至30.50、4.17、4.79mg/L,分别升高了10.0、2.63、4.48倍。实验进行到第4d各形态氮含量均达到最高水平,TN、[NH+4]-N、[NO-3]-N含量分别为50.75、21.11、6.85mg/L,相对初始值分别升高了16.6、13.3、6.4倍。第4d以后TN、[NO-3]-N表现为逐渐下降趋势,而[NH+4]-N则平稳并略有增加。对照组从实验开始至结束上覆水中TN、[NH+4]-N、[NO-3]-N均表現为缓慢增加趋势。
造成上述现象的主要原因为富藻水体中氮主要存在于藻体中[16],实验开始微囊藻碎屑腐烂分解释放大量营养盐使水体各形态氮含量迅速升高,而第0~1dTN及[NO-3]-N较NH4+-N增加较快。由于微囊藻腐烂分解首先以颗粒态、有机氮形式分解释放进入水体,而后在水体微生物的作用下逐渐发生矿化作用转化为铵盐[17]及前期有氧条件下硝化为硝酸盐[1,18],第1d以后[NH+4]-N迅速增加,水体中其余形态氮逐渐转化为比较稳定的铵盐形式存在。第4d以后上覆水TN、[NO-3]-N降低主要原因可能有3方面:(1)微囊藻腐烂释放首先造成上覆水体中氮的含量迅速升高,虽前期即造成上覆水浓度高于间隙水,氮开始向间隙水中迁移,但微囊藻腐烂营养盐释放速率大于其向间隙水迁移速率,第4d以后上覆水营养盐释放减慢,上覆水与间隙水形成较高浓度差,上覆水营养盐继续向间隙水迁移表现为上覆水TN及[NO-3]-N含量开始下降;(2)微囊藻腐烂后期造成水体形成一种缺氧环境,微生物细菌反硝化作用增强以N2或N2O的形式释放到大气中[1,19];(3)在缺氧环境中难以发生硝化作用,同时氮难以以[NO-3]-N的形式存在,各有机氮、[NO-3]-N等在缺氧环境中逐渐转化为[NH+4]-N,主要以[NH+4]的形式存在[1,11]。
2.3.2 上覆水[NH+4]-N、[NO-3]-N占TN百分比的变化 图3反映了不同阶段上覆水中NH4+-N、[NO-3]-N含量在TN中所占的比例变化,第0~1d [NH+4]-N、[NO-3]-N所占比例均呈现下降趋势,微囊藻腐烂初期主要以有机氮的形式进行释放,随后有机氮转化为无机氮,[NH+4]-N所占比例逐渐升高,而由于[NO-3]转化为[NH+4]及反硝化作用的发生,[NO-3]-N所占比例基本稳定,上覆水体中氮主要以[NH+4]的形式存在。
2.4 上覆水中磷的变化
2.4.1 上覆水中磷的含量 图4为微囊藻腐烂上覆水各形态磷的变化。从图可以看出实验组微囊藻腐烂分解后上覆水体中TP、DTP、SRP、DOP的释放较快,第1d即达到较高水平,分别从0.42、0.24L、0.21、0.03mg/L升至1.72、1.27、1.02、0.25mg/L,分别为初始值的4.10、5.29、4.86、8.33倍,对照氮的释放可以看出,微囊藻衰亡磷的释放较氮的释放快。第1~4d TP、DOP保持平稳,DTP、SRP有所上升,第4d以后TP、DTP、SRP均表现为缓慢下降趋势,而DOP则表现为逐步升高后期有所下降。由于藻类腐烂后主要以溶解性有机磷的形式进入水体,并进行矿化转化为无机磷形态进行释放[15]。对照组实验上覆水中各形态磷表现稳定有所上升,主要由于沉积物间隙水向上覆水释放导致。
2.4.2 上覆水SRP、DOP占DTP的百分比 由图5可以看出,SRP占DTP百分比在试验期间表现为先降低后升高的趋势,DOP占DTP百分比则表现为先升高后降低的趋势,因此微囊藻腐烂后首先以溶解性有机磷的形式进入水体,造成上覆水DOP含量的升高,后期溶解性有机磷逐渐转换为无机磷,造成后期SRP百分比的升高。
2.5 沉积物中Eh的变化 由图6可以看出,对照组沉积物中氧化还原电位Eh虽然有缓慢下降但一直处于-150mV以上,其缓慢下降主要由于沉积物底泥生物呼吸作用耗氧所致。而实验组第1d即从-110mV降至-210mV,至实验结束降至-261mV,微囊藻腐烂后造成水体严重缺氧状态,沉积物底泥表现为严重的强还原状态。这种强还原状态更有利于反硝化细菌的活动,实验后期上覆水中氮经反硝化作用以N2的形式回到大气中[1,19],此为上覆水中TN含量降低的原因之一。
2.6 间隙水中氮的变化
2.6.1 间隙水各形态氮的含量 图7为沉积物间隙水中各形态氮含量的变化。可以看出,实验组添加微囊藻碎屑后与上覆水各形态氮含量变化有所差别。上覆水中TN、[NO-3]-N表现为第1~4d迅速升高,第4d以后又表现为下降。而间隙水中TN、[NO-3]-N第1~4d逐渐升高,第4d以后上覆水与间隙水中TN、[NO-3]-N变化差异显著,第4~7d仍表现为升高趋势,实验至第7d其浓度分别从初始值的8.80、2.83mg/L升高至38.28、4.11mg/L,分别增加了4.35与1.45倍,其增高趋势明显低于上覆水,第7d以后TN与[NO-3]-N则表现平稳。间隙水中[NH+4]-N与上覆水中变化有所差别,表现为整个试验阶段持续升高的趋势,至实验结束其浓度从5.02mg/L升高至19.72mg/L,增高了3.93倍。对照组中间隙水TN与[NH+4]-N略有下降,而[NO-3]-N降低较为明显,由此推断对照组氮主要以[NO-3]-N的形式向上覆水中释放迁移。
间隙水中TN、[NH+4]-N增幅较大,[NO-3]-N次之,且NH4+-N持续升高,沉积物间隙水中氮主要以铵盐的形式存在,藻细胞内的有机氮在微生物参与下发生氨化作用,转化为硝酸盐,在沉积物表面形成的缺氧环境中微生物吸收利用硝酸盐作为氮源,发生同化性硝酸还原作用:[NO-3]→[NH+4][1,20]。有机氮逐渐向[NO-3]-N、[NH+4]-N转化,同时在缺氧条件下反硝化作用加强,微生物[NO-3]为呼吸作用的最终电子受体,把硝酸还原成氮(N2),发生反硝化脱氮作用,但此过程并未导致间隙水体中硝酸盐含量的降低,可能主要因为微生物发生矿化作用微囊藻腐烂释放的有机氮转化为硝酸盐及上覆水中高浓度硝酸盐的迁移扩散补充。上述结果表明高浓度微囊藻分解腐烂后释放的高浓度营养盐向间隙水中迁移,间隙水成为其营养盐的“汇”,其形成的底泥底部厌氧环境在腐烂分解的短时期内并未造成沉积物氮磷的释放。
2.6.2 间隙水[NH+4]-N、[NO-3]-N占TN的百分比 图8间隙水中[NH+4]-N、[NO-3]-N占TN百分比的变化,[NH+4]-N前期变化不明显,中期有所降低而后期又逐渐升高,[NO-3]-N整个实验期间一直表现为降低趋势。可能主要因为微囊藻腐烂造成极度缺氧环境,[NO-3]-N首先发生厌氧反硝化作用,随着微囊藻腐烂有机形式氮逐渐从高浓度上覆水向间隙水中迁移,造成[NH+4]-N、[NO-3]-N比例逐渐降低,后期随着反硝化作用、有机氮向无机氮的转化及[NO-3]转化为[NH+4],造成[NO-3]-N持续降低而[NH+4]-N又有所升高。
2.7 间隙水中磷的变化
2.7.1 间隙水中磷的含量 实验组间隙水中TP、DTP、SRP整个实验阶段一直有所升高,后期表现稳定,DOP先增高后期有所降低,主要因为微囊藻腐烂及部分残体沉降以溶解性有机磷的形式进入沉积物,在微生物作用下逐渐转化为无机磷[21]。而对照组由于沉积物间隙水向上覆水中的迁移而均逐渐降低。
2.7.2 间隙水SRP、DOP占DTP的百分比 由图10可以看出间隙水中DOP所占DTP比例明显高于上覆水中,并先升高后降低。一方面由于沉积物的存在,其间隙水中DOP的含量高于间隙水,另一方面微囊藻释放的溶解性有机磷除向上覆水中释放外向间隙水中迁移,同时微囊藻碎屑残体沉降至沉积物表面造成间隙水DOP含量的升高,而后期由于残体微生物的分解转化为无机磷而有所降低,但较上覆水中并不明显[21,22],同时SRP所占比例变化也并不明显。
3 结论
(1)水华微囊藻衰亡分解后,上覆水中DO迅速降低,之后一直保持較低水平;沉积物中氧化还原电位实验期间逐渐降低,一直处于强缺氧还原状态。
(2)微囊藻碎屑迅速分解释放,实验初期上覆水中TN、NH4+-N、NO3--N大幅上升,第4d达到最高水平,分别升高了16.6、13.3、6.4倍;第4d以后TN、NO3--N逐渐降低,主要因为厌氧反硝化作用、向间隙水中迁移及NO3-向NH4+的转化;NH4+-N平稳缓慢增加,后期主要以铵盐的形式存在;上覆水中TP、DTP、SRP、DOP的释放较氮快,第1d即达到较高水平,分别为初始值的4.10、5.29、4.86、8.33倍,藻类衰亡后先以溶解性有机磷的形式进入水体,并矿化转化以无机磷形态进行释放。
(3)沉积物间隙水中TN、NH4+-N增幅较大,NO3--N次之,且NH4+-N持续升高,间隙水中N的形态也主要以铵盐的形式存在;整个实验阶段间隙水中TP、DTP、SRP一直有所升高,DOP先升高后降低,微囊藻衰亡腐烂阶段,高浓度营养盐的释放未造成沉积物营养盐向间隙水迁移释放,而是逐渐升高成为湖泊内源污染营养盐的“汇”。
参考文献
[1]尚丽霞,柯凡,李文朝,等.高密度蓝藻缺氧分解过程与污染物释放实验研究[J].湖泊科学,2013,25(1):47-54.
[2]沈爱春,徐兆安,吴东浩.蓝藻大量堆积、死亡与黑水团形成的关系[J].水生态学杂志,2012,33(3):68-72.
[3]陈伟民,蔡后建. 微生物对太湖微囊藻的好氧降解研究[J].湖泊科学,1996,8(3):248-252.
[4]Krivtsovetal,Bellinger E G,Sigee D C. Elemental composition of Microcystis aeruginosa under conditions of lake nutrient depletion[J]. Aquatic Ecology,2005,39:123-134.
[5]孔繁翔,馬荣华,高俊峰,等.太湖蓝藻水华的预防、预测和预警的理论与实践[J].湖泊科学,2009,21(3):314-328.
[6]尚媛媛,关保华,郑建伟等.蓝藻堆积对水环境和沉水植物生长的影响[J].中国农学通报2015,31(5):195-198.
[7]孙小静,秦伯强,朱广伟.蓝藻死亡分解过程中胶体态磷、氮、有机碳的释放[J].中国环境科学,2007,3:341-345.
[8]刘国锋,申秋实,张雷,等.藻源性黑水团环境效应:对水-沉积物界面氮磷变化的驱动作用[J].环境科学,2010,31(12):2917-2923.
[9]Veuger B,Eyre B D,Maher D,et al. Nitrogen incorporation and retention by bacteria,algae and fauna in a subtropical intertidal sediment:An in situ15N-labeling study[J]. Limnology and Oceanography,2007,52(5):1930-1942.
[10]刘冬梅,姜霞,金相灿,等.太湖藻对水E沉积物界面磷交换过程的影响[J].环境科学研究,2006,19(4).8-13.
[11]李柯,关保华,刘正文.蓝藻碎屑分解速率及氮磷释放形态的实验分析[J].湖泊科学,2011,23(6):919-925.
[12]孙远军.淀山湖蓝藻碎屑的好氧降解和营养盐释放规律研究[J].中国环境科学,2013,33(11):2047~2052.
[13]范成新,张路,包先明,等.太湖沉积物-水界面生源要素迁移机制及定量化-2.磷释放的热力学机制及源-汇转换.湖泊科学,2006,18(1):207-217.
[14]国家环保总局《水和废水监测分析方法》编委会.水和废水监测分析方法(第4版).北京:中国环境科学出版社.2002.
[15]侯金枝,魏权,高丽,等.刚毛藻分解对上覆水磷含量及赋存形态的影响[J].环境科学,2013,34(6):2184-2190
[16]陈丙法,冯慕华,尚丽霞,等.秋季聚积蓝藻打捞对蓝藻生长及水质影响的原位实验[J].湖泊科学,2016,28(2):253-262.
[17]曾巾,杨柳燕,肖琳,等.湖泊氮素生物地球化学循环及微生物作用[J].湖泊科学,2007,19(4):382-389.
[18]赵悬悬,朱光灿,许丽娟,等.蓝藻自然腐解特性研究[J],江苏农业学报,2013,29(2):312-318.
[19]Kalff J. Limnology Inland Water Ecosystems[M]. New Jersey:Prentice Hall,2002:85-93.
[20]Downes M T. Aquatic nitrogen transformations at low oxygen concentration[J]. Appl Environ Microbiol,1988,54:172-175.
[21]张胜花,常军军,孙珮石.水体藻类磷代谢及藻体磷矿化研究进展[J].生态环境学报.2013,22(7):1250-1254.
[22]Wang Y Y,Chen F Z. Decomposition and phosphorus release from four different size fractions of Microcystis spp. Taken from Lake Taihu,China[J].Journal of Environment Sciences,2008,20(7):891-896.
(责编:王慧晴)
