Tim-3对早期梅毒患者外周血CD56dimNK细胞的影响及初步机制①
2019-09-03王政洁闫越颖张杰娜赵培庆
张 伟 王政洁 闫越颖 张杰娜 赵培庆
(菏泽市立医院皮肤性病科,菏泽274000)
梅毒是由梅毒螺旋体(Treponema pallidum,Tp)引起的性传播疾病。最新数据表明,我国梅毒发病率已达32.86/10万,居全国甲乙类法定传染病发病第3位,已成为严重影响我国公共卫生与人民健康的社会问题[1]。梅毒螺旋体含有丰富的脂蛋白,可作为病原相关分子模式(PAMPs)通过CD14和Toll样受体1(TLR1)以及TLR2依赖性信号通路激活巨噬细胞和树突状细胞(DC)[2,3]。然而梅毒螺旋体表面由于独特的外膜结构存在,导致缺乏暴露的脂蛋白成分,因此这些PAMPs不容易被TLRs或其他模式识别受体(PRRs)识别,从而造成梅毒螺旋体在组织中可长期复制并传播[4]。研究发现,患者感染的皮肤局部除了CD4+和CD8+T细胞外,还有大量CD56+NK细胞浸润,其可能的机制是通过分泌IFN-γ参与皮肤巨噬细胞的激活[5],提示NK细胞在梅毒患者的疾病进程中发挥重要作用。
T细胞免疫球蛋白与黏蛋白结构域分子3(T cell immunoglobulin and mucin domain containing 3,Tim-3)是重要的免疫调节分子。在人类活化的CD4+(Th1)和CD8+细胞毒性T细胞(TC)上首次发现;其表达范围较广,包括NK细胞在内几乎所有免疫细胞上都有Tim-3的表达[6]。Tim-3的功能也异常复杂,与免疫系统的激活和抑制都密切相关[7]。但到目前为止,Tim-3在梅毒患者NK细胞上的表达与功能皆未知。本研究中,我们采用流式细胞术等实验方法检测梅毒患者外周血中Tim-3的表达情况并探讨其初步功能,以期明确Tim-3在梅毒等性传播疾病发生发展中的确切生物学作用。
1 材料与方法
1.1 病例获取、试剂及仪器 早期梅毒患者外周血标本由菏泽市立医院皮肤性病科门诊收集,并与患者签署研究知情同意书。患者经梅毒螺旋体明胶凝集试验 (TPPA)及快速血浆反应素试验 (RPR)确诊,且未经治疗的早期梅毒患者78例[其中一期患者34例,二期患者40例,隐性梅毒患者4例;其中男62例,年龄(31.0±16.9)岁,女16例,年龄27.0±22.4)岁]。正常对照外周血标本80例取自菏泽市立医院健康体检中心,排除任何感染性疾病、自身免疫性疾病等可能影响Tim-3及NK细胞表达情况的疾病。流式抗体CD3、CD16、CD56为Biolegend公司产品(Cat# 300327,Cat#302011,Cat#304605,Biolegend,USA),Human Tim-3为R&D公司产品(#344823,R&D,USA),Lysing Buffer 为BD公司产品(#555899,BD,USA),RPMI1640培养基购自Gibco公司,PBS溶液购自Hyclone公司,人IL-2重组蛋白购自CST公司(#8907,CST,USA),人IL-12及IL-18重组蛋白购自R&D公司(Catalog #219 IL,Catalog #119 BP,R&D,USA),多功能酶标仪产自赛默飞世尔公司(VarioskanFlash),流式细胞仪产自美国BD公司(Aria2),Tim-3及STAT1干扰慢病毒载体由上海吉凯基因有限公司构建(GeneChem,Shanghai)。
1.2 方法
1.2.1 外周血NK细胞的检测 取患者及正常对照EDTA-K2抗凝外周血100 μl置于流式管底部,依次加入3 μl CD3、CD16、CD56、Tim-3流式抗体,室温避光30 min;加入1×Lysing Buffer 2 ml,涡旋混匀,置于室温避光15 min;1 000 r/min离心5 min后弃上清,然后用含0.5%小牛血清的PBS洗涤一次;弃上清,加入约1 ml PBS,充分混匀,上机检测。
1.2.2 外周血NK细胞分离与培养 按仪器要求调整液流,使液流稳定;然后用微球调节断点,先调节Ampl,使Gap线位于中上且下面两个数值保持稳定;分选时,把实际Drop1和Gap值输入设定窗口,并点击Sweet Spot锁定。常规制备无菌管路,以CD3-、CD16+、CD56bright或CD56dim设门分别分选CD56bright及CD56dim两群NK细胞,细胞分选成功后,加入IL-2(1 000 U/ml)刺激NK细胞增殖,并在含有双抗的细胞培养基中继续培养。
1.2.3 ELISA检测血清及培养上清中细胞因子的分泌 采集患者及正常对照5 ml无抗凝剂外周血标本,待标本完全凝集后充分离心(1 500 r/min离心20 min),以彻底去除可能影响检测的杂质。然后取上清50 μl进行细胞因子检测,并设阳性对照、阴性对照及空白对照孔。具体实验步骤参照试剂说明书,最后用多功能酶标仪在吸光度450 nm处进行读数,读取各孔OD值;绘制标准曲线,计算患者及正常对照血清中细胞因子的浓度。
1.2.4 流式细胞仪检测胞内蛋白IFN-γ水平 收获培养的细胞1 000 r/min离心5 min,弃上清;加入500 μl 固定液对细胞进行固定,置室温10 min,1 000 r/min离心5 min,弃上清;加入1.5 ml破膜剂置室温10 min,1 000 r/min离心5 min,弃上清;加入含0.5%小牛血清的PBS重悬细胞,加入适量抗IFN-γ流式抗体室温孵育30 min;过400目细胞筛,上机检测。
1.2.5 Western blot检测培养细胞中信号通路蛋白的变化 利用蛋白裂解液(含RIPA)抽提细胞总蛋白质,裂解完成后酶标仪BCA法测蛋白浓度,进行蛋白电泳、转膜,最后将膜与磷酸化STAT1 抗体(#9167,CST,USA),STAT1抗体(#14994,CST,USA)及GAPDH抗体进行孵育,胶片曝光检测蛋白表达量, GAPDH为内参对照,与目的蛋白比对后得到相对表达量。
1.3 统计学分析 本研究统计学方法利用GraphpadPrism7.0.统计作图软件(GraphPad Software Inc.)进行统计学分析,数据采用t检验,相关性分析采用Spearman′s rank方法进行统计学分析。P<0.05表示差异有统计学意义。
2 结果
2.1 早期梅毒患者NK细胞数量变化 早期梅毒患者与正常人外周血经NK细胞标记抗体标记后(CD3-CD56+)进行流式分析,结果如图1所示,患者NK细胞比值(10.8±4.6)与正常对照(9.97±5.02)之间无统计学差异(P>0.05)。
2.2 早期梅毒患者NK细胞上Tim-3表达水平变化 流式结果显示梅毒患者NK细胞上Tim-3的表达水平较正常对照明显上调,差异有统计学意义(图2,P<0.05);进一步分析发现,梅毒患者CD56dimNK上Tim-3表达差异更显著(P<0.01)在CD56brightNK上Tim-3表达则差异较小(P=0.058)。一般情况下,CD56dim约占NK细胞总数的90%,表达中度亲和力的IL-2受体(IL-2R),其主要功能为细胞毒性作用,具有较强的杀伤活性;CD56bright则主要起免疫调节作用。本实验结果初步提示Tim-3可能通过抑制CD56dim生物学功能,从而导致梅毒患者疾病的发展进程。
2.3 早期梅毒患者CD56dimNK细胞上Tim-3表达水平与血清中IFN-γ相关性分析 为进一步明确CD56dimNK细胞上Tim-3的生物学功能,我们分析了患者Tim-3表达与其血清中IFN-γ分泌水平的相关性,结果如图3所示,Tim-3表达与其血清中IFN-γ 分泌水平呈明显负相关性(P<0.01,r=-0.450 6)。
2.4 Tim-3影响CD56dimNK细胞中INF-γ的分泌水平 分选式流式细胞仪以CD56dim设门后对该群细胞进行分选,分选出的细胞置于5%CO2、37℃细胞培养箱中培养,并以IL-2(1 000 U/ml)刺激该群细胞增殖。待细胞扩增后以1×104密度接种于24孔板中,继续培养24 h后,转染Tim-3干扰慢病毒载体及对照载体,流式细胞仪及ELISA检测IFN-γ水平,结果如图4所示,干扰Tim-3表达后,不管是CD56dimNK细胞中的IFN-γ表达水平,还是培养上清中的IFN-γ水平皆明显上调。

图1 早期梅毒患者NK细胞数量与正常人的比较Fig.1 Comparison of number of NK cells between patie-nts with early stage syphilis and control groupNote: A.Analysis of the ratio of NK cells by flow cytometry;B.There was no significant difference for the ratio of circulating NK cells between patients with early syphilis and controls(P>0.05).
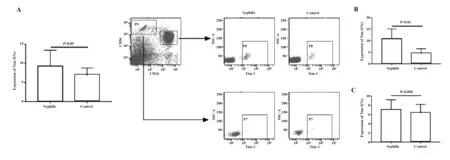
图2 早期梅毒患者NK细胞上Tim-3表达水平明显上调Fig.2 Up-regulation of Tim-3 on NK cells in patients with early stage syphilisNote: A.The expression level of Tim-3 on peripheral NK cells was significantly different from controls in patients with early stage syphilis (P<0.05);B.The expression level of Tim-3 was up-regulated on CD56dimNK cells in patients with early stage syphilis (P<0.01);C.There was no significant difference for Tim-3 on CD56brightNK cells between patients with early stage syphilis and controls (P=0.058).

图3 早期梅毒患者CD56dimNK细胞中Tim-3表达水平与血清中IFN-γ水平负相关Fig.3 Tim-3 expression level on CD56dimNK cells from patients with early syphilis was negatively correlated with the serum IFN-γ level

图4 干扰CD56dimNK细胞中Tim-3的表达后,IFN-γ分泌水平上调Fig.4 Up-regulation of IFN-γ after interference with Tim-3 on CD56dimNK cellsNote: A.Detection of Tim-3 interference determined by Western blot;B.After interfering with Tim-3 on CD56dimNK cells,the level of IFN-γ secretion was up-regulated (P<0.01);C.The supernatant IFN-γ level was up-regulated after interfering with Tim-3 on CD56dimNK cells (P<0.01).
2.5 Tim-3通过JAK-STAT1通路调控IFN-γ分泌Western blot检测梅毒患者CD56dimNK细胞JAK-STAT1通路蛋白变化,结果如图5所示,p-STAT1蛋白在IL-12和IL-18的刺激下较正常对照明显下调,干扰CD56dimNK细胞中Tim-3的表达后则JAK-STAT1通路蛋白表达上调,同时上清中IFN-γ分泌水平增高(P<0.01)。为进一步明确该通路在Tim-3介导IFN-γ分泌中的作用,我们干扰CD56dimNK细胞中Tim-3表达的同时,也对STAT1蛋白进行干扰,结果显示IFN-γ升高现象消失(P>0.05),提示Tim-3主要是通过JAK-STAT1通路调控IFN-γ分泌。

图5 Tim-3通过JAK-STAT1通路调控IFN-γ分泌Fig.5 Tim-3 regulates IFN-γ secretion via JAK-STAT1pathwayNote: A.p-STAT1 protein in CD56dimNK cells is significantly down-regulated in patients with syphilis;B.Up-regulation of p-STAT1 protein in CD56dimNK cells after Tim-3-sh transfected;C.Detection of STAT1 interference using Western blot method.Tim-3 regulates IFN-γ secretion via the JAK-STAT1 pathway;D.IFN-γ was up-regulated in the culture supernatant in CD56dimNK cells after interference with Tim-3 (P<0.01).Tim-3 regulates IFN-γ secretion via the JAK-STAT1 pathway;E.There was no significant difference for IFN-γ in CD56dimNK cells when both interference with STAT1 and Tim-3 (P>0.05).
3 讨论
人类NK细胞是一群异质性细胞群体,一般分为CD56dim和CD56bright两个亚群。 外周血中CD56dim约占NK细胞总数的90%,其功能主要为细胞毒性反应,在各类感染性疾病中发挥重要作用。相反,CD56bright只占外周血中NK细胞总数的10%,该类细胞主要生物学功能是免疫调节作用,可能在自身免疫性疾病中发挥关键作用[8,9]。与 CD56brightNK细胞不同,CD56dimNK细胞表达CD16 (Fcγ受体) 和KIR 受体[10]。在抗病原体感染方面,NK细胞一方面通过细胞与细胞直接接触来杀伤受病原体感染的细胞,另一方面通过分泌细胞因子(如IFN-γ)来控制病原体在细胞中的增殖[11],因此NK细胞在抗击病原体感染的第一线发挥重要的生物学作用。但相关研究表明早期梅毒患者IFN-γ分泌水平往往低于正常人,从而导致病原体清除障碍。
人Tim基因家族主要包括Tim-1、 Tim-3和 Tim-4,该家族成员与免疫调节、感染等密切相关。课题组前期研究表明Tim-4可以调控巨噬细胞免疫学功能,在SLE、糖尿病、脓毒血症等炎症性疾病中发挥关键生物学作用[12-15]。但Tim-3与其他两个成员不同,它几乎在所有免疫细胞中皆有表达,可以调控几乎所有细胞的功能。但到目前为止它通过调控NK细胞参与梅毒等性传播疾病的机制还不清楚。有研究报道梅毒患者外周血NK细胞数量较正常对照低[16],但在本研究中,我们发现NK细胞总数在梅毒患者与正常对照之间无统计学差异,可能的原因是检测群体差异导致。有趣的是,我们发现CD56dimNK细胞上Tim-3的表达水平差异非常显著,由于Tim-3是重要的免疫调节分子,因此我们认为Tim-3可能通过调控CD56dimNK细胞在梅毒感染中发挥关键生物学功能。
CD56dim主要表达中度亲和力的IL-2受体(IL-2R),主要功能是行使细胞毒性作用,具有较强的杀伤活性。有研究表明乙肝患者外周血中CD56dimNK细胞可分泌大量IFN-γ,进而导致乙肝病毒持续感染[17],表明CD56dimNK细胞可能通过调控IFN-γ的分泌水平参与感染性疾病的病理进程。由于我们发现早期梅毒患者CD56dimNK细胞中Tim-3表达水平与血清中IFN-γ水平明显负相关,提示Tim-3可能是该进程中的关键调控分子。已有研究表明Tim-3在成熟NK细胞上高表达,体外实验发现NK细胞上的Tim-3具有共刺激功能。在肿瘤模型中,Tim-3的表达与预后负相关,主要功能是抑制抗肿瘤作用,阻断Tim-3可逆转某些肿瘤中NK细胞的衰竭状态,表明Tim-3通过调控NK细胞促进了肿瘤的进展过程[18]。在感染性疾病如HIV患者中,有学者发现表达Tim-3的CD8+T细胞在功能上呈现耗竭状态,Tim-3表达水平也与病毒载量正相关[19]。在乙型肝炎病毒和丙型肝炎病毒感染者中,高表达的Tim-3也与T细胞功能耗竭相关,抗Tim-3治疗后可以使T细胞毒性功能部分恢复,并能显著降低病毒滴度[20]。Tim-3在某些胞内细菌如结核分枝杆菌感染中,Tim-3的表达可促进人类T细胞功能增强,利用小鼠模型发现Tim-3有助于在结核分枝杆菌感染过程中维持T细胞的耗竭状态。机制上,T细胞上的Tim-3与其配体Gal-9相互作用,后者又可刺激巨噬细胞,从而增强抗菌功效。因此Tim-3对免疫功能的调控具有双向性[21]。本研究中,CD56dimNK细胞上高表达的Tim-3生物学功能到底如何?我们首先分析了梅毒患者Tim-3表达水平与血清中IFN-γ分泌水平的相关性,结果发现Tim-3的表达与血清中IFN-γ分泌水平呈明显负相关性。IFN-γ等Th1型细胞因子可增强T细胞免疫功能,在促进梅毒螺旋体清除以及皮损愈合方面起重要作用。因此,我们初步认为CD56dimNK细胞上高表达的Tim-3可能抑制了IFN-γ的分泌,从而导致梅毒螺旋体的清除障碍。为进一步深入探讨Tim-3通过调控CD56dimNK细胞对IFN-γ分泌水平的影响,我们分选出CD56dimNK细胞,同时转染Tim-3干扰慢病毒载体及对照载体,结果发现干扰Tim-3表达后,不管是CD56dim中的IFN-γ表达,还是培养上清中的IFN-γ水平皆明显上调。该结果更进一步明确了我们的理论推测。文献结果表明IFN-γ的分泌主要受JAK-STAT1通路的正向调控[22]。基于以上理论基础,我们检测了梅毒患者CD56dimNK细胞中JAK-STAT1通路蛋白表达变化,结果显示梅毒患者CD56dimNK细胞中JAK-STAT1通路蛋白在IL-12和IL-18的刺激下较正常对照明显下调,干扰CD56dimNK细胞中Tim-3的表达后则JAK-STAT1通路蛋白表达上调,同时上清中IFN-γ分泌水平增高,该结果进一步明确Tim-3主要通过调控JAK-STAT1通路进而影响CD56dimNK细胞中IFN-γ的分泌水平。为进一步明确该通路在Tim-3介导IFN-γ分泌中的作用,我们干扰CD56dimNK细胞中Tim-3表达的同时,也对STAT1蛋白进行干扰,结果显示IFN-γ升高现象消失。以上结果更进一步表明Tim-3通过JAK-STAT1通路调控IFN-γ分泌,进而影响梅毒患者的疾病进程。
总之,在本研究中我们发现Tim-3通过下调JAK-STAT1通路蛋白,进而导致IFN-γ分泌减少。由于IFN-γ是梅毒螺旋体清除过程中的重要细胞因子,因此高表达的Tim-3水平可能抑制了梅毒螺旋体的清除进程,最终影响了梅毒患者的疾病进程。
综上所述,我们的结果初步阐释了Tim-3可能参与梅毒疾病进程的分子机制,为阐明梅毒发生发展提供了新的理论基础,可能在梅毒的预后判断中发挥重要作用。
