一种新型硼亲和磁性纳米吸附剂的制备及其对糖蛋白的分离纯化
2019-08-30贺茂芳苗延青王春阳
贺茂芳,张 博,苗延青,王春阳,韩 禄
(1.西安医学院药学院,西安医学院药物研究所,陕西西安710021;2.西安医学院临床医学院,陕西西安710021)
糖蛋白/糖肽的分离纯化和鉴定在疾病诊断及糖蛋白组学研究方面具有重要意义。然而,生物体内糖蛋白的丰度较低且基体复杂,鉴定难度较大[1-4]。目前,对糖蛋白的分离富集主要有酰肼化学法[5]、凝集素亲和色谱法[6]、亲水色谱法[7]和硼酸亲和法[8-10]等。基于硼亲和磁性吸附剂的磁性分散固相萃取具有选择性好、条件温和、操作简便等优点,成为糖蛋白分离纯化的常用方法。但由于基体材料表面的活性基团密度低,使直接键合的硼酸功能团数目较少,因此传统硼亲和吸附剂实际应用价值有限[11]。表面引发-原子转移自由基聚合(SI-ATRP)因具有活性可控的优点,已经成为材料表面构建三维聚合物的常用方法[12]。目前,基于SI-ATRP制备的硼亲和材料有硅胶[13]、石墨烯[14-15]和整体柱[16]等。例如,Ye等[17]通过SI-ATRP将聚3-(2-叠氮基-乙酰氨基)苯基硼酸接枝在硅胶表面,详细研究了其荧光响应,但并未关注材料的吸附容量。Wang等[13]和Li等[18]采用SI-ATRP技术制备了苯硼酸功能化硅胶吸附剂并用于邻羟基生物分子的分离富集,虽然获得了较高的吸附容量,但是高速离心过程导致样品损失,并且操作繁琐,不利于快速、高效地样品前处理。
近年来,磁性纳米材料因具有制备简单、生物相容性好、非特异性吸附小等优点而被广泛用于生物样品的前处理[19-21]。本研究以Fe3O4@SiO2磁性纳米粒子为基体,采用SI-ATRP技术,将3-丙烯酰基苯硼酸(AAPBA)原位聚合在磁性纳米粒子表面,制备了一种含有苯硼酸聚合物链的硼亲和磁性纳米吸附剂(Fe3O4@SiO2@pAAPBA)。将该吸附剂用于对糖蛋白的分离纯化,不仅具有较高的吸附容量和选择性,而且有效地提高了样品前处理效率,具有实际应用前景。
1 实验部分
1.1 仪器及试剂
Cary 60紫外-可见分光光度计(美国,安捷伦);H600透射电镜(日本,日立);STA600热分析仪(美国,Perkin-Elmer仪器公司);TENSOR 27傅立叶红外光谱仪(德国,布鲁克);TS-211BQ恒温振荡器(上海岛析实业有限公司);SB-5200DT超声清洗仪(宁波新芝生物科技股份有限公司)。
分析纯的FeCl3、正硅酸乙酯、2,2-联吡啶(bpy)购自国药集团化学试剂有限公司;3-氨基苯硼酸(99%)、丙烯酰氯(98%)、4-(氯甲基)苯基三甲氧基硅烷(4-CPTS)(99%)购自上海纯晶实业有限公司;卵清蛋白(OVA)、辣根过氧化物酶(HRP)、牛血清蛋白(BSA)、β-酪蛋白(β-casein)、溶菌酶(Lys),纯度均大于98%,购自美国Sigma-Aldrich公司。水为二次蒸馏水。
1.2 Fe3O4@SiO2@pAAPBA的制备
(1)Fe3O4@SiO2参照文献报道[22]按以下方法制备。Fe3O4的制备:1.3g FeCl3,0.4g柠檬酸酸钠,2.0g无水NaAc溶于30mL乙二醇中,搅拌30min后,转移至聚四氟乙烯反应釜中,200℃反应12h。反应结束后,磁分离倾去上层溶液,所得产物用水、乙醇依次洗涤,即得Fe3O4磁性纳米粒子。SiO2的包覆:0.5g Fe3O4依次用45mL 0.1mol·L-1HCl洗涤5min,90mL水洗涤10min后,分散于45mL 20%柠檬酸酸钠溶液中静置2h,随后将Fe3O4微球超声分散于720mL乙醇-水(576∶144,V/V)中,依次向其中加入15mL氨水、1.2mL正硅酸乙酯,搅拌下反应12h,磁分离倾去上层溶液,所得产物用水、乙醇依次洗涤,即得Fe3O4@SiO2。
(2)AAPBA的制备参照文献方法[23]。具体过程如下:5.0g(36.5mmol)3-氨基苯硼酸溶于0℃的73 mL的2mol·L-1NaOH溶液中;在冰浴、搅拌下向其中缓慢滴加5.9mL(73mmol)丙烯酰氯,在室温下搅拌反应2h后,再向其中缓慢滴加1mol·L-1HCl直至溶液的pH为1,此时会析出白色固体;过滤后用冷水多次洗涤固体并向滤液中加入NaCl直至饱和;用乙酸乙酯分3次萃取滤液(60mL×3),合并有机相、旋转蒸发得到白色固体,与上述白色析出物合并后,用60℃的水重结晶并用冷水冲洗产物,即得到灰色针状晶体AAPBA。
(3)采用SI-ATRP法制备Fe3O4@SiO2@pAAPBA。具体过程如下:首先将0.5g Fe3O4@SiO2分散于50mL干燥甲苯中,向其中加入0.5mL 4-CPTS,110℃反应8h,得到固体引发剂Fe3O4@SiO2@Cl;然后进行SI-ATRP反应:0.5g Fe3O4@SiO2@Cl超声分散于20mL DMF中,并向其中加入0.8g AAPBA,0.2g bpy,体系经过冷冻-抽真空-解冻循环3次后,在 N2保护下迅速加入0.1g CuBr,于95℃反应8h。反应结束后,用甲醇和水依次洗涤粒子,再用20%EDTA-2Na溶液浸泡4h以上以除去残余的Cu2+,最后用水洗涤,40℃真空干燥,即得到Fe3O4@SiO2@pAAPBA。
1.3 吸附容量的测定
用静态吸附法测定了Fe3O4@SiO2@pAAPBA对蛋白质的吸附容量。将蛋白质标准品配制于50mmol·L-1NH3-NH4Cl缓冲溶液(pH=8.5)中,得到一系列不同浓度的标准溶液。准确称量5.0mg吸附剂分散于2.0mL蛋白质标准溶液中,置于恒温振荡器中,于25℃、150r·min-1振荡30min后,用磁铁分离,用紫外分光光度计,在280nm波长处测定吸附后蛋白质溶液的平衡浓度。计算吸附剂对蛋白质的吸附量(Q):Q = (c0-ce)×V0/m 。其中,c0和ce(mg·mL-1)分别是蛋白质溶液的初始浓度和吸附后的平衡浓度,V0(mL)是蛋白质溶液的体积,m(mg)是吸附剂的质量。
1.4 吸附动力学
以OVA、HRP为模型蛋白,通过静态吸附法研究了吸附容量随吸附时间的变化。准确称量磁性纳米吸附剂5.0mg,分散于2.0mL 0.5mg·mL-1的蛋白质标准溶液中,置于恒温振荡器上,设定振荡时间分别为5、10、20、30、60min。振荡结束后测定并计算吸附容量,方法同上。
1.5 吸附选择性
用竞争吸附法考察了Fe3O4@SiO2@pAAPBA对混合样品中糖蛋白的吸附选择性。将100mg Fe3O4@SiO2@pAAPBA分散于5.0mL含有1.0mg·mL-1BSA、Lys、β-casein和 OVA 的混合溶液中,吸附30min。吸附完成后,用磁铁分离出上层清液,将吸附剂用缓冲液淋洗3次,最后用5%HAc溶液洗脱。将吸附前后的蛋白质溶液、淋洗液和洗脱液进行十二烷基苯磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
1.6 实际样品分析
将鲜鸡蛋清用50mmol·L-1NH3-NH4Cl缓冲溶液(pH=8.5)稀释20倍,室温下搅拌30min,在4℃、10 000r·min-1下离心20min,上层清液即为鸡蛋清样品。将100mg Fe3O4@SiO2@pAAPBA分散于5.0mL鸡蛋清样品中,吸附30min。吸附完成后,用磁铁分离出上层清液,将吸附剂用缓冲液洗涤3次,最后用5%HAc溶液进行洗脱。将吸附前后的蛋清样品溶液、洗涤液和洗脱液进行SDS-PAGE分析。
2 结果与讨论
2.1 Fe3O4@SiO2@pAAPBA的制备与表征
SI-ATRP作为一种活性可控的聚合方法,被广泛应用于各种基质表面聚合物的接枝,以提高材料表面功能基团的密度。本研究选用4-CPTS为引发剂,通过硅烷化反应将其键合在Fe3O4@SiO2表面,得到固定引发剂Fe3O4@SiO2@Cl;然后以AAPBA为单体,在CuBr/bpy的催化下进行聚合反应,反应结束后即在Fe3O4@SiO2表面生成了含有苯硼酸的聚合物链(图1)。

图1 SI-ATRP法制备Fe3O4@SiO2@pAAPBAFig.1 The preparation process of Fe3O4@SiO2@pAAPBA via SI-ATRP
通过傅里叶变换红外(FT-IR)光谱和X射线光电子能谱(XPS)对Fe3O4@SiO2@pAAPBA表面化学组成进行表征(图2)。在Fe3O4@SiO2的FT-IR光谱图谱中(图2A曲线a),631、1 095cm-1处的吸收峰分别归属于Fe-O-Fe和Si-O-Si的伸缩振动,1 625、1 408cm-1的吸收峰分别归属于Fe3O4@SiO2表面残留柠檬酸酸钠中COO-的对称振动和非对称振动;在Fe3O4@SiO2@pAAPBA的FT-IR图中(图2A曲线b),1 350cm-1处出现了B-O键的特征吸收,同时1 625、1 580、1 450cm-1处出现了新的吸收峰,属于苯环的骨架振动。在XPS图谱中(图2B),196.5eV和400.8eV的结合能分别归属于B 1s和N 1s。对各元素含量进行积分计算,Fe3O4@SiO2@pAAPBA表面的N元素含量为4.2%,B元素含量为3.6%。

图2 (A)Fe3O4@SiO2(a)和Fe3O4@SiO2@pAAPBA(b)傅立叶变换红外(FT-IR)光谱图;(B)Fe3O4@SiO2@pAAPBA的X射线光电子能谱(XPS)图Fig.2 (A)FT-IR spectra of Fe3O4@SiO2(curve a)and Fe3O4@SiO2@pAAPBA(curve b);(B)XPS spectra of Fe3O4@SiO2@pAAPBA
采用透射电镜(TEM)观察了吸附剂的形貌和尺寸(图3A、3B)。可以明显地观察到Fe3O4@SiO2的“核壳”结构,且SiO2层包裹密实,厚度约为30nm;经过聚合反应后,得到的Fe3O4@SiO2@pAAPBA表面粗糙,聚合物层厚度增大。最后,利用热重分析(TGA)表征了Fe3O4@SiO2表面聚合物的含量(图3C)。当温度由25℃升高到200℃时,Fe3O4@SiO2和Fe3O4@SiO2@pAAPBA的质量均有所下降,可能是材料中残余溶剂的挥发所致。当温度继续升高时,由于SiO2具有良好的热稳定性,Fe3O4@SiO2在200~750℃间质量下降仅为5%;Fe3O4@SiO2@Cl在300~500℃间的质量损失率为6%,是4-CPTS的分解所致;相比之下,Fe3O4@SiO2@pAAPBA在200~600℃间的质量损失率高达17%,说明Fe3O4@SiO2表面AAPBA聚合物的相对含量为17%。以上结果证明Fe3O4@SiO2@pAAPBA的制备是成功的。

图3 (A)Fe3O4@SiO2的透射电镜(TEM)图;(B)Fe3O4@SiO2@pAAPBA的TEM 图;(C)Fe3O4@SiO2(a)、Fe3O4-@SiO2@Cl(b)、Fe3O4@SiO2@pAAPBA(c)的热重分析(TGA)曲线Fig.3 (A)TEM image of Fe3O4@SiO2;(B)TEM image of Fe3O4@SiO2@pAAPBA;(C)TGA curves of Fe3O4@SiO2(a),Fe3O4@SiO2@Cl(b)and Fe3O4@SiO2@pAAPBA(c)
2.2 吸附容量
采用静态吸附法测定了Fe3O4@SiO2@pAAPBA对4种不同蛋白质的吸附容量,并绘制了等温吸附线(图4)。由图可以看出,Fe3O4@SiO2@pAAPBA对蛋白质的吸附容量随着蛋白质溶液浓度的增大而逐渐增大,最后达到平衡。但是Fe3O4@SiO2@pAAPBA对OVA和HRP的吸附容量要远高于BSA和Lys,这是由于OVA和HRP为糖蛋白,其分子表面的邻羟基能与Fe3O4@SiO2@pAAPBA表面的硼酸基发生共价结合,因此Fe3O4@SiO2@pAAPBA对糖蛋白具有特异性吸附。Fe3O4@SiO2@pAAPBA对OVA和 HPR的吸附容量分别为373.9μg·mg-1和471.3μg·mg-1。
2.3 吸附动力学
改变吸附时间,研究Fe3O4@SiO2@pAAPBA对糖蛋白的吸附容量随时间的变化,结果如图5。可见,在5min到30min内,Fe3O4@SiO2@pAAPBA对OVA和HPR的吸附容量迅速增大,30min后不再增大。因此,Fe3O4@SiO2@pAAPBA对糖蛋白的吸附在30min内达到平衡。说明该吸附剂对蛋白质的吸附具有较快的传质速率,这大大缩短了分析时间,提高了样品前处理的效率。

图4 Fe3O4@SiO2@pAAPBA对不同蛋白质的静态吸附等温线Fig.4 Adsorption isotherms of Fe3O4@SiO2@pAAPBA towards different proteins

图5 吸附时间对蛋白质吸附量的影响Fig.5 Effect of adsorption time on the adsorption capacity for proteins
2.4 吸附选择性
根据硼亲和原理,在碱性条件下,硼羟基能与顺式二羟基形成稳定的五元或六元酯环;而在酸性条件下,酯环水解,反应逆向进行,从而释放出顺式二羟基物质。因此,硼亲和吸附剂特别适合用于顺式二羟基物质的分离纯化。本研究用Fe3O4@SiO2@pAAPBA对糖蛋白(OVA)和非糖蛋白(BSA、Lys、β-casein)的混合溶液进行磁性分散固相萃取,SDS-PAGE分析结果如图6。由于OVA分子表面含有顺式二羟基,能与Fe3O4@SiO2@pAAPBA发生可逆结合,因此萃取之后的蛋白质样品中(条带3)OVA的含量明显降低,而BSA、Lys和β-casein基本没有变化;在洗涤液中(条带4),物理吸附的蛋白质都被洗涤下来;而在洗脱液中(条带5),OVA分子被释放,获得了较高的纯度。因此,Fe3O4@SiO2@pAAPBA对糖蛋白具有特异性识别,可用于复杂样品中糖蛋白的分离纯化。
2.5 实际样品分析
鸡蛋清中含有丰富的蛋白质,主要包括OVA(45kDa)、卵蛋白抑制物(Ovoinhibitor,49kDa)、转铁蛋白(TRF,77kDa)和Lys(14kDa),它们的相对含量分别为54%、11%、13%和3.5%。其中,OVA、卵蛋白抑制物、转铁蛋白都是糖蛋白[24]。因此,本研究以鸡蛋清为生物样本,考察了Fe3O4@SiO2@pAAPBA对实际样品中糖蛋白的分离纯化能力,SDS-PAGE结果如图7。对比条带2和3可以发现,鸡蛋清样品中OVA、卵蛋白抑制物和转铁蛋白经过固相萃取之后含量明显降低,表明这3种蛋白被选择性吸附;而在洗涤液中(条带4),物理吸附的蛋白质被洗脱下来,出现了浅显的条带;在洗脱液中,被吸附OVA、卵蛋白抑制物和转铁蛋白被洗脱下来,从而出现了明显的条带且纯度较高,说明它们从鸡蛋清中被分离提取出来。因此,Fe3O4@SiO2@pAAPBA可用于实际样品中糖蛋白的分离纯化,具有良好的实际应用前景。

图6 蛋白质的SDS-PAGE分析图Fig.6 SDS-PAGE analysis of proteinslane 1:protein marker;lane 2:protein mixture before the solid phase extraction;lane 3:protein mixture after the solid phase extraction;lane 4:the washing fraction,lane 5:the elution fraction.
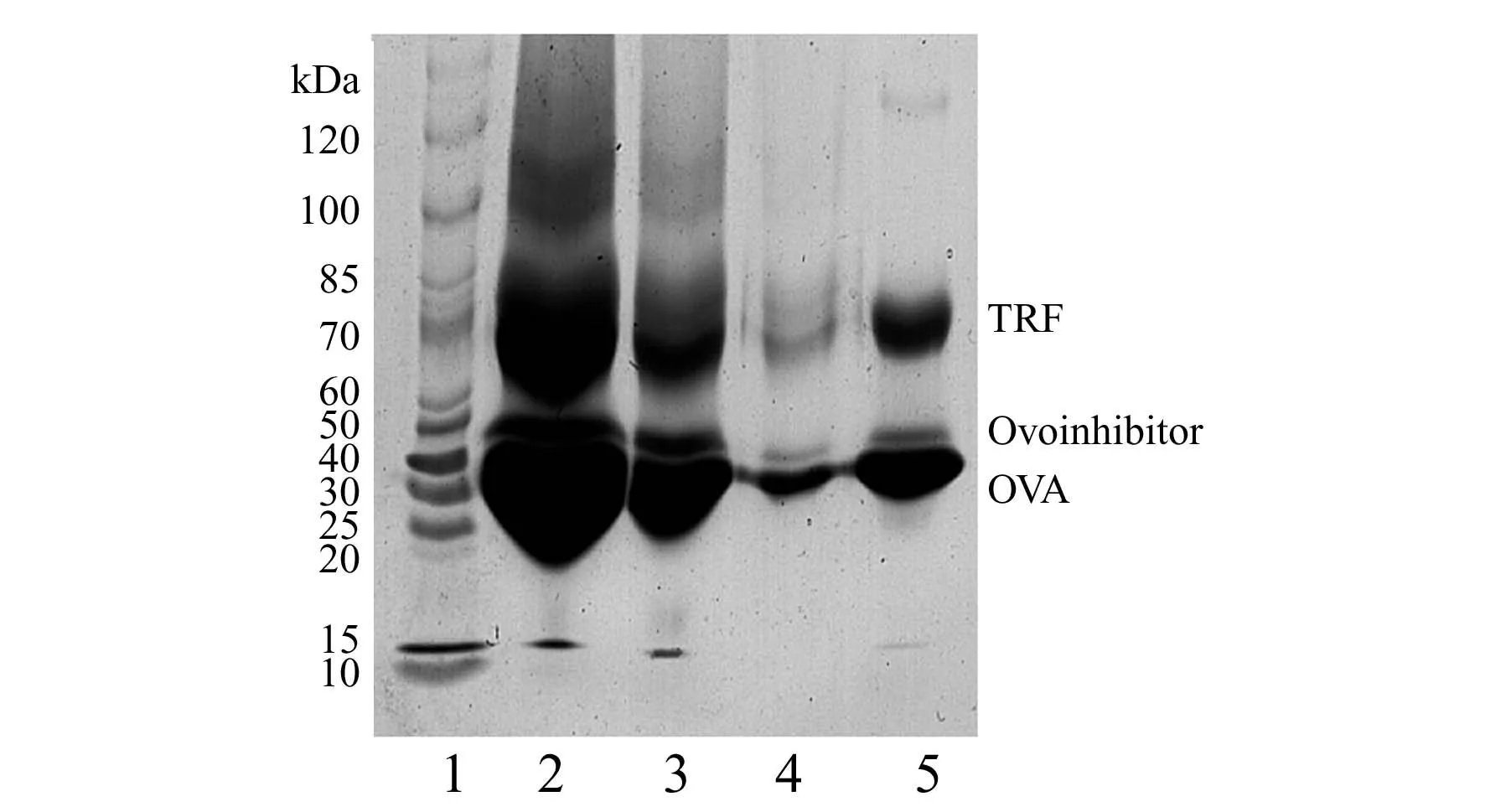
图7 实际样品中蛋白质的SDS-PAGE分析图Fig.7 SDS-PAGE analysis of proteins in real samplelane 1:protein marker,lane 2:egg white before the solid phase extraction;lane 3:egg white after the solid phase extraction;lane 4:the washing fraction,lane 5:the elution fraction.
2.6 重复利用性能
将50.0mg Fe3O4@SiO2@pAAPBA吸附剂重复进行吸附-洗脱-吸附实验,重复10次,测定其吸附容量。重复利用7次以后,吸附容量虽然有所下降,但仍保持在初始吸附容量的81%左右。因此,该吸附剂具有较好的稳定性和重复利用性能。
3 结论
本研究以AAPBA为单体,采用SI-ATRP技术在Fe3O4@SiO2表面接枝含有苯硼酸基团的聚合物链,制备了一种新型硼亲和磁性纳米吸附剂。聚合物链的接枝有效地提高了微球表面苯硼酸基团的密度,从而增大了吸附剂对糖蛋白的吸附容量。同时,该吸附剂对糖蛋白具有吸附选择性,将其用于鸡蛋清样品的分离纯化,能够选择性吸附糖蛋白并有效排除干扰。因此,此吸附剂可用于实际样品中糖蛋白的分离纯化,在生物样品前处理方面具有良好的应用前景。
