光镊捕获单个上转换发光微纳复合物颗粒对链置换反应引发解组装过程的实时探测
2019-08-30宋重阳康亚峰李诚予庞代文唐宏武
宋重阳,康亚峰,李诚予,庞代文,唐宏武
(生物医学分析化学教育部重点实验室,武汉大学化学与分子科学学院,湖北武汉430072)
自1986年Ashkin发明光镊以来[1],这一操纵微粒的工具得到了广泛的应用。一些研究者应用光镊捕获各种各样的纳米颗粒,例如金纳米粒子(AuNPs)[2]、量子点(QDs)[3]、上转换纳米颗粒(UCNPs)[4-5]、DNA纳米复合物[6]等,用来研究纳米材料和结构的光物理和光化学性质等问题[3,5]。UCNPs具有近红外激发、可见光发射的特点,在生物分子检测[7]、细胞标记[8]、活体成像[9]等领域得到广泛的应用。Jaque等人基于光镊捕获UCNPs,研究了UCNPs的发光性质[5],以及尺寸和表面电荷对光阱力的影响[10],并操纵单颗UCNPs考察了单细胞光热效应[11]。
链置换反应(Strand Displacement Reaction)是动态DNA纳米技术(Dynamic DNA Nanotechnology)研究的核心。其中Toehold,即进攻链(Invader strand)与之结合后引发分支迁移的单链DNA片段,可用于改变链置换反应的速率,进而构建具有复杂动力学行为的无酶DNA反应网络[12-13]。一些研究者利用Toehold介导的链置换反应,结合生物功能化纳米材料,构建纳米生物传感器用于DNA/RNA的传感和检测。Sun等人[14]利用金纳米棒、金纳米十字架构建荧光共振能量转移-表面荧光增强类型的纳米传感器,实现miRNA-34a的灵敏检测和细胞内成像。Li等人[15]构建卫星式纳米金复合物,探究Toehold介导的链置换反应的动力学行为,并将其应用于活细胞内miRNA-21的实时检测。
我们曾结合光镊技术和微球悬液分析方法,实现了肿瘤标志物分子的体外检测[7]。在此基础上,本文结合核酸链置换反应和发光稳定的UCNPs,构建可以对DNA进行响应的上转换发光的微纳复合物(Micro-Nano Composites,MNCs),并采用光镊辅助的显微成像平台实时探测单颗MNCs的解组装过程,希望未来本方法能够应用于生物体系中生物分子的实时检测。
1 实验部分
1.1 仪器与试剂
IX70型倒置荧光显微镜(日本,Olympus Ltd);Evolve 512Delta型电子倍增电荷耦合器件(EMCCD)(加拿大,Photometrics Ltd);980nm连续激光器(上海科乃特激光科技有限公司);ZS90型动态光散射粒度仪(英国,Malvern Instruments Ltd.);JEM-2010型透射电子显微镜镜(日本,JEOL Ltd);SIGMA FESEM型扫描电子显微镜(德国,Zeiss)。
稀土氯化物(LnCl3·6H2O)、Y(NO3)3·6H2O、NH4F、油酸(OA)、十八烯、2-(N-吗啡啉)乙磺酸(Mes)、4-羟乙基哌嗪乙磺酸(Hepes),均购于上海阿拉丁公司;聚丙烯酸(PAA)、马来酸酐十八碳烯共聚物(PMAO)、三羟甲基氨基甲烷(Tris),均购于Sigma-Aldrich(中国上海);双(6-氨基己基)胺(BHMT)购于上海TCI;NaOH、NaF、NaCl、氯仿、乙醇、正己烷、甲醇、一缩二乙二醇等购于国药集团化学试剂有限公司;碳二亚胺盐酸盐(EDC)购于上海共价化学;羟基-PEG2000-氨基、生物素-PEG2000-氨基购于上海芃硕生物科技有限公司;色谱纯链酶亲和素(SA)和DNA购于上海生工生物工程技术服务有限公司,见表1。实验用水为超纯水。
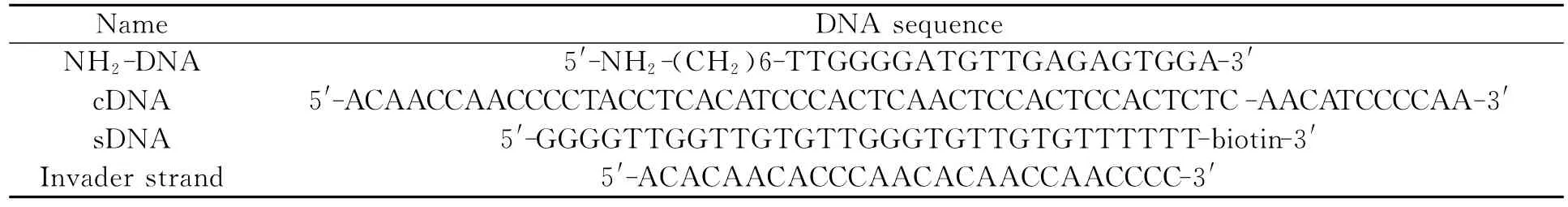
表1 实验所用核酸序列Table 1 DNA Sequences used in this study
1.2 PMAO-UCNPs的制备
采用高温热裂解法制备油溶性 UCNPs[16]。将1mmol稀土氯化物(Y/Yb/Er,78%/20%/2%)置于100mL三口烧瓶中,加入6mL OA和15mL十八烯,磁力搅拌和真空环境下升温至120℃,保持120℃一段时间直至氯化物溶解。降温至50℃以下,加入10mL NH4F(148mg)和NaOH(100mg)的甲醇溶液并搅拌30min,然后升温至110℃将甲醇蒸出,随后氩气保护下升温至320℃并保持此温度反应1h。反应结束后,用水和乙醇的混合溶液(1∶1,V/V)、乙醇和正己烷(5∶11,V/V)的混合溶液分别洗涤3次,最后将得到的固体物质分散于8mL氯仿中,即得OA包覆的上转换纳米颗粒(OA-UCNPs)。
OA-UCNPs的水溶性修饰采用两亲性聚合物PMAO包覆的方法[17]。称取500mg的PMAO,置于100mL单口圆底烧瓶中,加入20mL氯仿搅拌溶解。加入1mL上述制备的OA-UCNPs,超声5min,室温下搅拌2h后,减压旋蒸除去氯仿。再加入10mL氯仿溶解分散,磁力搅拌下逐滴加入1mL的BHMT(30mg)的氯仿溶液,水浴超声30min后,减压旋蒸除去氯仿。加入12mL Na3BO3溶液(50mmol/L,pH=9),于65℃水浴超声将凝胶状聚合物溶解。将所得的溶液于8 000r/min离心3min,弃去离心下来的团聚物,上清液用0.45μm滤膜过滤后,于16 000r/min离心30min,将离心下来的固体用水洗涤3次,最后分散于1mL水中,即得水溶性上转换纳米颗粒PMAO-UCNPs。
1.3 PAA-MPs的制备
采用水热法制备 NaYF4-MPs[18]。将0.0016mol Y(NO3)3·6H2O 置于50mL水热反应釜中后,用8mL水溶解,加入5mL柠檬酸钠溶液(0.0016mol),磁力搅拌30min;加入18mL NaF溶液(0.0128mol)继续搅拌1h后,将水热釜加热至220℃反应12h,冷却至室温,依次用水、乙醇各洗涤3次后,分散于4mL乙醇中。MPs的表面修饰采用PAA配体交换的方法[19]。将200mg的PAA置于50mL三口烧瓶中,加入10mL一缩二乙二醇溶解,磁力搅拌下,逐滴加入1mL上述制备的MPs乙醇悬浮液,于水浴中超声分散30min,磁力搅拌下升温至120℃蒸出乙醇,在氩气保护下升温至240℃并持续搅拌4h。反应结束后,依次用乙醇和水各洗涤3次,最后分散于1mL水中,即得PAA-MPs悬浮液。
1.4 Capture-MPs的制备
取20μL上述制备的 MPs悬浮溶液,加入30μL NH2-DNA(10μmol/L),混合均匀后加入10μL新配的EDC溶液(10mg/mL),混匀后置于旋转混匀仪上反应过夜,3 000r/min离心分离,并用Tris-HCl缓冲溶液(50mmol/L,pH=8.0,200mmol/L NaCl)洗涤3次,再分散于50μL的 Hepes缓冲溶液(10mmol/L,pH=7.4,200mmol/L NaCl)中,4℃下保存备用。
1.5 SA-UCNPs的制备
取100μL制备的水溶性上转换纳米颗粒PMAO-UCNPs,依次加入100μL Mes缓冲溶液(10mmol/L,pH=6.1),10μL羟基-PEG2000-氨基(100mg/mL),10μL生物素-PEG2000-氨基(0.1mg/mL),混合均匀后加入10μL现配的EDC溶液(1mg/mL),室温下反应过夜。反应结束后,16 000r/min离心30min,用 Hepes缓冲溶液(10mmol/L,pH=7.4,200mmol/L NaCl)洗涤3次,分散于200μL Hepes缓冲溶液中,加入2μg SA,于25℃孵育12h,用Hepes洗涤3次后,分散于200μL Hepes中,4℃下保存备用。
1.6 MNCs的制备
取浓度均为10μmol/L的sDNA和cDNA各10μL,于25℃孵育2h,得到20μL的Duplex溶液(5μmol/L),置于4℃下保存备用。将Capture-MPs和1nmol/L的Duplex孵育4h,Hepes(10mmol/L,pH=7.4,200mmol/L NaCl,1%BSA)洗涤3次后,加入SA-UCNPs孵育16h,Hepes洗涤3次,再分散于Hepes中,4℃下保存备用。
1.7 链置换反应引发MNCs解组装
在上述制备的 MNCs悬浮液中加入不同浓度的Invader strand(10nmol/L、1nmol/L、0.1nmol/L、0nmol/L),混匀后于25℃旋转振荡反应12h。取10μL样品置于显微成像样品室中,以100×油镜观察,10mW激光形成光镊捕获单颗微纳复合物,EMCCD采集显微照片并记录上转换发光信号的强度(曝光时间50ms,增益2)。
1.8 实时探测光阱中MNCs的解组装
将上述制备的MNCs悬浮液稀释20倍,然后取10μL分别加入10μL不同浓度的Invader strand(2 000nmol/L、200nmol/L、20nmol/L、2nmol/L、0nmol/L),混匀后,立即加入显微成像样品室中,光镊捕获后观察发光强度的变化,每一浓度测定5个MNCs。
2 结果与讨论
2.1 实时探测MNCs解组装的原理
如图1所示,构建的MNCs以链置换反应的底物为连接单元和分子识别单元,NaYF4微米颗粒为载体,UCNPs为发光标记材料。Invader strand存在时,引发链置换反应,MNCs发生解组装。单颗MNCs被捕获时解组装过程在光阱中进行,通过显微成像平台实现对该过程的实时探测。
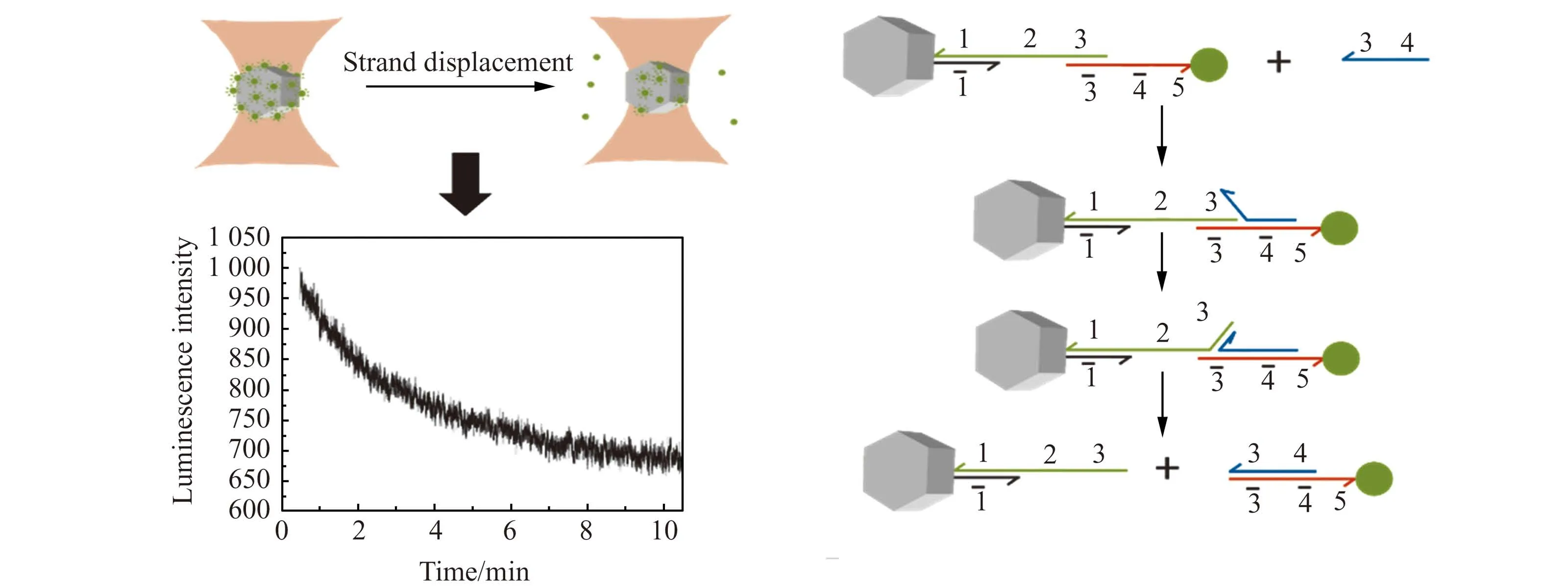
图1 实时探测链置换引发MNCs解组装的示意图Fig.1 Schematic illustration of real-time detection of the disassembling process of MNCs induced by strand displacement
2.2 UCNPs的制备
图2 A(a)为OA-UCNPs的透射电镜(TEM)图片,该纳米颗粒粒径均一(22.9±1.5nm)。制备得到的PMAO-UCNPs(图2A(b))和OA-UCNPs相比,其形貌没有明显变化,但是其表面有一层聚合物包覆层,厚度约为2nm。动态光散射测试结果(图2B、2C)表明,偶联PEG之后UCNPs的水合粒径由27nm增加到30nm,Zeta电势由-30mV变为-25mV,证明UCNPs表面偶联上PEG分子。然后将SA和PEG末端的生物素结合,制备得到SA-UCNPs。
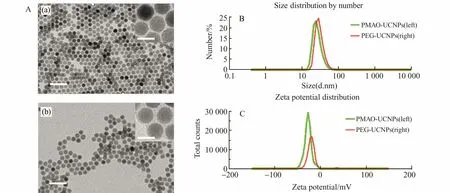
图2 (A)OA-UCNPs(a)和PMAO-UCNPs(b)的透射电镜(TEM)图(标尺100nm,插入图中标尺25nm);(B)PMAO-UCNPs和PEG-UCNPs的动态光散射粒径测试结果;(C)PMAO-UCNPs和PEG-UCNPs的动态光散射Zeta电势测试结果Fig.2 (A)TEM images of OA-UCNPs(a)and PAMO-UCNPs(b)(scale bar 100nm,insert scale bar 25nm);(B)DLS sizes of PMAO-UCNPs and PEG-UCNPs;(C)DLS zeta potentials of PMAO-UCNPs and PEG-UCNPs
2.3 PAA修饰的NaYF4微米颗粒(PAA-MPs)的制备
图3 A为MPs的扫描电镜(SEM)图,由图可见MPs为规则的正六边型盘状晶体,尺寸均一,平均直径为1.17±0.07μm,平均厚度为0.67±0.05μm。我们用PAA对MPs的表面进行修饰,在MPs表面引入羧酸官能团,Zeta电势测试结果证明PAA成功修饰在MPs表面(图3B)。

图3 (A)MPs的扫描电镜(SEM)图(标尺5μm);(B)MPs和PAA-MPs的动态光散射(DLS)Zeta电势Fig.3 (A)SEM image of MPs(scalebar 5μm);(B)DLS zeta potentials of MPs and PAA-MPs
2.4 MNCs的制备
UCNPs在MPs表面的组装通过Duplex的连接实现,详细步骤如图4A所示。首先PAA-MPs表面偶联NH2-DNA,制备得到Capture-MPs,然后通过异相DNA杂交将Duplex固定到MPs表面,最后通过SA与biotin的结合,将SA-UCNPs组装在MPs表面,从而得到MNCs。根据SEM图(图4B),UCNPs已成功组装到MPs表面。

图4 (A)MNCs的制备流程图;(B)MNC的SEM图Fig.4 (A)Schematic illustration of the preparation of MNCs;(B)SEM image of MNCs
2.5 单个MNCs的光学捕获
我们通过对商品化的倒置荧光显微镜进行改造来搭建光镊平台,其光路如图5A所示。图5B为EMCCD拍摄的单颗MNCs进入光阱被捕获的过程。MNCs在极短时间内即可被稳定捕获,MNCs处于光阱边缘位置时发光微弱,稳定捕获后发光大大增强。这是因为光阱内的激光功率密度可以达到106W/cm2,虽然UCNPs量子产率较低,但仍然可以发出明亮的荧光。

图5 (A)光镊辅助的显微成像平台;(B)单颗MNCs的捕获过程Fig.5 (A)Optical tweezers-assisted imaging plateform;(B)Trapping process of single MNCs
水分子在980nm波长处有较大吸收[4],如果产生的热量过多,将会造成光阱(激光焦点处)内溶液的温度过高,会影响微纳复合物中起连接作用的DNA Duplex的稳定性,使其解链的可能性增加(图6A)。如图6B所示,激光功率为50mW时光阱中单颗MNCs的发光强度随时间逐渐减弱,以10mW的激光功率捕获MNCs的同时连续激发30min,MNCs的发光强度也没有明显变化,说明10mW激光不影响MNCs的稳定性。为了避免过热效应对微纳复合物稳定性的不利影响,我们采用10mW的激光捕获MNCs。

图6 (A)过热导致MNCs解组装的示意图;(B)不同功率激光对MNCs发光的影响Fig.6 (A)Scheme of the disassembly process of MNCs caused by overheating;(B)Influence of different powers on the luminescence of MNCs
2.6 链置换反应引发微纳复合物解组装
Invader strand首先与sDNA的Toehold结合,然后经过分支迁移,将cDNA置换下来,cDNA和sDNA分开,与sDNA连接的UCNPs脱离 MPs。如图7所示,在MNCs悬液中加入不同浓度的Invader strand孵育12h,MNCs的发光强度有不同程度减弱,浓度越高信号变化越大。低至100pmol/L的浓度即可产生显著的信号变化,因此MNCs可应用于DNA的检测。
2.7 微纳复合物解组装的实时探测

图7 与不同浓度的invader strand孵育12h后单颗MNCs的发光强度Fig.7 Luminescence intensity of single MNCs after incubating with different concentrations of invader strand for 12h
在证明光阱中MNCs的稳定性和解组装的有效性之后,我们进一步实时探测了光阱中MNCs的解组装过程,如图8A所示。加入100nmol/L Invader strand,MNCs的发光强度在数分钟之内快速减弱,如图8B和8C所示。Invader strand的浓度越高,如图8D所示,发光强度变化速度越快。Invader strand的浓度为1nmol/L时,可以在10min内产生显著的信号变化,因此构建的MNCs可作为微传感器用于DNA的实时检测。

图8 (A)光阱中链置换引发 MNCs解组装;(B)100nmol/L invader strand产生的发光强度变化(平行测定5个MNCs);(C)图B中5次结果的平均值;(D)不同浓度invader strand产生的发光强度变化(从上至下:0、1、10、100、1 000nmol/L)Fig.8 (A)Disassembling process of optical-trapped MNCs induced by strand displacement;(B)Luminescence variation caused by 100nmol/L invadet strand(measuring 5MNCs);(C)Average value of 5measurements in(B);(D)Luminescence variations caused by invader strand with different concentrations(from top to bottom:0,1,10,100,1 000nmol/L)
3 结论
本文以微米颗粒作为载体,纳米颗粒为发光标记材料,链置换反应底物Duplex为连接单元构建的微纳复合物在Invader strand存在时顺利发生解组装。较低功率(10mW)的近红外激光对微纳复合物的稳定性没有明显影响,利用光镊辅助的显微成像平台可以实时探测链置换反应引发的微纳复合物的解组装过程。光镊捕获的微纳复合物可作为一种微传感器来响应DNA浓度的变化,结合光镊可以主动捕获并操纵微粒的特点,构建的MNCs有望应用于生物体系中DNA/RNA的实时探测,为动态DNA纳米技术提供一种有效的研究手段。
