不同有机氮源对山药-食药用真菌“双向发酵”的影响
2019-08-30尹圣化王振泉李慧星郭书贤
许 彬,尹圣化,王振泉,李慧星,李 斌,郭书贤
(1.南阳理工学院 生物与化学工程学院,河南 南阳 473004;2.河南省工业微生物资源与发酵重点实验室,河南 南阳 473004;3.南阳福元生态菌业有限公司,河南 南阳 473004)
山药-食药用真菌菌质是以山药为培养基质,接种食药用真菌菌种,经固态发酵后得到的菌丝、山药基质及发酵代谢产物的混合物。在现代科技条件严密控制下,用有益的食药用真菌发酵具有活性成分的中药材,其除了能提供真菌所需营养外,同时因真菌酶的作用,分解转化药性基质的组织成分,使原有的成分(含活性成分)转化,形成新成分,从而具有新的性味功能,因此发酵具有“双向性”[1]。山药中的淀粉、纤维素、微量元素等物质能为食药用真菌提供营养,促进菌丝的生长代谢和抗氧化活性物质的生成[2]。同时,食药用真菌在生长代谢过程中凭借菌丝的穿透能力、水解酶和氧化酶的酶解能力[3-5],可以解聚山药基质的细胞结构,促进山药中的抗氧化活性物质如山药多糖、多酚、皂甙等[6-8]的释放,并有可能生成新的活性物质。课题组前期研究表明,灵芝、蛹虫草、香菇、银耳对山药基质具有良好的适应性,表现在这四种食药用真菌与山药形成的菌质在折干率、消耗率、自由基清除率方面总体上优于其他山药-食药用真菌菌质。这四种菌质的自由基清除能力远高于山药本身,且菌质提取物的高效液相色谱(high-performance liquid chromatography,HPLC)图成分比山药提取物的更多。因此,山药-食药用真菌的发酵具有“双向性”,形成的菌质具有更高的抗氧化活性,可以开发为抗氧化食品,显著增加山药的附加值。
影响食药用真菌在药性基质上发酵的因素包括药性成分种类、碳源种类和用量、氮源种类和用量等[2,9-11],由于山药-食药用真菌菌质可开发为抗氧化食品,而使用有机氮源则可以提高产品的营养价值,具有可食用性。蛋白粉可以作为食药用真菌发酵体系中的有机氮源,顾冬艳等[12]将大豆粉作为北虫草的发酵基质;高文庚等[13]在灵芝发酵基质中添加12%的大豆粉。氮源种类可能会影响菌丝在基质上的生长速度[14-15]、菌丝对基质的利用率、菌丝生物量[13,16]以及菌丝代谢产物和菌质的抗氧化活性[12,17-18]。
山药是一种食药同源食物,可以作为食药用真菌的固态培养基质。课题组前期通过主成分分析研究得出,食药用真菌对山药基质适应性因子中包含了折干率、消耗率、超氧阴离子清除率、2,2-二苯基-1-苦基肼(2,2-diphenyl-1-picrylhydrazyl,DPPH)自由基清除率、羟基自由基清除率指标,耗时因子中包含了布满天数指标。本研究以山药作为培养基质分别接种发酵灵芝、蛹虫草、香菇和银耳四种对山药适应性良好的食药用真菌,以酵母浸粉、谷朊粉、花生蛋白粉、玉米蛋白粉、黄豆蛋白粉作为有机氮源,在固态条件下发酵获得山药-食药用真菌菌质。实验以上述基质适应性因子为检测指标,通过加权评分法对各检测指标加权,综合评价蛋白粉对山药-食药用真菌“双向发酵”适应性的影响,以确定各种山药-食药用真菌发酵体系中合适的有机氮源,为提高山药-食药用真菌发酵体系适应性提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料和菌种
马铃薯(产地:河南濮阳)、山药(产地:河南焦作):南阳市佳乐福超市;酵母浸粉(蛋白质含量>60%):北京奥星生物技术公司;玉米蛋白粉(蛋白质含量>70%)、谷朊粉(蛋白质含量>75%):河南万邦实业有限公司;花生蛋白粉(蛋白质含量>60%)、黄豆蛋白粉(蛋白质含量>60%):亳州华圣生物科技有限公司。
灵芝(Ganoderma lucidium)14025、蛹虫草(Cordyceps militaris)14013、银耳(Tremellafuciformis)50179、香菇(Lentinula sp.)14035:中国工业微生物菌种保藏管理中心。
1.1.2 化学试剂
葡萄糖、水杨酸、无水乙醇、硫酸亚铁、过氧化氢、磷酸二氢钾、硫酸镁、三羟甲基氨基甲烷、盐酸、连苯三酚(均为分析纯):天津市科密欧化学试剂有限公司;维生素B1(生化试剂):北京酷来搏科技有限公司;琼脂粉(生化试剂):北京奥博星生物技术有限责任公司;DPPH(分析纯):合肥博美生物科技有限责任公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextroseagar,PDA)培养基:去皮马铃薯200 g,切成小块,加水1.0 L煮沸30min,滤去马铃薯块,将滤液补足至1.0 L。葡萄糖20.0 g,KH2PO43.0 g,MgSO4·7H2O 1.5g,维生素B1微量,琼脂15.0g,pH 6.0。121℃灭菌20min。
菌质固态发酵培养基:将山药洗净、切碎成2~3mm左右的颗粒、自然晾干(含水量约10%)。在每个培养瓶中分装干山药23 g、实验所选用的蛋白粉(酵母浸粉、玉米蛋白粉、谷朊粉、花生蛋白粉及黄豆蛋白粉)2 g、蒸馏水38m L,拌匀,浸润2 h,得到山药基质。将装有山药基质的培养瓶置于121℃灭菌30min。
1.2 仪器与设备
PHS-3C精密酸度计:上海仪电科学仪器股份有限公司;TDL-40C低速台式大容量离心机、TG16-WS台式高速离心机:湖南湘仪离心机仪器有限公司;TU-1901双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;0107超声波细胞破碎机:上海冠森生物科技有限公司;FreeZoneRTriadTM2.5 L真空冷冻干燥机:美国LABCONCO有限公司;LRHS-300-Ⅱ恒温恒湿培养箱:上海跃进医疗器械有限公司;LDZX-30FB立式灭菌器:上海申安医疗器械有限公司。
1.3 方法
1.3.1 固体平板菌种制备
挑取灵芝、蛹虫草、香菇、银耳的斜面菌种一块分别接种至PDA培养基平板上,在温度25℃、相对湿度75%条件下培养10 d,备用。
1.3.2 山药-食药用真菌菌质的发酵方法
将1.3.1中所得固体平板菌种切成约0.8 cm的菌块,每个培养瓶接8块。将接种好的山药培养基放入温度25℃、相对湿度75%的恒温恒湿培养箱中,培养时间最长为20 d。以不加蛋白粉的纯山药作为空白对照。实验重复3次。
1.3.3 菌质干燥
将发酵结束后的菌质转移至9 cm培养皿中,铺成1 cm的料层,置于-20℃冰箱中预冻2 h,再置于-80℃冰箱中预冻12 h。将预冻后的菌质置于真空冷冻干燥机中,分阶段干燥。第一阶段:设置隔板温度-15℃,真空度30 kPa,维持5h;第二阶段:设置隔板温度-5℃,真空度30 kPa,维持5 h;第三阶段:设置隔板温度20℃,真空度8 kPa,维持20 h。
1.3.4 检测方法
(1)菌丝布满时间
以各食药用真菌菌丝在纯山药培养基上的布满天数为对照,当灵芝菌丝、蛹虫草菌丝、香菇菌丝、银耳菌丝在含蛋白粉的山药培养基上蔓延生长至布满培养基时(见图1),记录培养具体天数,记为该食药用菌在培养基质上的布满天数。菌丝在含蛋白粉的山药培养基上的布满天数与在纯山药培养基上的布满天数的差异能够反映蛋白粉对该山药-食药用真菌发酵体系耗时性的影响。

图1 菌丝布满培养基质的现象(a-侧面,b-表面,c-底部)Fig.1 Phenomenon of hypha bestrewing medium(a-side,b-surface,c-bottom)
(2)折干率和消耗率
折干率反映了发酵后菌质的含水量。折干率越低,菌质的含水量越高,菌质中固相成分占比越少。基质消耗率反映了菌种对山药基质的消耗情况,消耗率越高,说明基质被菌种分解代谢的越多。按1.3.3所述方法将菌质干燥后,采用邬吉野[19]的方法测定折干率和消耗率,其计算公式如下:

(3)抗氧化活性测定
按1.3.3所述方法将菌质干燥后,用研钵将干燥后的菌质研成粉末状。用无水乙醇按固液比1∶5(g∶m L),在超声功率120W、温度30℃条件下超声浸提60min,将浸提混合物在4 000 r/m in条件下离心30m in,倾倒上清液,重复浸提一次,合并上清液,备用。参考文献[20-22]测定羟基自由基(·OH)、DPPH自由基(DPPH·)及超氧阴离子自由基(O2-·)清除率。
1.3.5 数据处理和分析
(1)加权评分方法
采用加权评分法对检测指标加权,综合评价不同蛋白粉对山药-食药用真菌双向发酵适应性的影响。根据前期研究结果,将各指标的主成分载荷绝对值(α折干率=0.503 9,α消耗率=0.491 0,αO2-·=0.483 0,αDPPH·=0.368 3,α·OH=0.365 8)所占比例转化作为各指标加权评分的权值,即折干率权值为w1=22,消耗率权值w2=22,O2-·清除率权值w3=22,DPPH·清除率权值w4=17,·OH清除率权值w3=17,对各指标按式(3)做归一化处理。按式(4)计算加权评分[23-24]。

式中:yjmax为第j个指标的最大观测值;yimin为第j个指标的最小观测值;yij为第j个指标的i个实验处理的观测值;zij为第j个指标的第i个实验处理的归一化值;wj为第j个指标的权值;Pi为第i个实验处理的加权评分值。
(2)统计分析
利用SPSS 22.0处理实验数据,采用Turkey HSD法对添加蛋白粉与空白各蛋白粉之间进行差异显著性分析(显著水平取0.05)。
2 结果与分析
2.1 菌丝布满时间
山药-食药用真菌“双向发酵”耗时以菌丝布满山药基质的天数来表示(按1.3.4(1)判断)。不同氮源对山药-食药用真菌菌质发酵中菌丝长满培养瓶时间的影响结果见图2。
图2 氮源对菌丝生长速率的影响Fig.2 Effect of nitrogen sources on hypha grow th rate
由图2可知,本研究所考察的四种食药用真菌,每种真菌在含有不同氮源的山药基质以及纯山药基质上生长时,菌丝布满整个培养瓶的所需时间差异均不显著(P>0.05)。即在实验所考察的用量下,不同氮源对山药-食药用真菌固态发酵的布满时间无影响。这可能是由于氮源不能影响菌丝在培养基质表面的蔓延生长速度。
2.2 折干率和消耗率
2.2.1 折干率
不同氮源对山药-食药用真菌“双向发酵”中菌质折干率的影响如图3所示。
基质中的营养物质被分解后一部分用于合成菌体和次生代谢产物,一部分用于产生能量、水和CO2[25]。如果发酵后基质的干物质含量偏低,说明基质形成菌体的转化率较低。各山药-食药用真菌体系发酵后的折干率(即干物质含量)见图3。由图3可知,氮源对各种山药-食药用真菌菌质折干率的影响差异均不显著(P>0.05)。以山药-灵芝体系为例,空白组菌质的折干率为(37.49±0.96)%,添加不同氮源后,山药-灵芝菌质的最大折干率为(38.37±1.16)%(酵母浸粉),最小折干率为(36.28±0.94)%(玉米蛋白粉),菌质含水量变化不显著(P灵芝=0.114>0.05),说明不同氮源对食药用真菌转化山药基质形成菌体的转化率影响不大,这可能是由于有机氮源结构复杂,菌丝还是主要利用山药基质中的小分子氮源生长,因此添加了不同氮源的同一体系内,菌体对基质的转化率是相近的,表现为折干率差异不显著(P>0.05)。

图3 氮源对菌质折干率的影响Fig.3 Effect of nitrogen sources on mycoplasm dry matter content
2.2.2 消耗率
不同氮源对山药-食药用真菌“双向发酵”中基质消耗率的影响如图4所示。

图4 氮源对基质消耗率的影响Fig.4 Effect of nitrogen sources on substrate consum ing rate
由图4可知,不同氮源对各山药-食药用真菌基质消耗率影响均显著(P<0.01)。添加黄豆蛋白粉使山药-香菇的基质消耗率显著降低(P香菇=0.000<0.05);添加玉米蛋白粉使山药-银耳体系的基质消耗率显著提高(P银耳=0.007<0.05),山药-香菇体系的基质消耗率显著降低(P香菇=0.000<0.05);添加谷朊粉使山药-灵芝和山药-蛹虫草体系的基质消耗率显著降低(P灵芝=0.004<0.05,P蛹虫草=0.000<0.05);添加花生蛋白粉使山药-银耳和山药-香菇体系的基质消耗率显著降低(P银耳=0.008<0.05,P香菇=0.000<0.05);添加酵母浸粉山药-灵芝、山药-银耳和山药-香菇(P灵芝=0.000<0.05,P银耳=0.005<0.05,P香菇=0.000<0.05)体系的基质消耗率显著降低。当某一氮源的添加提高了山药-食药用真菌发酵体系的基质消耗率时,说明该氮源能促进菌丝对山药基质的分解,当其添加降低了发酵体系的基质消耗率时,可能是由于蛋白粉中含有抑制菌体产生胞外酶类分解基质的物质,或者是该氮源附着于山药基质表面,影响了菌丝对基质的分解利用。
2.3 抗氧化活性
2.3.1 超氧阴离子清除率
不同氮源对山药-食药用真菌菌质超氧阴离子清除率的影响如图5所示。
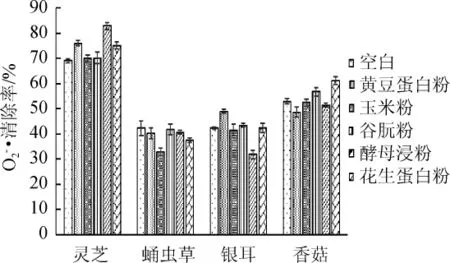
图5 氮源对菌质提取物超氧阴离子自由基清除率的影响Fig.5 Effect of nitrogen sources on superoxide anion free radical scavenging rate ofmycoplasm extract
由图5可知,不同氮源对山药-食药用真菌菌质超氧阴离子清除率影响显著(P灵芝=0.000<0.01,P蛹虫草=0.000<0.01,P银耳=0.000<0.01,P香菇=0.000<0.01)。添加黄豆蛋白粉使山药-灵芝和山药-银耳体系的超氧阴离子清除率显著提高(P灵芝=0.001<0.05,P银耳=0.001<0.05),使山药-香菇(P香菇=0.038<0.05)体系的超氧阴离子清除率显著降低;添加玉米蛋白粉使山药-蛹虫草体系的超氧阴离子清除率显著降低(P蛹虫草=0.000<0.05);添加谷朊粉对各体系的超氧阴离子清除率均无显著影响(P>0.05);添加酵母浸粉使山药-灵芝的超氧阴离子清除率显著增加(P灵芝=0.000<0.05),使山药-银耳体系的超氧阴离子清除率显著降低(P银耳=0.005<0.05);添加花生蛋白粉使山药-灵芝和山药-香菇体系的超氧阴离子清除率显著提高(P灵芝=0.003<0.05,P香菇=0.000<0.05)。
2.3.2 DPPH自由基清除率
不同氮源对山药-食药用真菌菌质DPPH·清除率的影响如图6所示。
由图6可知,蛋白粉对山药-食药用真菌菌质DPPH·清除率影响显著(P灵芝=0.000<0.01,P蛹虫草=0.000<0.01,P银耳=0.000<0.01,P香菇=0.000<0.01)。添加黄豆蛋白粉使山药-蛹虫草和山药-银耳体系的DPPH·清除率显著降低(P蛹虫草=0.000<0.05,P银耳=0.001<0.05);加玉米蛋白粉使山药-蛹虫草、山药-银耳和山药-香菇体系的DPPH·清除率显著降低(P蛹虫草=0.000<0.05,P银耳=0.001<0.05,P香菇=0.033<0.05);添加谷朊粉使山药-灵芝、山药-蛹虫草和山药-银耳体系的DPPH·清除率显著降低(P灵芝=0.000<0.05,P蛹虫草=0.000<0.05,P银耳=0.000<0.05);添加酵母浸粉使山药-灵芝、山药-蛹虫草和山药-香菇体系的DPPH·清除率显著降低(P灵芝=0.000<0.05,P蛹虫草=0.000<0.05,P香菇=0.000<0.05),使山药-银耳(P银耳=0.005<0.05)体系的DPPH·清除率显著降低;添加花生蛋白粉使山药-蛹虫草和山药-香菇体系的DPPH·清除率显著降低(P蛹虫草=0.000<0.05,P香菇=0.000<0.05)。
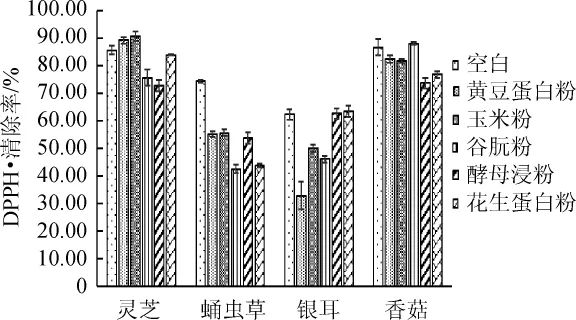
图6 氮源对菌质提取物DPPH自由基清除率的影响Fig.6 Effect of nitrogen sources on DPPH free radicalscavenging rate ofmycoplasm extract
2.3.3 羟自由基清除率
不同氮源对山药-食药用真菌菌质羟自由基清除率的影响如图7所示。

图7 氮源对菌质提取物羟自由基清除率的影响Fig.7 Effect of nitrogen sources on hydroxyl radicalscavenging rate ofmycoplasm extract
由图7可知,不同氮源对山药-食药用真菌菌质羟自由基清除率影响均极显著(P<0.01)。添加黄豆蛋白粉使山药-灵芝、山药-香菇体系的羟自由基清除率显著提高(P灵芝=0.006<0.05,P香菇=0.000<0.05),山药-银耳体系的羟自由基清除率显著降低(P银耳=0.000<0.05);加玉米蛋白粉使山药-灵芝、山药-蛹虫草、山药-银耳和山药-香菇体系的羟自由基清除率均显著提高(P灵芝=0.000<0.05,P蛹虫草=0.001<0.05,P银耳=0.000<0.05,P香菇=0.000<0.05);添加谷朊粉使山药-银耳体系的羟自由基清除率显著降低(P银耳=0.005<0.05),使山药-香菇体系的羟自由基清除率显著提高(P香菇=0.005<0.05);添加酵母浸粉使山药-蛹虫草和山药-银耳体系的羟自由基清除率显著降低(P蛹虫草=0.000<0.05,P银耳=0.000<0.05);添加花生蛋白粉使山药-蛹虫草和药-银耳体系的DPPH自由基清除率显著降低(P蛹虫草=0.002<0.05,P银耳=0.000<0.05)。
添加氮源的山药-食药用真菌体系对各种自由基清除率提高,可能是由于氮源被分解成的短肽产物具有一定的抗氧化活性;对各种自由基清除率降低,可能是由于蛋白粉的添加影响了食药用真菌代谢产生的抗氧化活性物质的产量。同一种氮源在不同的山药-食药用真菌发酵体系中,被真菌的酶类分解后产生的分解产物不同,且菌体吸收不同的氮源分解产物进而代谢产生的产物不同,导致添加不同氮源后山药-食药用真菌菌质的抗氧化活性变化趋势不同。有研究表明,抗氧化活性物质主要通过提供电子或质子来发挥清除自由基的作用[26-27]。食药用真菌在含有不同氮源的山药基质上生长时,对基质成分代谢产物不同,产物的供氢或供电子的能力不同,因此最终表现为氮源对山药-食药用真菌菌质的抗氧化活性的影响产生差异。
2.4 各指标加权综合评分
不同氮源对山药-食药用真菌“双向发酵”适应性的综合评分如表1所示。

表1 “双向发酵”适应性综合评分Table 1 Comprehensive score of'bi-directionalfermentation'adaptability
由表1可知,添加不同氮源对各山药-食药用真菌发酵的适应性影响各不相同。对于山药-灵芝体系,不添加氮源的综合评分为66.87分,添加谷朊粉在一定程度上会降低灵芝对山药基质的适应性(65.15分),而添加其他氮源能在一定程度上提高灵芝对山药的适应性,酵母浸粉对山药-灵芝适应性提高程度最大(提高了11.02分)。对于山药-蛹虫草体系和山药-银耳体系,不添加氮源的综合评分分别为52.92分和55.62分,添加各种蛋白粉均会降低菌体对山药的适应性,最大降低幅度分别为18.81分和16.45分。对于山药-香菇体系,不添加蛋白粉的综合评分为35.13分,添加各种氮源均能提高香菇对山药基质的适应性,玉米蛋白粉对山药-香菇适应性提高程度最大(提高了28.65分)。
氮源对山药-食药用真菌“双向发酵”适应性的影响是多方面的,不仅影响菌体对基质的利用情况,而且影响菌体的代谢产物,进而影响菌质对自由基的清除能力。因此对添加不同氮源的各山药-食药用真菌体系指标进行加权综合评分,能够综合体现氮源对各山药-食药用真菌发酵适应性的影响。
3 结论
在山药-食药用真菌双向发酵过程中添加黄豆蛋白粉、玉米蛋白粉、谷朊粉、酵母浸粉、花生蛋白粉五种氮源,对灵芝、蛹虫草、银耳、香菇四种食药用真菌在山药基质上的适应性影响各不相同。添加氮源对菌丝在山药基质上的耗时没有显著影响(P>0.05),但对菌丝消耗基质以及发酵所得菌质的抗氧化活性(即山药-食药用真菌双向发酵适应性)产生影响。不同氮源对各山药-食药用真菌菌质折干率的影响差异均不显著(P>0.05),对每种山药-食药用真菌基质消耗率影响均显著(P<0.05);对每种山药-食药用真菌菌质的抗氧化活性影响极显著(P<0.01)。根据适应性的综合评分,添加酵母浸粉使山药-灵芝适应性提高了11.02分,提高程度最大;蛹虫草和银耳则因氮源的添加对山药基质的适应性均有降低,最大降低幅度分别为18.81分和16.45分;氮源的添加对山药-香菇适应性均有提高作用,玉米蛋白粉的提高程度最大(提高了28.65分)。根据该实验结果,山药-灵芝发酵体系中可以添加酵母浸粉,而山药-蛹虫草和山药-银耳的体系中不宜添加这五种氮源,山药-香菇发酵体系中可添加玉米蛋白粉。该结论对山药-食药用真菌菌质抗氧化食品的研发具有一定的指导意义。
