不同培养基对黑曲霉菌丝生长影响的研究
2019-08-30赵成萍上官李娜张沛然宋艳波
赵成萍,上官李娜,张沛然,宋艳波*
(山西农业大学 生命科学学院,山西 晋中 030801)
黑曲霉(Aspergillusniger)属于真核生物子囊菌亚门丝孢目丛梗孢科,是一种常见的曲霉属真菌[1-2]。黑曲霉作为发酵微生物,在酶制剂生产、有机酸发酵及污水处理等方面具有广泛用途。黑曲霉具有高效的蛋白表达和修饰能力,在酶制剂工业上用来生产蛋白酶、纤维素酶、糖化酶和脂肪酶等多种酶类[3]。KANG X等[4]研究表明,黑曲霉通过生物质自然真菌培养系统,可使土壤和污水中的稀土元素达到生物转化和生物恢复的目的。菌丝球是丝状真菌培养过程中形成的松散且不规则、致密或光滑的球形、近球形微生物颗粒,其内部结构各不相同[5]。菌丝球按形态可分为松散型、紧密型和空心菌丝球,目前菌丝球的形成机理已有大量研究[6-8]。在菌丝球形成的过程中,大多数丝状真菌以凝集型和非凝集型两种方式形成菌丝球,黑曲霉以凝集型方式形成菌丝球的过程中,培养初期孢子通过聚集形成孢子团,孢子团萌发的菌丝进一步交织缠绕形成菌丝球[9]黑曲霉在浸没条件发酵可通过悬浮菌丝或菌丝球存在[10],丝状体菌丝在发酵过程中会使培养基黏度增加,显著降低营养运输和生产效率[11-13]。因此,菌丝球的形成可降低介质黏度和搅拌能源消耗,提高氧转移效率,是发酵工业中丝状真菌的理想形态[14],菌丝球形成过程中受到碳源、氮源种类及浓度、微量元素、温度、pH值及溶解氧等诸多因素影响[15-16]。雷德柱等[17]研究表明,菌丝在不同培养阶段所需底物不同,菌丝形态结构也发生变化;丁乐洪等[18]通过显微图像技术对产黄青霉的菌丝形态进行了研究,并进一步分析了发酵过程中菌丝形态、菌丝总长度、菌丝生长期等变化规律。BIZUKOJCM等[20]研究表明,孢子接种量对菌丝球形成和大小具有重要影响,培养基中添加表面活性剂(Tween-80、Triton X-100)时,菌丝球直径显著下降。pH对菌丝体成球也具有显著影响,冬虫夏草菌丝体在培养过程中,当pH=6.0时,可形成直径约1.8mm大小均匀、表明光滑的菌丝球[21]。SARASWATHY A等[22]研究发现,青霉菌可利用难降解的芘作为碳源形成菌丝球。本试验以察氏培养基为基础培养基;通过对不同培养基碳源种类(蔗糖、葡萄糖、可溶性淀粉)、pH值、外源添加物(玻璃珠和吐温-80)等培养条件的筛选和优化,研究各因素对黑曲霉菌丝生长的影响,从而确定黑曲霉生长和发酵的最适条件,为后期黑曲霉的广泛应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株
黑曲霉(Aspergillusniger)M 011.9:山西农业大学食品学院实验室。
1.1.2 化学试剂
琼脂(生化试剂):北京索莱宝科技有限公司;硝酸钠、磷酸氢二钾(均为分析纯):天津北辰方正试剂厂;硫酸镁(分析纯):天津天力化学试剂有限公司;氯化钾(分析纯):天津鼎盛鑫科技有限公司;硫酸亚铁(分析纯)、蔗糖(分析纯)、可溶性淀粉(生化试剂)、葡萄糖(分析纯):天津化学试剂三厂。
1.1.3 培养基
察氏培养基:硝酸钠3.0 g,磷酸氢二钾1.0 g,硫酸镁0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,蔗糖30.0 g,加热溶解于1 000m L蒸馏水中,115~116℃高压灭菌30min。
1.2 仪器与设备
LS-75HD高压灭菌锅:江阴滨江医疗设备有限公司;SW-CJ-2G超净工作台:苏州净化设备公司;STARTER3100 pH计:台湾衡欣科技股份有限公司;SHZ-C水浴恒温振荡器:天津泰斯特仪器公司;101-2AB电热鼓风干燥箱:广州博讯仪器设备厂;E100显微镜:日本尼康公司;BSA223S电子天平:德国赛多利斯科学仪器公司;74mm×33mm×5mm血球计数板:南昌科伟仪器设备有限公司。
1.3 试验方法
1.3.1 黑曲霉活化
黑曲霉(Aspergillusniger)M 011.9于5~10℃的环境解冻,体积分数为75%酒精洗脱棉擦净,用无菌吸管吸取0.1m L菌体悬浮液,注入制定的察氏液体培养基内3~4m L,然后在37℃培养。
1.3.2 孢子悬液制备
超净台中用无菌水冲洗活化的黑曲霉菌的固体平板,并用涂布器轻刮表面使菌体充分洗脱,洗脱液倒于无菌三角瓶中高温灭活处理;用无菌的三层纱布(121℃灭菌20min)过滤菌液,移液器充分吹打使孢子呈均匀分散状态,得到孢子悬液,血球板计数孢子数。
1.3.3 培养基碳源的筛选
察氏培养基中分别加入浓度均为1mol/L蔗糖、可溶性淀粉、葡萄糖各10m L,混匀,分设平行试验组(n=3);高温灭菌后(121℃灭菌20min),斜面接种法接种孢子悬液100μL,28 ℃、120 r/min摇床培养,每12 h,10倍目镜40倍物镜下观察并记录生长状况。
1.3.4 培养基pH值的选择
用HCl和NaOH标准液分别调节察氏培养基的pH值为3.0、8.0、10.0,设平行试验组(n=8);高温灭菌后接种孢子悬液,28℃、120 r/min摇床培养,每12h观察并记录生长状况。
1.3.5 培养基外源添加物的筛选
分别将玻璃珠和Tween-80加入察氏培养基,以无任何添加察氏培养基为空白对照,设平行试验组(n=3);高温灭菌后接种孢子悬液,培养,每12 h观察并记录生长状况。
1.3.6 菌株生长状况分析
在培养0~48h期间,每隔12h,分别取按1.3.3~1.3.5节培养的黑曲霉培养液,吹打混匀,无菌条件下吸取0.3mL含有孢子的液体滴于载玻片上,10倍目镜、40倍物镜下观察并采集图像;48 h菌丝肉眼可见,无菌条件下接种环轻挑菌丝球于载玻片上,40倍镜下观察并采集图像。每组随机挑取10个菌丝球,平铺成直线后滤纸轻吸水分,直尺测量长度。每组随机挑取10个菌丝球,滤纸轻吸水分后置于60℃烘箱烘干至恒质量,记录数据。
1.3.7 数据统计与分析
每个实验重复3次,以平均值±标准差表示实验数据。采用SPSSV18.0对各指标进行方差分析,差异显著性以P<0.05水平表示。
2 结果与分析
2.1 不同碳源培养基菌丝生长状况
不同蔗糖、葡萄糖、可溶性淀粉察氏培养基,分别在接种孢子悬液后0、12 h、24 h、36 h、48 h、60 h于40倍物镜下观察菌丝生长状况,结果见图1~图3。由图1可知,以蔗糖为碳源时,培养时间<12 h无显著变化(图1a);培养12~24 h孢子萌发,培养24 h时菌丝伸长(图1b~c);培养36 h时菌丝继续伸长,产生新生分支,且开始缠绕(图1d);培养48 h时菌丝分支增多,生长旺盛,生长量增大(图1e);培养60 h形成菌丝球,外表不光滑(图1f)。由图2可知,以葡萄糖为碳源时,培养时间<12 h无显著变化(图2a),培养12~24h孢子萌发,培养24h时菌丝伸长(图2b~c),但萌发速度较以蔗糖为碳源时慢;36h菌丝缠绕,产生分支较少(图2d);培养48 h菌丝生长量增大(图2e),但比以碳源为蔗糖时的菌丝量要大;60 h形成菌丝球,球径较大,外表光滑(图2f)。由图3可知,以可溶性淀粉为碳源时,培养时间<12 h无显著变化(图3a),培养12~24h孢子萌发,培养24h时菌丝伸长(图3b~c),菌丝相比以蔗糖和葡萄糖为碳源时要粗大;培养36 h菌丝产生分支(图3d);培养48 h菌丝缠绕,生长旺盛(图3e);培养60 h菌丝未成球,依然为分散的丝状(图3f)。

图1 蔗糖为碳源察氏培养基中菌丝的生长状况Fig.1 Mycelium grow th situation in Czapek'sm edia with sucrose as carbon source
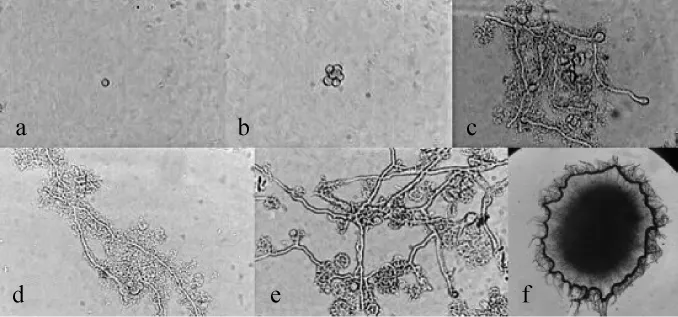
图2 葡萄糖为碳源察氏培养基中菌丝的生长状况Fig.2 Mycelium grow th situation in Czapek's media with glucose as carbon source

图3 可溶性淀粉为碳源察氏培养基中菌丝的生长状况Fig.3 Mycelium grow th situation in Czapek'smedia with soluble starch as carbon source
取上述不同碳源察氏培养基培养60 h的菌丝球,测定菌丝球的干质量和直径,结果见表1。由表1可知,蔗糖和葡萄糖碳源组菌丝球干质量和直径分别为0.018 g、0.147 cm和0.023 g、0.155 cm,二者无显著差异(P>0.05),且均显著高于可溶性淀粉组(P<0.05)。
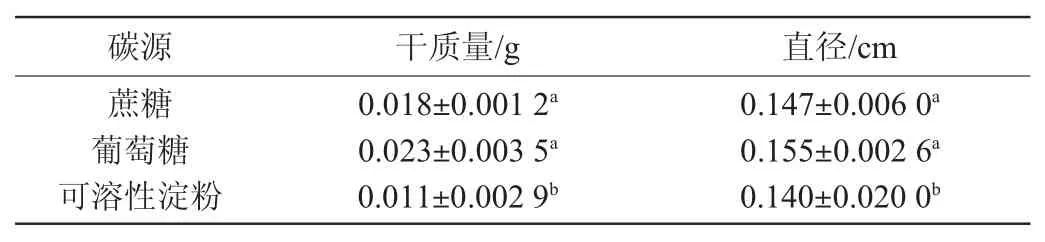
表1 60 h不同碳源察氏培养基中菌丝球的干质量和直径Table 1 Drymass and diameter ofmycelium pellets in Czapek's media with different carbon sources for 60 h
综上所述,黑曲霉在不同碳源的察氏培养基上培养时菌丝生长状况存在着一定差异。例如以蔗糖为碳源的菌丝在相同时间,生长量较大、但菌丝球形态不如以葡萄糖为碳源的菌丝,而以可溶性淀粉为碳源的菌丝相同时间生长量较小、粗壮但未形成球状。因此,葡萄糖为黑曲霉菌丝的生长的最适宜碳源。
2.2 不同pH培养基菌丝生长状况
在察氏培养基以葡萄糖为碳源,调整培养基初始pH值至3.0、8.0、10.0,接种孢子悬液后不同时间镜检观察菌丝生长状况,结果见图4~图6。由图4可知,培养基pH值为3.0时,培养时间<12 h无明显变化(图4a),培养12~24 h孢子萌发(图4b~c),36 h菌丝继续生长,并未形成分支(图4d),48 h菌丝生长旺盛,交叉缠绕,生长量增大(图4e);60 h形成菌丝球,外表光滑,直径较大(图4f)。由图5可知,pH值为8.0时,培养时间<12 h无明显变化(图5a),培养12~24 h孢子萌发(图5b~c),36 h菌丝继续生长,开始缠绕(图5d);48 h菌丝生长状况较pH值为3.0条件下旺盛(图5e);60 h菌丝未形成菌丝球,而是丝状形态(图5f)。由图6可知,pH值为10.0时,培养时间<12 h无明显变化(图6a),培养12~24 h孢子萌发,变形(图6b~c),36 h菌丝生长,产生新生分支(图6d);48 h菌丝生长旺盛,交织成网状(图6e);60 h依然为丝状,较pH值为8.0条件下形成的丝状菌团小(图6f)。

图4 pH值为3.0察氏培养基中菌丝的生长状况Fig.4 Mycelium grow th situation in Czapek'smedia with pH 3.0

图5 pH值为8.0察氏培养基中菌丝的生长状况Fig.5 Mycelium grow th situation in Czapek'smedia with pH 8.0

图6 pH值为10.0察氏培养基中菌丝的生长状况Fig.6 Mycelium grow th situation in Czapek's media with pH 10.0
取上述不同pH值察氏培养基下培养60 h的菌丝球,测定菌丝球的干质量和直径,结果见表2。由表2可知,培养基pH值为8.0时,菌丝球干质量和直径均最大,分别为0.018 g、0.147 cm,且均显著高于其他两组(P<0.05);培养基pH值为10.0时,菌丝球干质量和直径均最小。

表2 不同pH察氏培养基中菌丝球的干质量与直径Table 2 Dry mass and diameter ofmycelium pellets in Czapek's media with different pH
综上所述,黑曲霉在不同pH值察氏培养基上培养时菌丝生长状况存在着一定差异,在不同pH培养基条件下均可形成菌丝球,在pH值为8.0时形成的菌丝球直径较大,且比较均匀;在pH值为3.0和10.0时多形成絮状菌丝,菌丝生长状态最好。因此,黑曲霉菌丝生长的最适培养基pH值为8.0。
2.3 培养基不同添加物对菌丝生长的影响
添加物选用玻璃珠和吐温-80是由于其外表光滑不影响黑曲霉菌丝的生长,还可以改善菌丝球均匀程度和紧密程度。察氏培养基添加葡萄糖为碳源,培养基初始pH值为8.0,在培养基中添加玻璃珠和Tween-80后不同时间镜检观察菌丝生长状况,结果分别见图7和图8。由图7可知,培养基添加玻璃珠时,培养时间<12 h之前无显著变化(图7a),培养12~24 h孢子开始萌发(图7b~c);36 h菌丝产生分支并缠绕在一起(图7d);48 h菌丝生长旺盛(图7e);60 h形成菌丝球,外表不光滑,内部松散(图7f)。由图8可知,培养基添加Tween-80的条件下,培养时间<12 h之前无显著变化(图8a),培养12~24 h菌丝开始萌发(图8b~c),但萌发速度较添加玻璃珠时要慢;36 h菌丝继续生长,未产生分支,且菌丝较粗大(图8d);48 h菌丝缠绕(图8e),60 h形成菌丝球,外表光滑,内部紧实(图8f)。
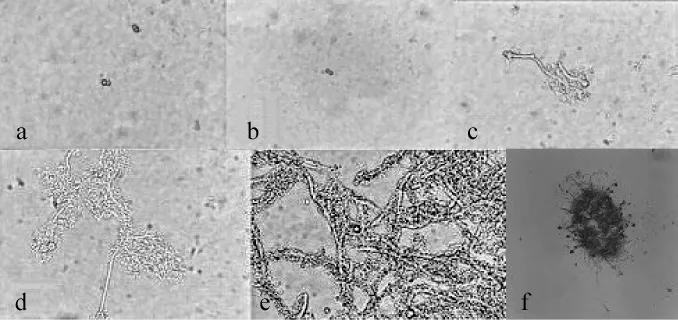
图7 添加玻璃珠察氏培养基中菌丝的生长状况Fig.7 Mycelium grow th situation in Czapek's media with glass beads as additive
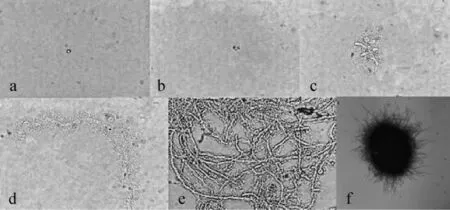
图8 添加Tween-80察氏培养基中菌丝的生长状况Fig.8 Mycelium grow th situation in Czapek's media with Tween-80 as additive
取上述培养基中添加玻璃珠和Tween-80后培养60 h的菌丝球测定干质量和直径,结果见表3。由表3可知,培养基添加玻璃珠和Tween-80后,菌丝球干质量和直径均显著低于对照组(P<0.05);培养基添加玻璃珠后,菌丝球干质量和直径与Tween-80组均不存在显著差异(P>0.05),但干质量和直径均低于Tween-80组。

表3 不同添加物察氏培养基中菌丝球的干质量与直径Table 3 Dry mass and diameter ofmycelium pellets in Czapek's media with different additives
综上所述,黑曲霉在外源添加物培养时菌丝生长状况存在着一定差异,表明培养基中不同添加物和剂量可显著促进菌丝生物量的提高和次生代谢产物的合成。加入玻璃珠和Tween-80后,菌丝球生长趋势和生长状况基本一致,与对照组相比,孢子萌发速度减慢。因此,黑曲霉菌丝生长的最适外源添加物为吐温-80。
3 讨论
在传统酶制剂发酵和新酶生产方面,黑曲霉在众多微生物表达系统中具有明显优势,广泛应用于发酵工业和污水处理企业。黑曲霉表达系统具有较强的蛋白合成后加工能力,具备好氧微生物生存力强、生长迅速、代谢旺盛等特点;同时,黑曲霉菌丝发达,分枝较多,通过孢子生殖方式使分生孢子梗从膨大的菌丝上生出,确保其在不同条件下快速增殖,并分泌表达多种蛋白[14]。黑曲霉在浸没条件发酵可通过悬浮菌丝或菌丝球存在[15]。研究表明,丝状体菌丝在发酵过程中会使培养基黏度增加,显著降低营养运输和生产效率[16-18]。因此,菌丝球的形成可降低介质黏度和搅拌能源消耗,提高氧转移效率,是发酵工业中丝状真菌的理想形态[19]。
4 结论
通过选择在察氏培养基不同pH、不同碳源和不同外援添加物的培养条件下,观察黑曲霉菌丝生长状况,并测定菌丝球干质量和直径,确定黑曲霉菌丝最适生长条件为:在发酵温度为28℃,孢子浓度为4.7×106个/m L,摇床转速为120 r/min条件下,黑曲霉菌丝生长的察氏培养基中最佳碳源为葡萄糖,最适pH值为8.0,最佳外源添加物为吐温-80,在此状态下形成的菌丝分枝较多,菌丝生物量大。目前对黑曲霉菌丝不成球的影响机理研究较少,随着研究技术的改进和发酵工业的发展,利用计算机及显微图像分析技术对丝状真菌的生长状况进行定量分析和检测,必将为黑曲霉发酵工业的深入研究和广泛应用提供技术支持。
