尼莫地平对蛛网膜下腔出血大鼠海马CA1区自噬的影响
2019-08-28焦继超马玉德李小亮付爱军孙林林
焦继超 马玉德 李小亮 付爱军 孙林林
蛛网膜下腔出血(SAH)是临床常见的一种严重的急性脑血管疾病,指脑表面或脑组织内血管破裂,血液及其成分流入蛛网膜下腔,多发生于颅内动脉瘤、外伤、药物或其他原因[1-2]。SAH后的早期脑损伤影响着患者预后和神经功能变化。最近研究发现,神经细胞自噬可能发生于早期脑损伤且起到一定的改善作用[3-4]。自噬是自身对受损的细胞蛋白和细胞器进行降解的过程,适度的自噬对维持细胞内微环境的稳定和细胞再生起着重要作用。自噬的表达相关蛋白Beclin-1和微管相关蛋白1轻链3Ⅱ (microtubule-associated protein 1 light chain 3Ⅱ,LC3-Ⅱ)经常被标记自噬的水平,3-甲基腺嘌呤(3-methyladenine,3-MA)常作为自噬研究的特异性抑制剂。尼莫地平是一种二羟吡啶类钙离子通道阻滞剂,是临床常见的一种对SAH有治疗作用的药物,可改变细胞通透性,影响神经细胞凋亡等病理生理改变[5],然而,SAH中尼莫地平对海马CA1区神经细胞自噬影响的报道较少。本研究通过颈内动脉刺破法制备SAH模型,探讨尼莫地平对SAH大鼠海马CA1区自噬的影响,为SAH的临床救治提供理论基础。
1 材料与方法
1.1 动物与分组
成年雄性清洁级Sprague-Dawley大鼠48只,体质量:360±5 g,购于解放军军事医学院卫生学环境医学研究所的动物实验研究中心[动物合格证号:SCXK-(军)2014-0001]。饲养条件:温湿度适宜,自由摄食饮水。对大鼠编码后按随机数字表法分为Sham组、SAH组、SAH+尼莫地平组(NMDP组)、SAH+尼莫地平+3-MA(3-MA组),每组各12只。本研究方案经本院实验动物伦理委员会批准。
1.2 试剂与仪器
尼莫地平注射液:德国Bayer Pharma AG 。免疫组化二抗:北京中杉金桥生物技术有限公司。自噬相关蛋白Beclin-1、LC3一抗:北京博奥森生物技术有限公司。3-MA:美国Sigma公司。苏木素-伊红(HE):南京荣春生物科技有限公司。大鼠抓力测定仪器:北京冀诺泰科技发展有限公司。RM2245半自动轮转式切片机、手术显微镜:德国LEICA公司。DYY-7C型电泳仪电源、电转仪电源:北京市六一仪器厂。凝胶成像系统:美国Bio-Rad 公司。
1.3 SAH模型制作
采用颈内动脉刺破法[6-7]制备SAH模型。大鼠称体质量,10%水合氯醛 (4.0 ml/kg)腹腔注射麻醉,大鼠于鼠板仰卧位固定,颈前区备皮,颈前区纵行切口,分离颈总、颈内、颈外动脉和枕动脉等血管,分离结扎枕动脉并离断,分离结扎颈外动脉并离断,牵拉离断的颈外动脉近心端使其与颈内动脉呈一条直线,纤芯从颈外动脉刺入,进入约18 mm后感阻力,此为颈内动脉颅内段(取材时可看到刺破口),刺破血管,停留15 s后拔出线栓并结扎颈外动脉,逐层缝合,消毒并无菌辅料包扎。保温复苏后送动物饲养房继续饲养。造模成功的衡量标准:(1)血管刺破感明显;(2)血管刺破后短暂的瞳孔散大;(3)剥离脑组织时肉眼可见明显的血液散布在脑底、环池等部位。
Sham组:只进行血管分离并不刺破血管。NMDP组:造模成功后30 min 腹腔注射尼莫地平(0.2 mg/kg)。3-MA组:于造模前1 h腹腔注射3-MA(10 mg/kg),且造模成功后30 min腹腔注射尼莫地平(0.2 mg/kg)。Sham组与SAH组给予腹腔注射等量等渗盐水。模型制作过程中无大鼠死亡。
1.4 穿梭箱试验
ZH-CSC系统(安徽正华生物仪器设备有限公司)记录并分析动物的动物行为学能力,随机选取各组大鼠6只于干预后24 h放置于穿梭箱中,先给予5 s声光刺激培养条件反射,随后给予20 s交流电刺激,间隔10 s后进入下一轮训练。训练中大鼠逃离危险区至安全区的次数记录为躲避反应次数;大鼠逃离危险区至安全区的时间记录为躲避反应时间。躲避反应次数越多,躲避反应时间越少表明动物学习能力越强。
1.5 HE染色
在大鼠穿梭箱实验后,每只大鼠给予10%水合氯醛4.0 ml/kg麻醉,麻醉成功后仰卧位固定,剪开胸廓,经左心室依次给予0.9%等渗盐水500 ml及4%多聚甲醛200 ml灌注,断头取脑,4%多聚甲醛浸泡固定,切取带有海马CA1区脑组织,常规进行石蜡包埋,以5 μm厚度冠状位切片。进行脱蜡、水化、HE染色、封片等实验步骤。400倍光镜下观察海马CA1区神经细胞,随机选取6个视野拍照,Image-Pro Plus 6.0软件 (美国,Media Cybernetics公司)分析图片,记录正常形态神经细胞并计算均值。
1.6 免疫组化
石蜡切片的制作过程同HE染色。各组随机选取6张大鼠石蜡切片进行免疫组化染色:常规脱蜡水化,柠檬酸钠溶液修复80 s,过氧化氢去离子水室温孵育8 min,滴加兔抗体(LC3 1∶100,Beclin-1 1∶100),置湿盒4 ℃过夜,磷酸盐缓冲溶液冲洗,滴加组化羊抗兔二抗,恒温箱孵育30 min。二氨基联苯胺显色,脱水透明,中性树胶封片,400倍光镜下观察海马CA1区神经细胞并采集视野。Image-Pro Plus 6.0分析图片,记录阳性神经细胞并计算均值,结果半定量分析。
1.7 Western blotting实验
每组剩余6只大鼠给予10%水合氯醛4.0 ml/kg麻醉,断头取脑,在冰上用神经剥离子剥离出海马,沿海马远端1/3切取海马CA1区脑组织,放置于EP管中剪碎,加入RIPA裂解缓冲液,加入苯甲基磺酰氟及磷酸酶抑制剂,匀浆,离心(12 000 r/min,离心半径10 cm,4 ℃,2 min),提取海马CA1区组织蛋白,牛血清白蛋白为标准测定蛋白浓度,聚丙烯酰胺凝胶电泳,聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF) 转膜,于PVDF上滴加Beclin-1一抗(1∶1 000)、LC3-Ⅱ一抗(1∶1 000) 4 ℃过夜,TBST缓冲液(含Tris-Hcl、NaCl、Tween20)洗膜3次,每次15 min,羊抗兔IgG(1∶5 000)室温孵育1 h,TBST洗膜3次,每次15 min,滴加电化学发光液,化学发光显影保存条带,Image J 软件分析目的条带灰度值。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)和LC3-Ⅰ为内参对照。阳性条带与内参的灰度值比值为相对表达量。
1.8 统计学分析
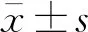
2 结果
2.1 穿梭箱实验
与Sham组比较,SAH组大鼠学习能力较差,躲避反应次数减少,躲避反应时间增多(均P<0.05)。与SAH组比较,NMDP组大鼠躲避反应次数增多,躲避反应时间减少(均P<0.05),而3-MA组差异躲避反应次数及时间差异无统计学意义(均P>0.05)。见表1。
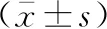
表1 各组大鼠干预后24 h穿梭箱实验结果比较
注:Sham组为假手术组,只进行血管分离并不刺破血管;SAH组为蛛网膜下腔出血模型组;NMDP组为SAH+尼莫地平组,造模成功后30 min 腹腔注射尼莫地平(0.2 mg/kg);3-MA组为SAH+尼莫地平+3-甲基腺嘌呤(3-MA)组,于造模前1 h腹腔注射3-MA(10 mg/kg),且造模成功后30 min腹腔注射尼莫地平(0.2 mg/kg);与Sham组比较,aP<0.05;与SAH组比较,bP<0.05,cP>0.05
2.2 HE染色结果
Sham组海马CA1区神经细胞多正常形态,胞质红色均匀,胞核清晰;SAH组海马CA1区神经细胞排列紊乱,细胞核深染,可见核固缩、核碎裂等。见图1。4组大鼠正常形态神经细胞数目比较,差异有统计学意义(F=8.575,P<0.01)。与Sham组比较,SAH组正常的神经细胞数目减少[(72±28)个比(118±27)个,P<0.05];与SAH组比较,NMDP组正常形态神经细胞数目明显增多[(86±20)个,P<0.05],3-MA组正常形态神经细胞数目差异无统计学意义[(74±24)个,P>0.05]。
2.3 免疫组化结果
Beclin-1及LC3-Ⅱ阳性蛋白表现在细胞质中呈浅棕色颗粒,Sham组可见少数细胞质中浅棕色颗粒,SAH组可见多数细胞质中表达棕色颗粒。见图2,3。与Sham组比较,SAH组Beclin-1及LC3-Ⅱ阳性细胞增多(均P<0.05)。NMDP组Beclin-1及LC3-Ⅱ阳性细胞较SAH组增多(均P<0.05),3-MA组Beclin-1及LC3-Ⅱ阳性细胞与SAH组差异无统计学意义(均P>0.05)。见表2。
2.4 Western blotting结果
Sham组中Beclin-1蛋白表达水平均较低,LC3-Ⅱ/LC3-Ⅰ 值较小;与Sham组比较,SAH组Beclin-1蛋白的表达水平升高,LC3-Ⅱ/LC3-Ⅰ值上升(均P<0.05);与SAH组比较,NMDP组Beclin-1蛋白表达水平增高,LC3-Ⅱ/LC3-Ⅰ值上升(均P<0.05),而3-MA组Beclin-1蛋白表达水平和LC3-Ⅱ/LC3-Ⅰ 值差异均无统计学意义(均P>0.05)。见图4,表3。
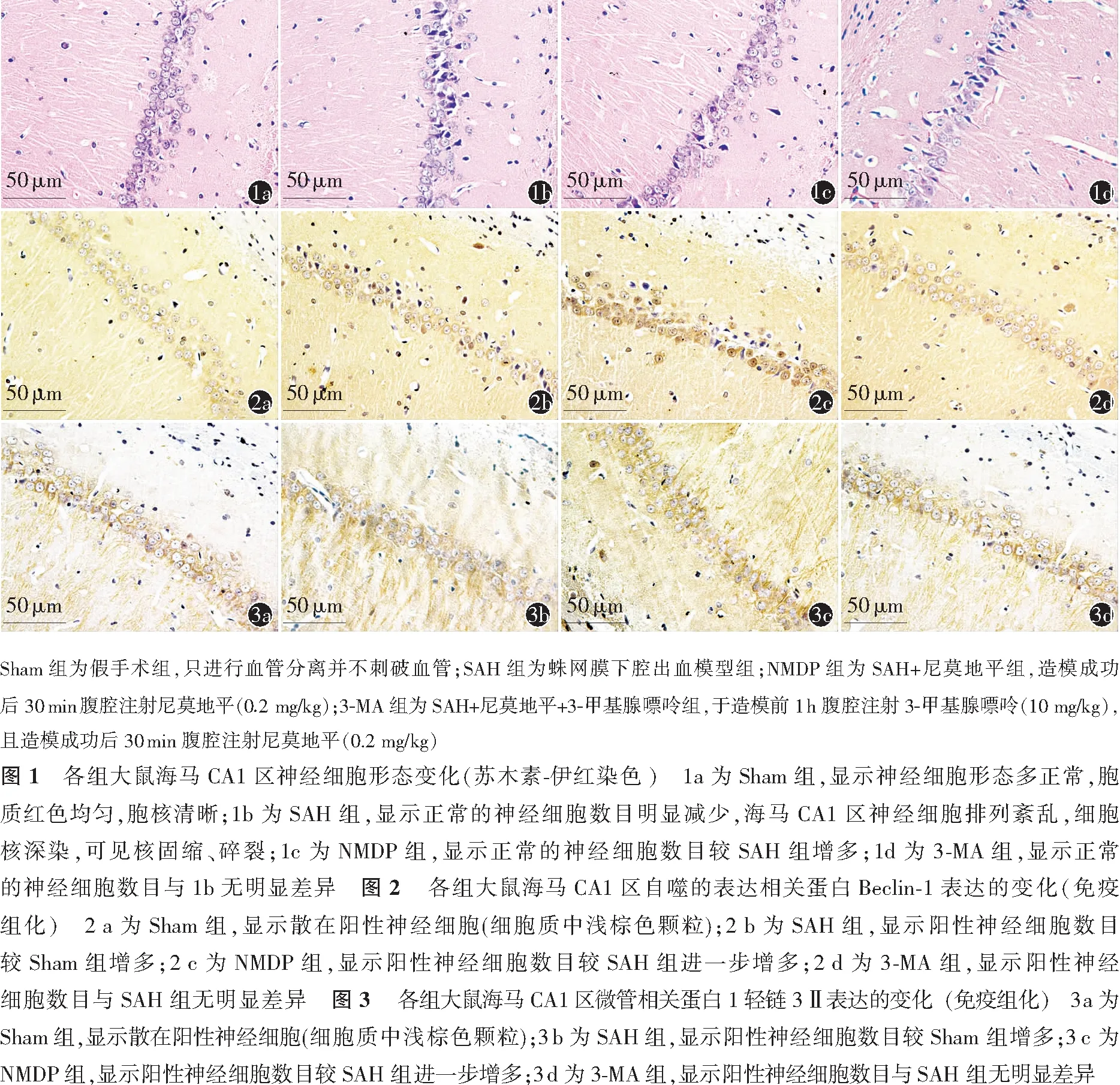
表2 各组大鼠阳性神经细胞数目比较
注:Sham组为假手术组,只进行血管分离并不刺破血管;SAH组为蛛网膜下腔出血模型组;NMDP组为SAH+尼莫地平组,造模成功后30 min 腹腔注射尼莫地平(0.2 mg/kg);3-MA组为SAH+尼莫地平+3-甲基腺嘌呤组,于造模前1 h腹腔注射3-甲基腺嘌呤(10 mg/kg),且造模成功后30 min腹腔注射尼莫地平(0.2 mg/kg);Beclin-1为自噬的表达相关蛋白;LC3-Ⅱ为微管相关蛋白1轻链3 Ⅱ;与Sham组比较,aP<0.05;与SAH组比较,bP<0.05,cP>0.05

表3 各组大鼠Western blotting结果比较
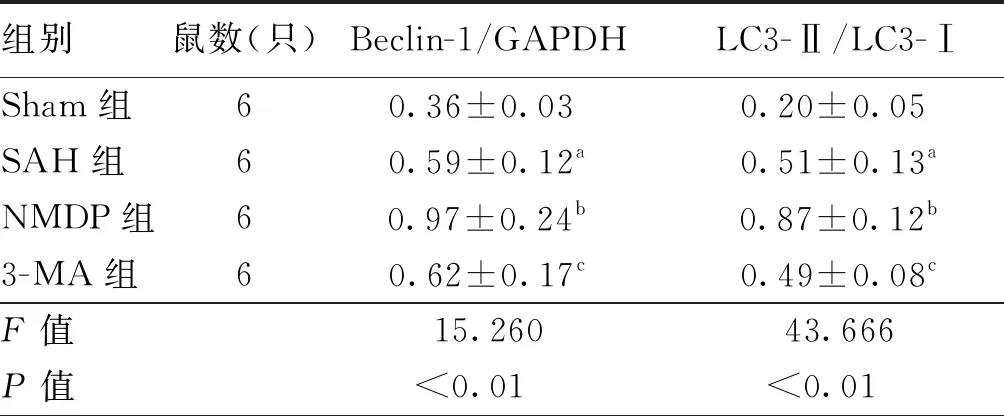
组别鼠数(只)Beclin-1/GAPDHLC3-Ⅱ/LC3-ⅠSham组60.36±0.03a0.20±0.05aSAH组60.59±0.12a0.51±0.13aNMDP组60.97±0.24b0.87±0.12b3-MA组60.62±0.17c0.49±0.08cF值15.26043.666P值<0.0100<0.0100
注:各组别注同图4;Beclin-1为自噬的表达相关蛋白;GAPDH 为甘油醛-3-磷酸脱氢酶;LC3-Ⅱ为微管相关蛋白1轻链3 Ⅱ;LC3-Ⅰ为微管相关蛋白1轻链3 Ⅰ;与Sham组比较,aP<0.05;与SAH组比较,bP<0.05,cP>0.05
3 讨论
尼莫地平是一种经典的钙离子抑制剂,易通过血-脑屏障抑制血管平滑肌收缩,改善血管痉挛及神经细胞的缺血缺氧,从而改善神经细胞损伤[8-9]。研究结果表明,SAH后海马CA1区神经细胞受到损伤,其机制可能是改变了蛛网膜下腔腔隙,导致肌球蛋白与肌动蛋白发生迁移,引起脑组织缺血、缺氧[10-11]。本研究结果表明,SAH后,海马CA1区神经细胞的形态改变,损伤的细胞数目明显增多,大鼠的学习能力减弱,与既往研究报道一致。
适度自噬在真核细胞中是一种保护性机制,其利用溶酶体酶对受损的细胞器和蛋白质进行降解,维持组织及机体的内环境稳定,减弱外界刺激对机体产生损伤[12-13]。Beclin-1是自噬的守护蛋白且是自噬激活的干预靶点,LC3是细胞膜表面参与自噬小体形成的蛋白。自噬过程中,LC3-Ⅰ 经过泛素化在自噬小泡膜表面与磷脂酰乙醇胺结合转变成LC3-Ⅱ[14]。 Beclin-1和LC3-Ⅱ 是自噬研究的标志性蛋白。有研究结果表明,自噬的激活对多种脑损伤发挥保护性作用[7]。Lee等[15]研究结果表明,大鼠SAH模型中自噬水平明显升高,在SAH后24 h自噬达到高峰,且对神经细胞起到了保护性作用。另有研究结果表明,SAH模型中大脑皮质中自噬的表达增加,且自噬激活剂雷帕霉素干预后可进一步增加自噬的表达,早期脑损伤如脑水肿、神经细胞凋亡、血-脑屏障通透性及神经功能等明显改善[16-17]。本研究应用尼莫地平对SAH大鼠进行体内实验观察其影响,结果表明,SAH组海马CA1区自噬水平升高,NMDP组自噬水平较SAH组进一步升高,研究结果与以上研究一致,表明SAH后应用尼莫地平进行干预,自噬被激活,从而改善神经细胞损伤。尼莫地平对自噬的影响可能是通过钙离子相关通路发挥作用,其涉及的具体作用机制有待于更进一步研究。
综上所述,尼莫地平增强了海马CA1区自噬的激活,减少了神经细胞的损伤,改善了大鼠神经功能。
