低剂量伽玛刀照射对癫痫大鼠皮层及海马NMDA受体亚基表达的影响☆
2019-08-22李卫泊尹昱梁传栋吕佩源赵振彪董长征
李卫泊尹昱 梁传栋 吕佩源 赵振彪 董长征
目前认为,兴奋性递质与抑制性递质失衡是癫痫的发病机理之一。N-甲基-D-天氡氨酸(N-methyl-D-aspartate,NMDA)受体作为一种重要的兴奋性氨基酸受体,因可介导Ca2+内流引起神经细胞迟发性损伤,在癫痫发病和脑损伤机制中起着重要作用[1]。伽玛刀作为不开颅治疗颅内病变的重要手段,已用于难治性癫痫的治疗,但确切的生物学机制尚不明确。本研究旨在观察低剂量伽玛刀照射后癫痫大鼠皮层及海马NMDA受体亚基NR1、NR2A和NR2B的表达变化,以期探讨伽玛刀治疗癫痫的可能机制,为临床应用提供理论和实验依据。
1 材料与方法
1.1 动物分组与癫痫模型制备实验动物选用雄性Wistar大鼠,根据动物是否应用药物戊四氮(pentylenetetrazole,PTZ)致痫及接受伽玛刀照射,将60只大鼠随机分为4组,每组各15只:①对照组;②伽玛刀组:大鼠单纯接受伽玛刀照射,不致痫;③药物致痫组:大鼠经腹腔注射PTZ致痫;④伽玛刀+药物组:PTZ致痫大鼠再经伽玛刀照射。大鼠按35 mg/kg经腹腔注射PTZ溶液制备癫痫模型,每24 h注射1次,连续注射4周,非致痫组大鼠腹腔注射同等容量相同次数的生理盐水。
大鼠痫性发作严重程度采用修正Racine六级评价标准进行评价[2],每次注射后观察并记录各组大鼠出现痫性发作的强度。在PTZ连续注射期间内至少出现连续3次的Ⅳ级以上的痫性发作视为完全点燃,只有完全点燃的大鼠用于后续的研究,此后仍每周腹腔注射1次相同剂量的PTZ以维持发作。
实验大鼠于注射PTZ 3~6次后出现痫性发作,如眨眼、节律性咀嚼、点头、甩尾、前肢阵挛、全身肌阵挛、跌倒等表现,每次于注射后3~5 min出现,每次发作持续约40~60 min后逐渐缓解。24只大鼠于注射12~16次后达到完全点燃标准,癫痫模型制备成功率为80%。其余6只在PTZ连续注射期间内未达到完全点燃,将其剔除出后续的实验。
1.2 低剂量伽玛刀照射于PTZ连续注射4周,癫痫模型制备成功后,应用Leksell伽玛刀系统(ELEKTA,瑞典)对实验大鼠进行低剂量伽玛刀照射,将大鼠麻醉后置于动物固定架及伽玛刀的Leksell框架上,通过核磁共振仪(GE,Signa1.5T)对大鼠进行脑冠状面连续定位扫描,以大鼠双侧额叶为照射靶区,并根据核磁图像在Gamma Plan系统上确定双侧额叶的坐标轴,然后按所定坐标将动物固定架安放在伽玛刀定位架上,以50%等剂量曲线包裹靶区,边缘剂量为15 Gy,用4 mm准直器对大鼠脑组织进行照射[3]。
1.3 免疫组织化学检测各组大鼠于伽玛刀照射后12周(对照组8只,伽玛刀组8只,药物致痫组6只,伽玛刀+药物组6只),常规灌注取脑、包埋、切片,采用SP法进行免疫组化染色。每组选取对应断面的脑切片,光镜下观察额叶皮层和海马区域NR1、NR2A、NR2B 免疫反应阳性细胞(NR1、NMDAR2A及NMDAR2B单克隆抗体购自美国Santa Cruz公司)的形态和分布,利用Image-Pro Plus软件进行图像分析,分别计算额叶和海马CA1和CA3区相同面积内阳性细胞数,并对阳性细胞进行平均吸光度值测定。
1.4 蛋白免疫印迹检测各组大鼠分别于伽玛刀照射后12周(对照组7只,伽玛刀组7只,药物致痫组6只,伽玛刀+药物组6只),常规断头取脑,留取额叶皮层及海马组织,提取总蛋白,-80℃保存备用。通过蛋白免疫印迹法检测NMDA受体亚基 NR1、NR2A、NR2B 的蛋白表达情况(NMDAR1、NMDAR2A、NMDAR2B单克隆抗体及β-Actin多克隆抗体均购自美国Santa Cruz公司)。应用BAND SCAN图像分析软件对蛋白电泳条带的灰度值进行测定,将各目标条带与内参照β-actin条带进行灰度比较,进行半定量分析。
1.5 统计学方法应用SPSS 21.0进行统计学处理。计量资料以均数±标准差(±s)表示,组间比较采用方差分析,进一步两组间比较采用SNK法;非正态分布资料采用秩和检验。检验水准α=0.05。
2 结果
2.1 大鼠行为学及癫痫发作观察对照组及伽玛刀组大鼠无痫性发作表现,行为正常。药物致痫组大鼠点燃后每周再次注射PTZ后,绝大部分可出现Ⅳ级以上发作。伽玛刀+药物组大鼠经低剂量伽玛刀照射后,随观察时间的延长,与药物致痫组相比,每周再次注射PTZ,发作程度逐渐减轻,于照射后12周时,发作症状明显减轻 (Z=-2.27,P<0.05,表 1)。
2.2 大鼠额叶及海马NR1、NR2A、NR2B免疫反应阳性神经元观察大鼠额叶皮层及海马区域均可见散在分布的 NR1、NR2A、NR2B免疫反应阳性神经元,其中对照组及伽玛刀组在额叶皮层及海马 CA1、CA3 区,NR1、NR2A、NR2B 阳性神经元胞浆呈棕黄色,胞体较大,可见突起。而药物致痫组皮层及海马 CA1、CA3 区 NR1、NR2A、NR2B 免疫反应阳性神经元数目明显增多 (NR1:F额叶=10.47,FCA1=12.75,FCA3=16.93;NR2A:F额叶=13.40,FCA1=10.56,FCA3=18.28;NR2B:F额叶=11.26,FCA1=10.09,FCA3=8.44;P<0.05),胞浆染色较深,树突减少、甚至消失,平均吸光度值均明显增加(NR1:F额叶=25.02,FCA1=7.27,FCA3=10.71;NR2A:F额叶=16.62,FCA1=9.10,FCA3=30.39;NR2B:F额叶=11.96,FCA1=14.28,FCA3=32.56;P<0.05)。伽玛刀+药物组反应阳性神经元数目及形态接近对照组 (图1~3和表 2~4)。
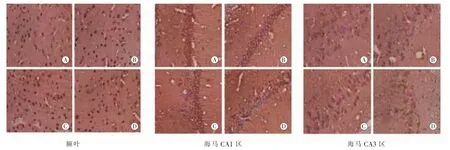
图1 NR1在各组大鼠额叶皮层和海马的表达情况(IHC,×400)。(A)对照组;(B)伽玛刀组;(C)药物致痫组;(D)伽玛刀+药物组
2.3 大鼠额叶及海马NMDAR亚基免疫蛋白印迹结果结果显示,与对照组比较,药物致痫组大鼠额叶皮层及海马NR1、NR2A和NR2B表达均明显增强;与药物致痫组比较,伽玛刀+药物组额叶皮层及海马NR1、NR2A和NR2B表达均明显减少(NR1:F额叶=35.60,F海马=19.68;NR2A:F额叶=44.39,F海马=39.31;NR2B:F额叶=50.26,F海马=47.70;P<0.05),伽玛刀与对照组无明显差别(图 4及表 5)。
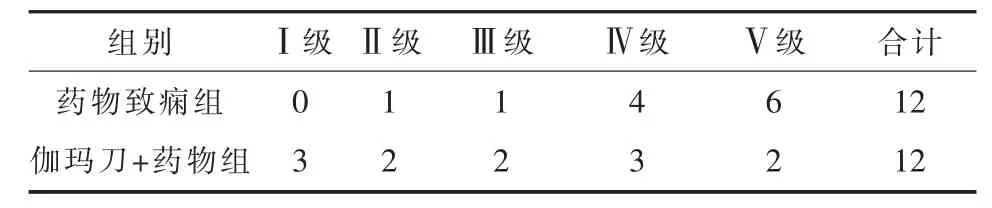
表1 两组大鼠痫性发作程度(只)
3 讨论
谷氨酸是中枢神经系统中介导快速兴奋性突触反应的重要神经递质,其受体分为离子型和代谢型两大类,其中离子型的NMDA受体主要分布于大脑皮层、海马、丘脑、纹状体、小脑及脑干的突触后膜上,是由NR1、NR2和NR3不同亚单位组成的异聚体。NR1亚基是基本功能亚单位,NR2、NR3亚基为调节亚单位,其中NR2有NR2A、NR2B、NR2C、NR2D亚型,在很大程度上决定了该受体的性质。研究表明,NMDA受体的激活是维持神经系统正常活动的前提,在突触传递和神经可塑性等生理过程中扮演关键角色,而NMDA受体过度的激活则可能与多种病理过程密切相关[3]。越来越多的资料显示,NMDA受体介导的兴奋性毒性在癫痫的发病过程中起重要的作用[4]。NMDA受体拮抗剂不但可以阻止癫痫的产生,还可以抑制由于癫痫而导致的大脑结构的改变[5]。此外,NMDA受体被认为是学习和记忆的关键物质,LTP的产生依赖于突触前膜谷氨酸等兴奋性递质的释放和突触后膜NMDA受体的激活。近年研究发现,NMDA受体可能在认知功能中具有双向作用,并与癫痫后认知功能损害有关。
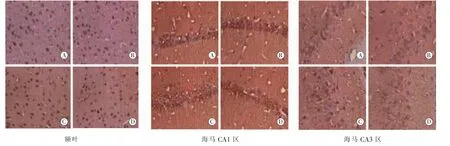
图2 NR2A在各组大鼠额叶皮层和海马的表达情况(IHC,×400)。 (A)对照组;(B)伽玛刀组;(C)药物致痫组;(D)伽玛刀+药物组

图3 NR2B在各组大鼠额叶皮层和海马的表达情况(IHC,×400)。(A)对照组;(B)伽玛刀组;(C)药物致痫组;(D)伽玛刀+药物组

图4 NR1,NR2A和NR2B在各组大鼠额叶皮层和海马的表达(免疫蛋白印迹法,β-actin为内参蛋白)。(A)对照组;(B)伽玛刀组;(C)药物致痫组;(D)伽玛刀+药物组
本研究发现,与正常大鼠相比,癫痫大鼠额叶皮层及海马区域NMDA受体亚基NR1、NR2A及NR2B蛋白表达均显著升高。课题组前期基础及临床研究发现,反复癫痫发作可导致广泛的认知功能障碍[6-7],因此,本研究提示,PTZ诱发癫痫的机制可能与PTZ提高脑组织 NR1、NR2A及NR2B亚单位蛋白的过度表达而改变NMDA受体的功能有关,而NMDA受体功能的变化可能是导致癫痫后出现认知功能障碍的原因之一。
表2 各组大鼠额叶皮层及海马CA1和CA3区NR1免疫阳性神经元数及平均吸光度值(±s)

表2 各组大鼠额叶皮层及海马CA1和CA3区NR1免疫阳性神经元数及平均吸光度值(±s)
1) 与对照组比较,P<0.05;2)与药物致痫组比较,P<0.05
组别n对照组伽玛刀药物致痫组伽玛刀+药物组8 8 6 6额叶1 3.7 5±3.2 8 1 4.1 3±2.6 4 2 2.3 3±3.2 7 1)1 7.6 7±3.6 1 2)免疫阳性神经元数C A 1 1 9.7 5±3.3 7 2 0.1 2±3.2 7 2 9.5 0±2.5 9 1)2 3.5 0±3.6 2 2)C A 2 1 7.6 2±3.6 7 1 8.6 3±2.9 7 2 9.1 7±3.1 9 1)2 1.6 7±3.0 8 2)额叶0.2 1±0.0 3 0.2 2±0.0 3 0.3 3±0.0 3 1)0.2 5±0.0 3 2)平均吸光度值C A 1 0.3 2±0.0 4 0.3 1±0.0 4 0.4 1±0.0 5 1)0.3 4±0.0 3 2)C A 2 0.2 7±0.0 5 0.2 8±0.0 4 0.3 9±0.0 4 1)0.3 0±0.0 4 2)
表3 各组大鼠额叶皮层及海马CA1和CA3区NR2A免疫阳性神经元数及平均吸光度值(±s)

表3 各组大鼠额叶皮层及海马CA1和CA3区NR2A免疫阳性神经元数及平均吸光度值(±s)
1) 与对照组比较,P<0.05;2)与药物致痫组比较,P<0.05
组别n对照组伽玛刀药物致痫组伽玛刀+药物组8 8 6 6额叶1 2.7 5±2.9 6 1 3.3 8±2.8 3 2 1.8 3±3.1 3 1)1 6.3 3±2.7 3 2)免疫阳性神经元数C A 1 1 4.5 0±3.2 1 1 5.6 2±2.8 8 2 3.3 3±2.7 3 1)1 7.6 7±3.5 6 2)C A 3 1 2.6 2±2.8 3 1 4.2 5±4.7 7 2 5.3 3±3.5 6 1)2 1.8 3±3.1 9 2)额叶0.2 0±0.0 3 0.2 1±0.0 3 0.3 2±0.0 4 1)0.2 4±0.0 4 2)平均吸光度值C A 1 0.2 5±0.0 5 0.2 7±0.0 4 0.3 7±0.0 5 1)0.3 0±0.0 4 2)C A 3 0.2 2±0.0 3 0.2 3±0.0 4 0.3 8±0.0 4 1)0.2 7±0.0 3 2)
表4 各组大鼠额叶皮层及海马CA1和CA3区NR2B免疫阳性神经元数及平均吸光度值(±s)
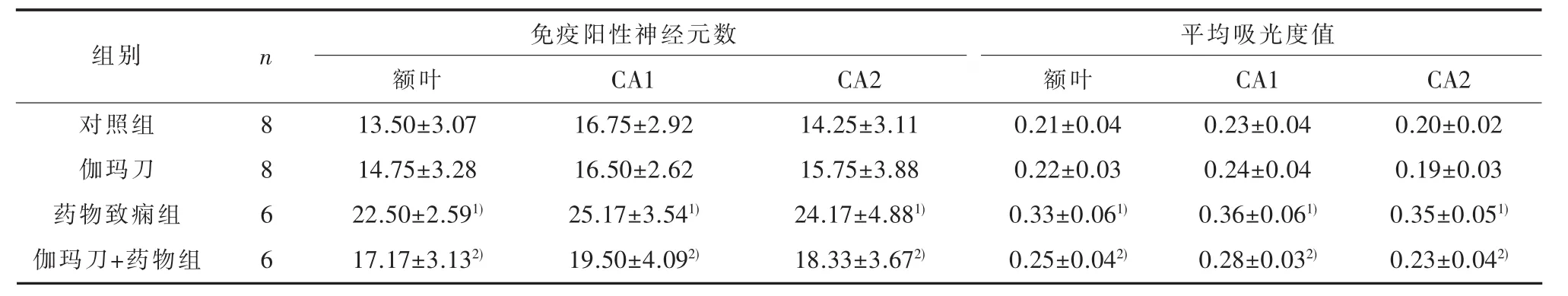
表4 各组大鼠额叶皮层及海马CA1和CA3区NR2B免疫阳性神经元数及平均吸光度值(±s)
1) 与对照组比较,P<0.05;2)与药物致痫组比较,P<0.05
组别n对照组伽玛刀药物致痫组伽玛刀+药物组8 8 6 6额叶1 3.5 0±3.0 7 1 4.7 5±3.2 8 2 2.5 0±2.5 9 1)1 7.1 7±3.1 3 2)免疫阳性神经元数C A 1 1 6.7 5±2.9 2 1 6.5 0±2.6 2 2 5.1 7±3.5 4 1)1 9.5 0±4.0 9 2)C A 2 1 4.2 5±3.1 1 1 5.7 5±3.8 8 2 4.1 7±4.8 8 1)1 8.3 3±3.6 7 2)额叶0.2 1±0.0 4 0.2 2±0.0 3 0.3 3±0.0 6 1)0.2 5±0.0 4 2)平均吸光度值C A 1 0.2 3±0.0 4 0.2 4±0.0 4 0.3 6±0.0 6 1)0.2 8±0.0 3 2)C A 2 0.2 0±0.0 2 0.1 9±0.0 3 0.3 5±0.0 5 1)0.2 3±0.0 4 2)
表5 免疫蛋白印迹法检测NR1,NR2A和 NR2B在各组大鼠额叶皮层和海马的表达(±s)
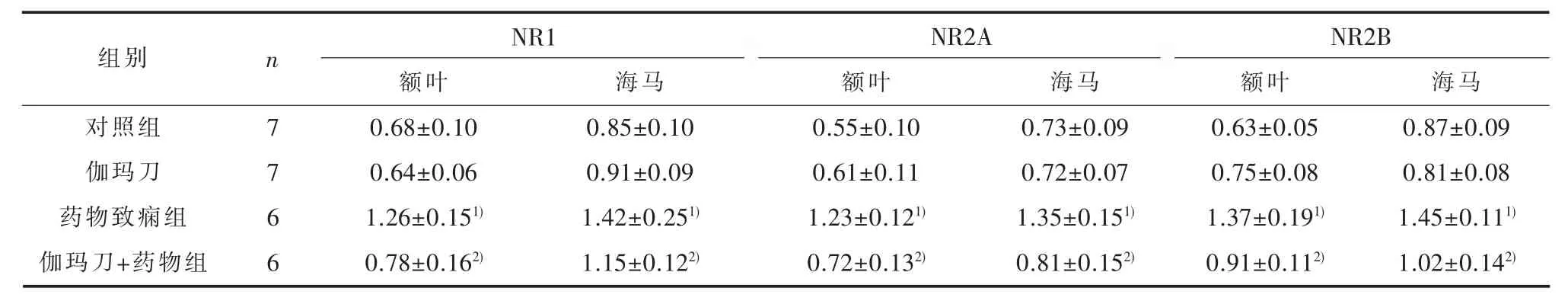
表5 免疫蛋白印迹法检测NR1,NR2A和 NR2B在各组大鼠额叶皮层和海马的表达(±s)
1) 与对照组比较,P<0.05;2)与药物致痫组比较,P<0.05
组别n N R 1 N R 2 A N R 2 B对照组伽玛刀药物致痫组伽玛刀+药物组7 7 6 6额叶0.6 8±0.1 0 0.6 4±0.0 6 1.2 6±0.1 5 1)0.7 8±0.1 6 2)海马0.8 5±0.1 0 0.9 1±0.0 9 1.4 2±0.2 5 1)1.1 5±0.1 2 2)额叶0.5 5±0.1 0 0.6 1±0.1 1 1.2 3±0.1 2 1)0.7 2±0.1 3 2)海马0.7 3±0.0 9 0.7 2±0.0 7 1.3 5±0.1 5 1)0.8 1±0.1 5 2)额叶0.6 3±0.0 5 0.7 5±0.0 8 1.3 7±0.1 9 1)0.9 1±0.1 1 2)海马0.8 7±0.0 9 0.8 1±0.0 8 1.4 5±0.1 1 1)1.0 2±0.1 4 2)
自上世纪中叶Leksell提出放射神经外科的概念以来,伽玛刀逐渐成为不开颅治疗颅内病变的重要手段,具有安全,定位精确,对周围组织损伤小等优点,已用于难治性癫痫的治疗,但目前伽玛刀抗痫的作用机制仍不十分清楚,限制了治疗的进一步优化。有研究表明[8],低剂量伽玛刀照射治疗癫痫的机制可能与增加致痫灶抑制性神经递质的含量,减轻癫痫发作后的氧化应激损伤以及神经细胞凋亡有关;还有学者认为,低剂量伽玛刀可阻滞癫痫神经元的突触传导,降低癫痫神经元自身活性而不会引起正常神经元坏死,从而使癫痫发作得到有效控制。本研究发现,癫痫大鼠经边缘剂量15Gy的低剂量伽玛刀照射后,痫性发作明显减少,且伴有额叶皮层和海马NR1、NR2A和NR2B表达降低。同时,我们前期研究发现,癫痫大鼠经低剂量伽玛刀照射后,认知功能也得以改善,提示NMDA受体亚基的表达变化在低剂量伽玛刀抗癫痫治疗和改善认知功能的过程中可能发挥了重要作用,但其具体作用机制有待进一步阐明。
