海参肽对运动性疲劳大鼠骨骼肌线粒体功能的影响
2019-08-19于雁飞王通王广飞王运智李亚高永林
于雁飞,王通,王广飞,王运智,李亚,高永林
(1烟台嘉惠海洋生物科技有限公司,山东烟台264006;2烟台大学)
运动性疲劳主要源于肌肉疲劳和能量的衰竭,表现为肌肉最大收缩或者最大输出功率暂时性下降[1]。如何延缓疲劳的发生以及促进疲劳状态的恢复是目前研究的热点[2]。线粒体在细胞能量代谢中发挥关键作用。线粒体功能障碍、结构异常、能量代谢紊乱等都是机体产生运动性疲劳的潜在因素[3]。海参是一种药用与营养价值极高的海洋棘皮动物,从海参中提取的海参肽具有消除疲劳、延续衰老、提高免疫力等作用[4]。2018年6~8月,我们从线粒体功能保护角度探讨海参肽对运动性疲劳大鼠保护机制,旨在为海参肽的进一步开发、利用提供实验依据。
1 材料与方法
1.1 动物、试剂与仪器 雄性SD大鼠50只,PVC盒饲养,室温20~26 ℃,相对湿度40%~70%,昼夜交替时间为12 h/12 h。海参肽由烟台嘉惠海洋生物科技有限公司提供,4 ℃干燥保存。主要试剂包括抗霉素A、细胞色素C、考马斯亮蓝、还原型辅酶Ⅰ(NADH)、辅酶Q0、牛血清白蛋白等,均为Sigma公司产品。NaCl、NaN3、EDTA、三羟甲基氨基甲烷(Tris)等均为国产分析纯。超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)、丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所。过氧化物酶体增殖物激活受体辅激活因子1α(PGC-1α)、雌激素相关受体(ERR)购自北京中杉金桥生物技术有限公司。主要仪器包括紫外可见光分光光度计、游泳箱、电热恒温水浴锅等。
1.2 动物分组与干预处理 将大鼠随机分为正常对照组、模型组及海参肽高、中、低剂量组,每组各10只。采取力竭性游泳方法进行负重游泳训练来构建运动性疲劳模型[5]。除正常对照组外,其他组每天进行游泳训练,连续2周。力竭标准:动物在水中旋转、运动协调性明显下降,身体下沉,鼻尖淹没至水下至再次浮出水面超过10 s。2周后分别给予海参肽高、中、低剂量组300、150、75 mg/kg海参肽灌胃,模型组和正常对照组给予等量纯净水灌胃,连续28 d。实验结束后将大鼠麻醉处死,取股四头肌中间部位冲洗干净,用于后续检测。
1.3 骨骼肌组织中MDA、SOD、GPx水平检测 取肌肉组织剪碎,匀浆,离心取上清液。采用分光光度法检测上清液中MDA、SOD、GPx水平,检测步骤严格按照试剂盒说明书进行。
1.4 骨骼肌线粒体的提取 取肌肉组织1 g,剪碎。按照1∶9(w/v)加入介质Ⅰ(0.12 mol/L KCl,20 mmol/L Hepes,5 mmol/L MgCl2,pH=7.4)匀浆,离心取上清液,用纱布过滤以去除脂肪,得到10%肌肉组织匀浆。离心取沉淀,加入介质Ⅰ,再次离心取沉淀,加入20 mL介质Ⅱ(0.3 mol/L Sucrose, 2.0 mmol/L Hepes, 0.1 mmol/L EDTA,2 mg/mL脱脂BSA,pH 7.4),离心取沉淀,加入1 mL介质Ⅱ,得到纯化的线粒体。
1.5 骨骼肌线粒体通透转运孔道(PTP)开放状况观察 向线粒体中加入测试溶液(230 mmol甘露醇,70 mmol蔗糖,3 mmol Hepes,pH=7.4)稀释至0.3 mg/mL,在20 ℃的条件下进行紫外分光光度计测定。检测线粒体在540 nm处的光密度(OD)值,以OD值表示线粒体PTP开放程度[6],OD值降低表示骨骼肌线粒体肿胀度增加,PTP开放程度增加。
1.6 骨骼肌线粒体中呼吸链复合物Ⅰ、Ⅲ活性检测[7,8]首先采用考马斯亮蓝G250法测定骨骼肌线粒体中的蛋白含量。配制0~100 μg/mL牛血清白蛋白梯度溶液(0、20、40、60、80、100 μg/mL),分别加入5 mL考马斯亮蓝G250蛋白试剂充分混合,放置2 min后在紫外可见光分光光度计595 nm下比色,作出标准曲线。吸取线粒体提取液0.1 mL,加入5 mL考马斯亮蓝G250蛋白试剂充分混合,放置2 min后595 nm下比色,记录消光值,并通过标准曲线查得每毫升溶液中的蛋白含量,以蒸馏水作空白样。另取酶复合物Ⅰ反应缓冲液2 mL(反应体积),加入10 μL线粒体蛋白;然后加入辅酶Q0(80 amol/L)+BSA(1 mg/mL)、NaN3(2 mmol/L)、抗霉素(2 ag/mL)混匀,加入10 μL 200 amol/L NADH启动反应;紫外可见光分光光度计340 nm处测定NADH吸收值(3 min内连续测定340 nm处吸收值的变化记为ΔA,吸光系数为6.22)。取酶复合物Ⅲ反应缓冲液2 mL(反应体积),加入10 μL线粒体蛋白;然后加入2 mmmol/L NaN3+50 amol/L细胞色素C混匀,加入10 μL辅酶Q0启动反应;紫外可见光分光光度计550 nm处测定细胞色素C吸收值(3 min内连续测定550 nm处吸收值的变化记为ΔA,吸光系数为21.84)。酶复合物活性=[(ΔA/min×反应体积)/吸光系数]/线粒体蛋白含量。
1.7 骨骼肌线粒体中相关蛋白PGC-1α、ERR表达检测[9]采用Western blotting法。肌肉组织匀浆,收集上清,提取总蛋白,采用BCA法测定蛋白浓度。取20 μL样品进行SDS-PAGE凝胶电泳,电转到硝酸纤维膜,300 mA恒流1 h。加入5%脱脂牛奶室温封闭1 h,分别加入一抗,室温孵育1 h,4 ℃冰箱过夜。TBST洗膜,加入二抗,室温孵育1.5 h。TBST洗膜,加入HRP发光底物,暗室曝光。采用Image J软件分析,以目的蛋白条带灰度值与β-actin灰度值的比值表示目的蛋白的相对表达量。
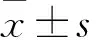
2 结果
2.1 各组骨骼肌组织中SOD、GPx活性和MDA含量比较 见表1。与正常对照组比较,模型组肌肉组织中SOD、GPx活性降低,MDA含量升高(P<0.05或<0.01)。与模型组比较,海参肽高、中剂量组肌肉组织中SOD、GPx活性升高,MDA含量降低(P<0.05或<0.01)。
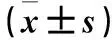
表1 各组骨骼肌组织中SOD、GPx活性和MDA含量比较
注:与正常对照组比较,*P<0.01;与模型组比较,△P<0.05,△△P<0.01。
2.2 各组骨骼肌线粒体PTP开放状况比较 正常对照组、模型组和海参肽低、中、高剂量组骨骼肌线粒体OD值分别为0.48±0.09、0.10±0.01、0.08±0.02、0.24±0.04、0.39±0.06。与正常对照组比较,模型组骨骼肌线粒体OD值降低(P<0.01);海参肽高、中剂量组较模型组升高(P均<0.01),海参肽低剂量组与模型组比较差异无统计学意义(P>0.05)。
2.3 各组骨骼肌线粒体中呼吸链复合物Ⅰ、Ⅲ活性比较 见表2。与正常对照组比较,模型组骨骼肌线粒体呼吸链酶复合物Ⅰ、Ⅲ活性降低(P均<0.01)。与模型组相比,海参肽高、中剂量组骨骼肌线粒体复合物Ⅰ、Ⅲ活性提高(P<0.05或<0.01)。海参肽低剂量组线粒体复合物Ⅰ、Ⅲ活性与模型组比较差异无统计学意义(P均>0.05)。

表2 各组骨骼肌线粒体中呼吸链酶复合物Ⅰ、Ⅲ活性比较
注:与正常对照组比较,*P<0.01;与模型组比较,△P<0.05,△△P<0.01。
2.4 各组骨骼肌线粒体中PGC-1α、ERR表达比较 见表3。与正常对照组比较,模型组骨骼肌线粒体中PGC-1α、ERR表达降低(P<0.05或<0.01)。与模型组相比,海参肽高、中剂量组PGC-1α、ERR表达升高(P<0.05或<0.01)。
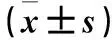
表3 各组骨骼肌线粒体中PGC-1α、ERR表达比较
注:与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。
3 讨论
运动性疲劳主要表现为能量缺失、运动耐力下、躯体性疲乏以及体力恢复时间延长[10]。运动性疲劳多由肌肉过度运动引起,可引起骨骼肌氧化应激水平的变化[11]。能量代谢机制改变是运动性疲劳发生的重要机制。线粒体在细胞能量代谢中起关键作用,线粒体功能障碍、结构异常、能量代谢紊乱等均是疲劳发生的潜在因素。因此维持线粒体结构与功能的正常对缓解机体运动性疲劳具有重要意义。
海参肽具有抗氧化、抗疲劳等广泛的生理功能,其生物利用率高,较氨基酸更易吸收[12]。卢连华等[13]报道,对小鼠给予海参肽灌胃,能够延长小鼠负重游泳时间,降低运动后小鼠的尿血氮素和血乳酸水平,提高肝糖原含量,表明海参肽具有较强的抗疲劳作用。Ye等[14]报道,海参提取液可显著延长小鼠的负重游泳时间和存活时间,显著提高血红蛋白含量并减少运动小鼠血乳酸的积累,具有显著的抗疲劳和抗缺氧效应。王军琦[15]报道,海参肽能够增强小鼠单核巨噬细胞作用及体液免疫和细胞免疫功能,增强小鼠的抗疲劳能力。本研究采用力竭性游泳方法进行负重游泳训练构建运动性疲劳大鼠模型,通过检测骨骼肌氧化应激指标、线粒体PTP开放程度及呼吸链复合物Ⅰ、Ⅲ活性和线粒体PGC-1α、ERR蛋白表达,观察海参肽对骨骼肌线粒体功能的影响。
机体在持续运动中,体内的氧化代谢及脂质过氧化反应代偿性增强,导致组织和血液中自由基增加并攻击细胞及线粒体等生物膜[16]。MDA是机体内自由基代谢的脂质过氧化产物,MDA水平间接反映了细胞受自由基攻击的严重程度。SOD和GPx作为机体内重要的清除自由基活性酶,是缓解运动疲劳过程中氧化应激的重要保护酶。本研究结果显示,模型组骨骼肌SOD、GPx活性降低,MDA含量升高,表明机体运动性疲劳诱导了动物体内氧化应激反应;海参肽中、高剂量组骨骼肌SOD、GPx活性较模型组升高而MDA含量降低,说明海参肽可提高机体抗氧化能力并促进自由基清除。
线粒体PTP是位于线粒体内、外膜之间的多蛋白复合体,可影响线粒体的正常生理功能。研究表明,疲劳引起的氧化应激可导致线粒体PTP过度开放[17]。本研究结果显示,模型组骨骼肌线粒体PTP过度开放(OD值降低)。而海参肽高、中剂量组骨骼肌线粒体PTP开放有所降低(OD值较模型组升高)。研究结果表明,海参肽可通过降低线粒体PTP开放发挥抗疲劳作用。
线粒体呼吸链复合物Ⅰ、Ⅲ是线粒体进行能量代谢的重要组成部件,其活性变化能直接或间接地反映线粒体呼吸功能的变化[18]。本研究结果显示,模型组骨骼肌线粒体呼吸链酶复合物Ⅰ、Ⅲ活性降低,表明机体运动性疲劳引起机体线粒体呼吸功能下降。海参肽中、高剂量可显著提高呼吸链酶复合物Ⅰ、Ⅲ活性。研究结果表明,海参肽可通过影响骨骼肌线粒体呼吸功能改善动物运动性疲劳状态。
PGC-1α在调控细胞线粒体再生中发挥着重要作用。PGC-1α通过促进骨骼肌线粒体生成的转录因子ERR增强肌肉的抗氧化能力和抗疲劳性。PGC-1α和ERR表达反应了线粒体再生的强度。有研究表明,运动性疲劳可引起骨骼肌线粒体PGC-1α和ERR水平下降[19]。本研究结果显示,运动性疲劳模型组骨骼肌线粒体中PGC-1α和ERR表达显著降低。与模型组比较,海参肽中、高剂量组骨骼肌PGC-1α和ERR表达显著增加。表明海参肽可以增加疲劳大鼠骨骼肌线粒体中PGC-1α、ERR表达,促进线粒体生成,进而增强疲劳大鼠的运动耐受力。
综上所述,海参肽能够对抗运动性疲劳,其机制可能与其改善骨骼肌氧化应激状态、降低骨骼肌线粒体肿胀度和线粒体膜通透性、增强骨骼肌线粒体的呼吸功能及上调线粒体生成转录因子PGC-1α、ERR表达有关。
