Cfap43基因缺陷小鼠组织病理学研究
2019-08-16余怡王家雄马勇许伟伟王玮李红杨慎敏
余怡,王家雄,马勇,许伟伟,王玮,李红,杨慎敏
(南京医科大学附属苏州医院生殖与遗传中心,苏州 215002)
严重弱精子症除环境、生活方式等特异性因素外[1],与精子尾部超微结构异常有关,而这些超微结构的异常往往提示患者自身存在着遗传缺陷,如原发性纤毛运动障碍(primary ciliary dyskinesia,PCD)、精子鞭毛多发形态异常(multiple morphological abnormalities of the sperm flagella,MMAF)、成人型多囊肾(autosomal dominant polycystic kidney disease,ADPKD)等。其中PCD与ADPKD患者的遗传缺陷不仅影响了精子质量与男性生育力,更关键的是这些缺陷对其他脏器的严重不良影响。PCD患者常伴有慢性呼吸道症状,而ADPKD患者双侧肾脏出现广泛的囊性改变。MMAF患者表型与PCD类似,其精子在光学显微镜下表现尾部短而粗、僵直等特征,早年间学者将其称为“短尾”(short tail)、“残段尾”(stump tail)或纤维鞘发育不良(dysplasia of the fibrous sheath,DFS)[2-3],MMAF患者遗传缺陷的研究较PCD与ADPKD少。本课题组曾报道Cfap43基因缺陷的MMAF[4],而近来也有MMAF新致病突变基因的报道[5]。本研究通过构建Cfap43缺陷的小鼠,对其精子表型以及生殖系统及非生殖系统的脏器进行了组织病理检查,旨在探讨Cfap43在弱精子症发生发展中的作用。
材料与方法
一、实验动物与仪器试剂
1.实验动物:8周龄C57BL/6品系雄性小鼠(野生型)3只(购自苏州昭衍新药研究中心有限公司,SPF级)。
2.主要试剂仪器:引物(南京金思瑞);核酸提取试剂盒(BIMAKER,美国);胚胎缓冲液(GMOPS,Vitrolife,瑞典);2.5%戊二醛电镜固定液(Life Science,美国);Boin固定液(Life Science,美国);环氧树脂Epon 812(SPI,美国);PCR仪(Biometra Tadvanced 96,德国);Sanger测序仪(ABI 3500,美国);光学显微镜(Nikon Eclipse E100,日本);透射电镜(TECNAI 10,Philips,荷兰)。
二、实验方法
1.基因敲除小鼠构建:参照本课题组之前的方法[4],使用CRISPR/Cas9技术生成了Cfap43敲除小鼠。
2.基因型鉴定:8周龄小鼠剪尾,使用核酸提取试剂盒提取鼠尾DNA,参照试剂盒说明书,配置20 μl体系后行PCR。引物序列:F:5’-TCCTTTCTTTTTTGATGGCTCTAGC-3’;R:5’-TTCTATCTTCATGGGCTTCTTTGCT-3’。反应产物行Sanger测序后,使用FINCHTV软件与NCBI网站分析测序结果。
3.精子形态检测:胚胎缓冲液37℃预热,将Cfap43(-/-)小鼠与WT小鼠解剖取出附睾剪碎置入EP管,加1 ml预热的缓冲液,37℃水浴10 min,使精子游离,镊子夹去附睾组织,400g离心15 min,弃上清,加入PBS洗涤,离心沉淀进行精子涂片,剩余沉淀加入2.5%戊二醛固定过夜,PBS缓冲液冲洗2次,每次15 min,之后经过1%锇酸后固定1 h,再经过PBS缓冲液冲洗2次,每次15 min,2%醋酸铀染色,乙醇逐级脱水,100%丙酮置换,用环氧树脂Epon 812包埋,切片机超薄切片,醋酸铀与柠檬酸铅双重染色,最后在透射电镜下观察精子尾部超微结构。
4.组织病理学检测:解剖Cfap43(-/-)小鼠与WT 小鼠,取肝、脾、肺、肾、脑、小肠,4%多聚甲醛固定过夜,睾丸、附睾用Bouin固定液固定过夜。经梯度酒精脱水,二甲苯透明,石蜡包埋,切片,HE染色,比较病理学差异。肾、小肠的电镜检测过程同上述精子的电镜检测过程。
结 果
一、小鼠基因型鉴定
按照人类的表型,我们通过CRISPR/Cas9技术构建了Cfap43基因第20号外显子上的一个2 bp的删除,从而导致移码突变并终止了Cfap43 的转录,Sanger测序对小鼠基因型鉴定,与构建模型吻合(图1)。

A:在Cfap43上构建了2 bp的删除(红色);B:2 bp的删除造成的移码突变直接导致了转录的提前终止,cDNA中的终止子用*表示;C:Sanger测序鉴定小鼠基因型,与构建方案吻合,2 bp缺失的位置如方框所示图1 Cfap43缺陷小鼠构建和鉴定

图2 两组小鼠精子形态学结果(HE染色,×40)
二、两组小鼠的精子形态
WT小鼠精子的头部呈镰刀状,鞭毛较长。与WT小鼠相比,Cfap43基因缺陷小鼠精子尾部则出现短、粗、卷曲甚至缺失等异常(图2)。透射电镜下观察,两组小鼠精子头部差异不明显,但尾部超微结构显示:WT小鼠精子纤维鞘排列整齐,内部中央微管与外周微管呈现经典的“9+2”结构;而Cfap43(-/-)小鼠,精子尾部出现程度不一的结构紊乱,如纤维鞘的增厚,纤维鞘、外周致密纤维、微管的排列异常与数目异常等(图3)。
三、两组小鼠各组织病理学特征
生殖系统方面,WT小鼠与Cfap43(-/-)小鼠附睾内的精子数无明显差异。WT小鼠附睾内精子发育成熟,有明显的正常尾部鞭毛(图4A),而Cfap43(-/-)小鼠附睾内成熟精子较少,且精子尾部出现粗、短等明显的MMAF表型(图4C);睾丸内,WT小鼠睾丸的各级生精细胞排布整齐,有较多正常的长形精子(图4B),而Cfap43(-/-)小鼠生精细胞精子鞭毛发育异常,未见正常的长形精子,但精子头部的变形和浓缩未见明显异常,可见正常残余体(residual body,RB)的存在(图4D)。
Cfap43(-/-)小鼠的肝脏组织与WT组相比无明显差异,肝小叶完整,中央静脉存在,肝内胆管未见明显扩张,肝细胞未见明显充血、水肿,肝脏未见纤维化;Cfap43(-/-)小鼠的脾脏组织白髓与红髓结构正常,小梁间血管排列紧密,与WT组相比无明显差异;Cfap43(-/-)小鼠的肺脏组织,镜下可见各级支气管、肺泡管、肺泡及肺泡囊结构整齐,肺泡内未见明显渗出,肺间质未见明显炎症细胞浸润,与WT组相比无明显差异;Cfap43(-/-)小鼠的肾脏组织肾小体与肾小管结构完整,排列整齐,未见明显充血、水肿、纤维化,与WT组相比无明显差异;Cfap43(-/-)小鼠的大脑皮质与海马体排列结构正常,未见明显神经细胞萎缩等异常现象,与WT组相比无明显差异;Cfap43(-/-)小鼠的小肠组织的各层结构排列整齐,腺体无明显萎缩,管腔见较多的环形皱襞与绒毛,与WT组相比无明显差异(图5)。
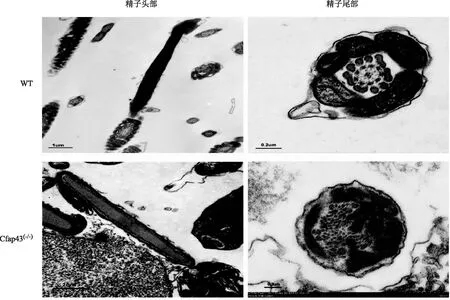
图3 两组小鼠精子的透射电镜图
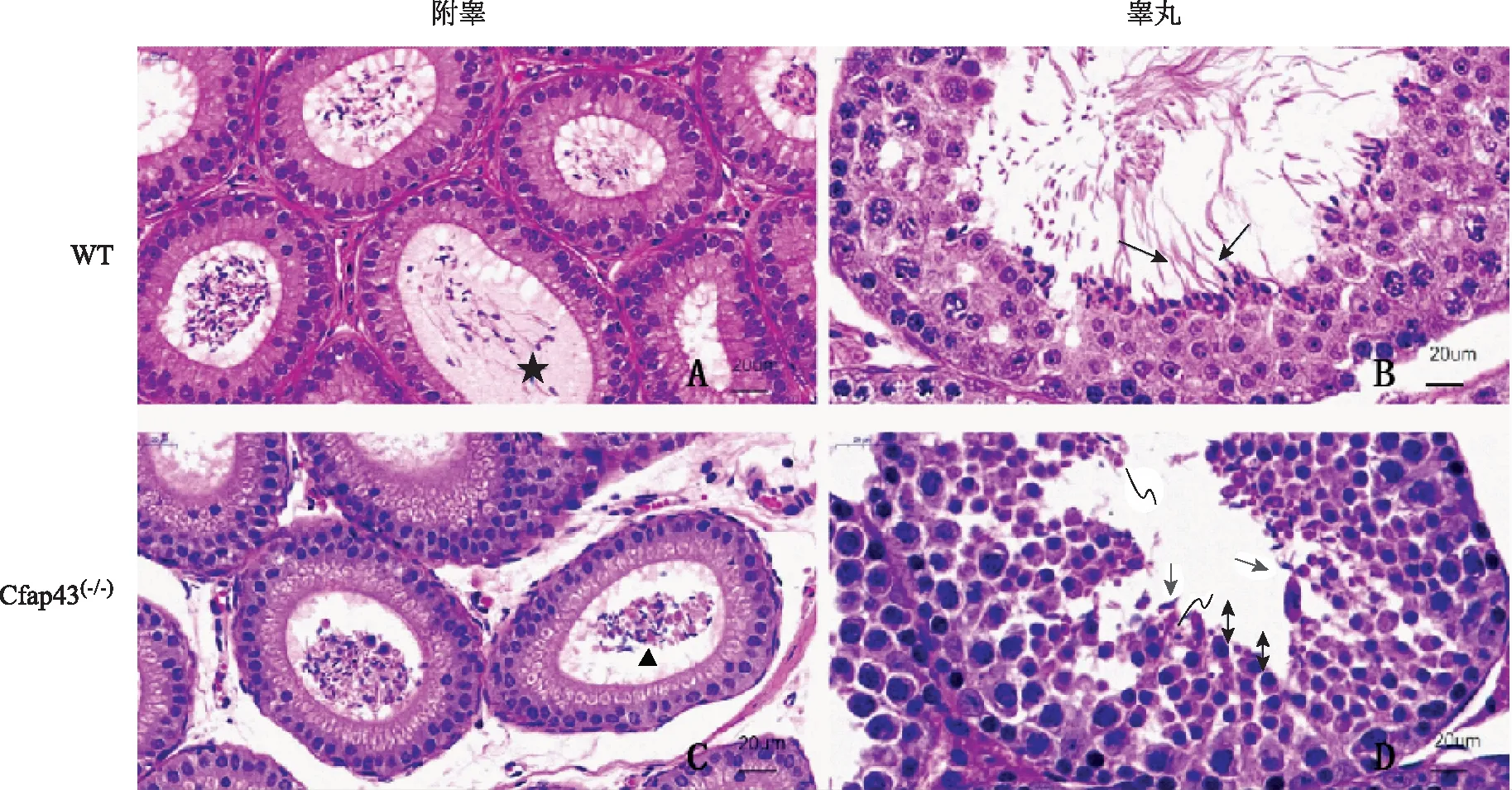
★示附睾内正常鞭毛精子;▲示附睾内MMAF表型;示正常长形精子;→示睾丸生精细胞鞭毛异常;↔示精子头部变形和浓缩;示正常残余体图4 小鼠睾丸与附睾病理图片(HE染色,附睾×50;睾丸×80)
透射电镜下观察,两组小鼠的小肠肠腔表面均分布有紧密排列的正常微绒毛结构,两者对比未见明显差异。两组小鼠的肾小管(近曲小管)有着紧密排列的的微绒毛,两者对比亦未见明显差异(图6)。

A:肝、肺、肾组织(HE染色,×20).B:脑组织(HE染色,×5)及脾、小肠组织(HE染色,×10)图5 两组小鼠各组织切片病理结果

图6 两组小鼠部分非生殖器官的电镜图
讨 论
纤毛/鞭毛组织在人体内广泛分布于听觉器官、视觉器官、呼吸道上皮、肝脏、肾脏、输卵管、睾丸组织等,其在各组织内的作用有所不同[6]。哺乳动物通过纤毛运输来实现视觉色素的更新,因此纤毛组织的受损会影响视觉功能。气管与支气管上皮细胞表面存在着许多纤毛柱状上皮,这些纤毛规律地摆动能够及时清除异物组织及粘液[7]。肝脏、肾脏等部分实质器官中,纤毛组织能够起到调控液体流动的作用,当相关基因突变时,纤毛的这种调控机制出现紊乱,引发器官的囊性病变[8]。在输卵管中,纤毛组织在性激素的调控下,周期性地发生摆动,加速卵子或受精卵的移动。在睾丸组织内,鞭毛作为精子的重要组成,是精子运动不可缺少的部分,任何影响精子鞭毛结构的基因突变,均可引起精子活动力的下降甚至导致精子不活动[9]。
MMAF是一类鞭毛发育异常引起的功能性疾病,主要表现为精子尾部的粗、短、卷曲等形态异常,电子显微镜下观察,整个精子鞭毛组装均出现异常[10],包括纤维鞘、线粒体鞘的发育不良,微管的缺失与排列异常,外周致密纤维的数目与排列异常等[11]。本课题组通过全外显子组测序的方法鉴定出中国MMAF患者的疾病相关基因Dnah1、Ccdc39、Cfap43、Cfap44和Cfap65[4]。此后在国际上报道了Cfap43导致的MMAF新病例。据目前文献来看,Cfap43是除DNAH1之外MMAF最为常见的致病基因,而Cfap43的功能尚不完全明确。Coutton等[12]对MMAF的研究中发现,Dnah1、Cfap43、Cfap44基因突变的病例占到其病例总数的28.2%,这也提示深入研究这三种基因的潜在功能对于更好地理解MMAF的发病有重要的作用。近年来MMAF受到了学者们的关注,近期又报道了MMAF的新致病基因Cfap69[5]以及最新报道的Cfap251[13-14]。这些研究均着眼于目的基因对精子鞭毛的影响,涉及对其他脏器的潜在威胁。本研究发现,Cfap43缺陷的小鼠其精子出现典型的MMAF表型,其睾丸病理提示生精功能存在异常,但是其他脏器的组织病理无显著异常。有研究发现,Cfap43基因高表达于成年小鼠睾丸中[15],其他组织相对较少或不表达,这或许可以解释Cfap43缺陷导致的MMAF并不一定会伴随着其他脏器的疾病。
CFAP43蛋白首次在牛精子中心粒被鉴定[16],之后发现在人类精子也存在CFAP43蛋白[17]。CFAP蛋白是一类纤毛中高度保守的蛋白,其结构中富含WD重复结构域,而这种结构域在精子鞭毛内运输(intraflagellar transport,IFT)蛋白中高度富集[18],提示其在精子鞭毛形成过程中的重要作用[19]。IFT蛋白将位于胞质合成的重要蛋白运送到轴丝部位,参与动力蛋白臂的合成,其在精子鞭毛发生中发挥了重要的作用。CCDC39基因突变引起纤毛内侧动力蛋白臂的缺失,文献报道该基因与PCD有较大关联[20]。据统计。PCD男性病例中,约有76%病例同时表现为弱精子症[13],而这部分患者中精子形态学表现为MMAF的比例并不清楚。
本研究中,我们仅对部分实质器官进行了形态学研究。除睾丸与附睾组织外,其他脏器组织并未发现有明显的异常。CFAP43在肺组织中有一定的表达[15],而肺的各级支气管的表面分布着呈柱状的纤毛组织,摆动的纤毛负责清除粘液与异物组织[7,21]。CFAP43作为一种结构蛋白,其在精子鞭毛形成中主要影响内侧动力蛋白臂的正常结构形成[12],但其是否影响其他运动纤毛(呼吸道、支气管粘膜表面的运动纤毛)的正常结构与功能目前尚无研究。肾脏上皮细胞电镜下存在着初级纤毛,与运动纤毛不同的是,初级纤毛主要起到维持细胞形态与组织完整的作用[22],ADPKD的发生正是由于初级纤毛上的多囊蛋白(polycystin-1、2,PC-1、2)突变引起,CFAP43蛋白是否参与肾脏上皮细胞的初级纤毛结构组成,以及该蛋白突变后能否引起纤毛信号通路(cilia-dependent cyst activation,CDCA)的激活或抑制进而引起肾脏的囊性病理改变[8],目前尚无充分研究解释这些猜想。我们的实验结果暂未发现Cfap43敲除小鼠肾脏组织病理表现为典型的多囊肾,后期需要更多的探索来解开这些疑问。
总结与展望:Cfap43缺陷导致精子尾部畸形,但是含纤毛的组织(肺、肾、脑)和不包含纤毛的组织(肝、脾)病理上未发现明显影响。纤毛组织在不同的物种间具有高度的保守性,但在同一物种内,其在各器官内的分化机制却不相同。CFAP43作为一种纤毛与鞭毛的结构蛋白,其在小鼠的各器官中表达含量不尽相同,当Cfap43缺陷时,各器官尤其是含有纤毛组织的器官病变也存在较大的差异。纤毛组织在生物体内除了起到运动功能外,其还参与细胞信号转导的过程,而各组织细胞间存在着部分信号转导的差异性,导致后期的生物学事件也不相同,这可能与上述器官病变的差异性有关。未来需要更多的研究去解释这些现象。
