骨肉瘤患者3种基因多态性与大剂量甲氨蝶呤不良反应相关性的Meta分析Δ
2019-08-15宋再伟刘爽易湛苗张恩瑶赵荣生
宋再伟,刘爽,易湛苗,张恩瑶,赵荣生,3#
(1.北京大学第三医院药剂科,北京100191;2.北京大学药学院药事管理与临床药学系,北京 100191;3.北京大学医学部药物评价中心,北京 100191)
骨肉瘤是最常见的原发性恶性骨肿瘤,好发于儿童与青少年。目前骨肉瘤治疗难度仍较高,临床上多采用以外科治疗为主、化疗或其他治疗为辅的治疗方案[1]。对于骨肉瘤的化疗方案,美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)、《骨肿瘤临床实践指南》[2]、欧洲肿瘤内科学会(European Sarcoma Network Working Group,ESMO)、《骨肉瘤诊断、治疗和随访指南》[3]、《中国骨肉瘤临床循证诊疗指南(2018)》[4]均推荐了大剂量甲氨蝶呤[High-dose methotrexate(HDMTX),静脉注射,>500 mg/m2[5]]作为一线化疗药物。在骨肉瘤化疗方案中,HD-MTX在有效提高血药浓度、改善疗效的同时,其药物不良反应发生率也相应增加,包括血液毒性、肝毒性、肾毒性和神经毒性等严重不良反应。HD-MTX不良反应存在较大的个体差异,可导致化疗中断、肿瘤复发,影响治疗,因此受到广泛关注[6]。
MTX是叶酸拮抗剂,其通过与细胞内二氢叶酸还原酶结合,竞争性地抑制二氢叶酸还原酶活性,阻断二氢叶酸转化为具有生物活性的四氢叶酸,进而发挥药理作用。在甲氨蝶呤代谢途径中,亚甲基四氢叶酸还原酶(MTHFR)、还原性叶酸载体(RFC)、P-糖蛋白(P-gp)相关的基因多态性被广泛研究[7-9]。MTHFR是细胞内叶酸代谢的关键酶,对MTX发挥药理作用有重要意义,其基因常见多态是MTHFR C677T(rs1801133)/A1298C(rs1801131)[7]。RFC1/SLC19A1是转运MTX进入细胞产生疗效的重要载体,RFC1G80A(rs1051266)存在多态性[8]。P-gp是由多重耐药基因(MDR1/ABCB1)编码的外排蛋白,将MTX外排出细胞,其基因常见多态是MDR1C3435T(rs1045642)[9]。
目前,国内外对MTHFR C677T/A1298C、RFC1G80A、MDR1C3435T多态性与HD-MTX不良反应相关性的研究结论不一致,有研究[10]表明,MTHFR677CT/TT型可显著增加中国人群的中重度口腔黏膜炎的发生风险,而比利时人群中未观察到显著相关性[11]。骨肉瘤患者中HD-MTX个体化用药仍缺乏有效指导,但尚无系统评价综合评估骨肉瘤患者中相关基因多态性对HD-MTX不良反应的影响。因此,本研究采用Meta分析的方法,系统评价MTHFR C677T/A1298C、RFC1G80A、MDR1C3435T对HD-MTX不良反应的影响,为骨肉瘤患者HD-MTX临床用药提供循证参考,为临床决策提供循证依据,促进HD-MTX个体化用药,最终改善骨肉瘤患者的临床结局。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 国内外公开发表的队列研究。
1.1.2 研究对象 接受HD-MTX化疗的骨肉瘤患者,种族、性别、年龄不限。
1.1.3 暴露因素MTHFR C677T/A1298C、RFC1G80A、MDR1C3435T分别按照野生型与突变型分组。
1.1.4 结局指标 HD-MTX相关不良反应发生率,包括:①血液毒性与骨髓抑制发生率(a.白细胞减少发生率;b.粒细胞减少发生率;c.血小板减少发生率;d.血红蛋白降低/贫血发生率),②肝毒性发生率,③肾毒性发生率,④口腔黏膜炎发生率,⑤消化道毒性发生率,⑥整体不良事件发生率。不良反应分级参照世界卫生组织(WHO)抗癌药物毒副作用分级、美国国家癌症研究所(National Cancer Institute,NCI)常见不良反应评价标准(Common terminology criteria for adverse events,CTCAE)5.0版或其他通用标准,分为轻、中度(G1-2)和重度(G3-4)。
1.1.5 排除标准 重复发表的文献;样本重复的文献仅纳入最新发表的文献;联系作者后仍无法获取全文的文献;结局指标为总生存期(Overall survival,OS)等有效性指标或原发疾病患病风险;未提供基因型分布或不符合哈迪-温伯格平衡(Hardy-Weinberg equilibrium,HWE)[12]的研究;数据有误或缺失的研究。
结合调研结果及我校英语教学现状,校企合作模式下大学英语教学改革应从以下几个方面入手,即改革现有的高校英语教学模式,将英语知识与学生专业知识相融合,建立与专业相结合的大学公共英语教学模式将是未来教学改革的重要聚焦点。而且学校以结合市场为导向,注重学生英语实践能力,更能培养出企业所需的高水平外语人才,实现校企合作“双赢”。
1.2 检索策略
计算机检索Medline、Embase、中国知网、万方数据和中国生物医学文献数据库,补充检索clinicaltrials.gov。检索限定在题目或摘要中进行。英文数据库以“Methotrexate”及其同义词,“Osteosarcoma*”“Osteogenic sarcoma*”等大剂量甲氨蝶呤适应证,“Gene”“Polymorphim”“Methylenetetrahydrofolate reductase”“RFC1”“Pglycoprotein”“Multidrug resistance protein 1”等关键词合并检索。中文数据库以“甲氨蝶呤”及其同义词,“骨肉瘤”等大剂量甲氨蝶呤适应证,“基因”“多态性”“亚甲基四氢叶酸还原酶”“还原叶酸载体”“P-糖蛋白”等关键词合并检索。检索时限均为建库起至2018年3月。同时对纳入文献的参考文献进行手工补充检索。本项系统评价与Meta分析已在PROSPERO平台(网址:http://www.crd.york.ac.uk/PROSPERO/)注 册 ,注 册 号No.CRD42018096992。
1.3 资料提取与质量评价
1.3.1 资料提取 明确和统一文献的纳排标准后,按照题目、摘要和全文的逐级顺序,由2名研究者独立进行文献筛选。完成文献筛选后,2名研究者根据预先设计的资料提取表独立提取纳入文献的基本信息,提取信息包括第一作者、发表年份、患者国家、种族或地区、性别比例、年龄、MTX剂量、基因位点、是否符合HWE平衡(χ2检验)、结局指标及不良反应定义等。若纳入文献中相关数据缺失,通过邮件形式联系通信作者获取数据。出现不一致时,通过讨论或咨询第三方协商解决。
1.3.2 质量评价 2名研究者独立采用Cochrane协作网推荐的纽卡斯尔-渥太华量表(The Newcastle-Ottawa scale,NOS)[13]评价纳入研究的偏倚风险。NOS量表共8个评价条目,满分为9分,其中研究人群选择方面4个条目、组间可比性方面1个条目、结果测量方面3个条目。7~9分为高质量研究,5~6分为中等质量研究,1~4分为低质量研究。如有异议,由第3方(通信作者)参与讨论并解决分歧。
1.4 统计学方法
应用Microsoft Excel 2016软件建立数据库,双人录入并校对。对纳入文献的基因型分布频率进行χ2检验,P>0.05表明样本符合HWE,说明样本具有群体代表性。
首先判断同一结局指标的研究间是否存在明显临床异质性,如纳入人群疾病种类、不良反应定义是否相似。当2项或2项以上文献报道了同一种结局指标且研究间没有明显临床异质性时,采用Cochrane协作网提供的Rev Man 5.3统计软件进行Meta分析。对于无法进行Meta分析的结局指标,进行描述性分析。Meta分析时,分析资料与方法如下:(1)统计学指标,采用比值比(Odds ratio,OR)及其95%置信区间(CI)评估基因多态性与HD-MTX不良反应的相关性;(2)遗传模型,分别计算显性遗传模型(MM/Mmvs.mm)、隐性遗传模型(MMvs.Mm/mm)、等位基因遗传模型(Mvs.m)下的OR及95%CI,其中M为突变型,m为野生型;(3)效应量检验,用Z检验计算OR是否具有统计学意义(P<0.05);(4)统计学模型,所有分析均采用固定效应模型合并OR值;(5)异质性评估,用q检验及I2评价研究间的异质性大小,P异质性>0.10或I2≤50%表明不存在显著异质性,反之,P异质性≤0.10且I2>50%表明异质性明显[14],则进一步分析异质性来源;(6)敏感性分析,逐篇剔除纳入Meta分析的研究,观察剔除的研究对合并效应量的影响,以判断Meta分析的稳定性和可靠性;(7)亚组分析与异质性分析,当研究数量足够时,按不同年龄和种族进行亚组分析,各研究结果存在统计学异质性时,首先排除数据提取错误,观察亚组分析是否可以解释异质性来源,并结合敏感性分析寻找异质性来源,若最终无法明确异质性来源,换用随机效应模型,或行描述性分析;(8)发表偏倚,采用倒漏斗图评估发表偏倚(研究数>10时有效[15])。
2 结果
2.1 纳入研究基本信息
按照相应检索式进行检索,共检出文献1 901篇,手工补充纳入文献4篇,去重764篇,阅读题目和摘要后去除1 129篇,去除研究类型不符合2篇、研究人群不符合1篇、未报道结局指标数据1篇,最终纳入8篇(项)研究[10-11,16-21],其中 4 项研究[10-11,17-18]纳入 Meta分析、4 项研究[16,19-21]仅纳入描述性分析,合计608例患者。8项纳入研究中,3 项研究[10,17,19]对象为亚洲人群,5项研究[11,16,18,20-21]对象为高加索人群,4项研究[11,16-17,21]纳入的患者为儿童,3 项研究[10,19-20]同时纳入了儿童与成人,1 项研究[18]未报道患者年龄范围。剂量方面,8项研究均严格限定为HD-MTX。基因多态性方面,研究MTHFR C677T、MTHFR A1298C、RFC1G80A、MDR1C3435T的研究数量分别为 6[10-11,17-19,21]、5[17-21]、4[16-18,21]、2[16,20]项。经过χ2检验,8项纳入研究均符合HWE平衡。报道的结局指标包括血液毒性、肝毒性、肾毒性及口腔黏膜炎等不良反应,不良反应分级标准多为WHO标准或CTCAE。纳入研究基本信息见表1。

表1 纳入研究基本信息Tab 1 General information of included studies
2.2 方法学质量评价结果

表2 纳入研究的方法学质量评价结果Tab 2 Methodological quality evaluation of included studies
2.3 MTHFR C677T多态性与HD-MTX不良反应的相关性分析
共 6项研究[10-11,17-19,21]评估了MTHFR C677T基因多态性与HD-MTX不良反应的相关性。对于肝毒性、肾毒性、口腔黏膜炎,相关性分析结果见表3。
2.3.1 肝毒性发生率 ①相关性。对于G1-4肝毒性发生率,单项研究提示MTHFR C677T多态性与G1-4肝毒性不存在显著相关性。对于G1-2肝毒性发生率,3种遗传模型下MTHFR C677T多态性与G3-4肝毒性[TT/CTvs.CC:OR=2.02,95%CI(0.85,4.80);TTvs.CT/CC:OR=0.68,95%CI(0.21,2.18);Tvs.C:OR=1.27,95%CI(0.63,2.57)]均无显著相关性。对于G3-4肝毒性发生率,3种遗传模型下MTHFR C677T多态性与G3-4肝毒性[TT/CTvs.CC:OR=0.50,95%CI(0.21,1.18);TTvs.CT/CC:OR=1.47,95%CI(0.46,4.69);Tvs.C:OR=0.79,95%CI(0.39,1.60)]均无显著相关性。亚组分析结果表明,亚洲患儿与高加索患者间的差异不具有显著性(P亚组>0.05),MTHFR C677T与G1-2、G3-4肝毒性相关性的Meta分析森林图见图1、图2。
②敏感性分析、异质性分析与发表偏倚分析。对肝毒性发生率的6个Meta分析结果进行敏感性分析。剔除Park JA等[17]的研究后,显性遗传模型下的两项Meta分析合并效应量发生显著改变,但其他遗传模型下的Meta分析合并效应量均未发生显著改变,整体稳定性与可靠性尚可。同时,肝毒性有关的Meta分析均不存在异质性,P异质性>0.10、I2≤32%。由于Meta分析均只纳入2项研究[17-18],此时倒漏斗图识别发表偏倚的敏感性较低,发表偏倚无法排除。
2.3.2 肾毒性发生率 ①相关性。对于G1-4肾毒性发生率,3种遗传模型下,均有研究表明MTHFR C677T多态性与G1-4肾毒性发生风险有显著相关性(P<0.05)。对于G1-2肾毒性发生率,3种遗传模型下MTHFR C677T多态性与G1-2肾毒性均无显著相关性(P>0.05)。对于G3-4肾毒性发生率,显性遗传模型下MTHFR C677T多态性与G3-4肾毒性有显著相关性[TT/CTvs.CC:OR=12.35,95%CI(3.28,46.42),P<0.001],MTHFR C677T与G3-4肾毒性相关性的Meta分析森林图见图3。
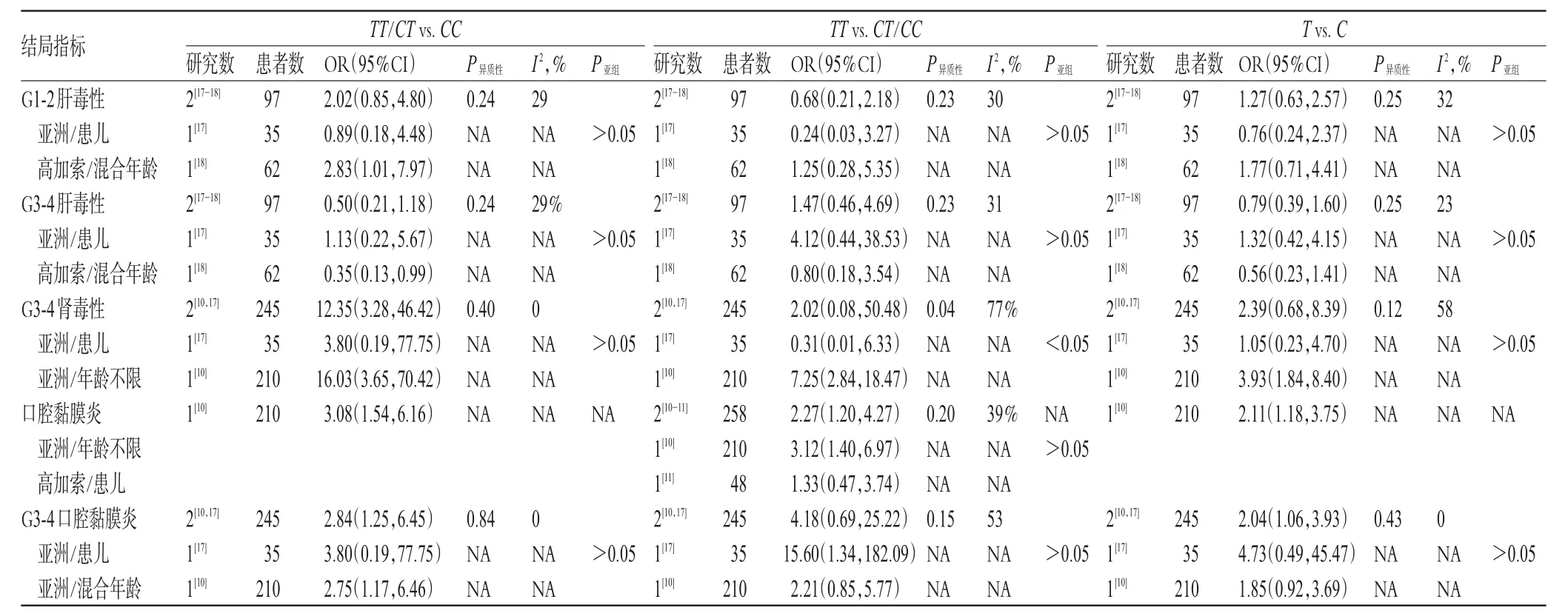
表3 MTHFR C677T基因多态性与肝毒性、肾毒性和口腔黏膜炎的相关性Tab 3 Association between MTHFR C677T gene polymorphism and hepatic toxicity,renal toxicity and oral mucositis

图1 MTHFR C677T与G1-2肝毒性相关性的Meta分析森林图(TT vs.CT/CC)Fig 1 Forest plot for Meta-analysis of association between MTHFR C677T and G1-2 hepatic toxicity(TT vs.CT/CC)

图2 MTHFR C677T与G3-4肝毒性相关性的Meta分析森林图(TT vs.CT/CC)Fig 2 Forest plot for Meta-analysis of association between MTHFR C677T and G3-4 hepatic toxicity(TT vs.CT/CC)

图3 MTHFR C677T与G3-4肾毒性相关性的Meta分析森林图(TT/CT vs.CC)Fig 3 Forest plot for Meta-analysis of association between MTHFR C677T and G3-4 renal toxicity(TT/CT vs.CC)
②敏感性分析、异质性分析与发表偏倚分析。对重度肾毒性发生率的3个Meta分析结果进行敏感性分析。由于Meta分析均只纳入2项研究[10,17],剔除任华益等[10]的研究后,3种遗传模型下的Meta分析合并效应量量均发生显著改变,提示Meta分析稳定性欠佳。此外,隐性遗传模型下的Meta分析存在显著异质性(P异质性=0.04、I2=77%),异质性可能源于患儿和混合人群间的显著差异(P亚组<0.05)。同时,发表偏倚仍无法排除。
2.3.3 口腔黏膜炎发生率 ①相关性。对于G1-4口腔黏膜炎发生率,3种遗传模型下C677T多态性与G1-4口腔黏膜炎发生风险均存在显著相关性,其中隐性遗传模型(TTvs.CT/CC)的OR=2.27,95%CI(1.20,4.27),P=0.01,MTHFR C677T与口腔黏膜炎相关性的Meta分析森林图见图4。

图4 MTHFR C677T与G1-4口腔黏膜炎相关性的Meta分析森林图(TT vs.CT/CC)Fig 4 Forest plot for Meta-analysis of association between MTHFR C677T and G1-4 oral mucositis(TT vs.CT/CC)
对于G1-2口腔黏膜炎发生率,单项研究提示3种遗传模型下C677T多态性与G1-2口腔黏膜炎均无显著相关性(P>0.05)。对于G3-4口腔黏膜炎发生率,C677T多态性与G3-4口腔黏膜炎有显著相关性[TT/CTvs.CC:OR=2.84,95%CI(1.25,6.45),P=0.01;Tvs.C:OR=2.04,95%CI(1.06,3.93),P=0.03],MTHFR C677T与重度口腔黏膜炎相关性的Meta分析森林图见图5、图6。

图5 MTHFR C677T与G3-4口腔黏膜炎相关性的Meta分析森林图(TT/CT vs.CC)Fig 5 Forest plot for Meta-analysis of association between MTHFR C677T and G3-4 oral mucositis(TT/CT vs.CC)

图6 MTHFR C677T与G3-4口腔黏膜炎相关性的Meta分析森林图(T vs.C)Fig 6 Forest plot for Meta-analysis of association between MTHFR C677T and G3-4 oral mucositis(T vs.C)
亚组分析结果表明,高加索与亚洲人群、患儿与混合人群间差异均没有显著性(P亚组>0.05)。
②敏感性分析、异质性分析与发表偏倚分析。对口腔黏膜炎发生率的4个Meta分析结果进行敏感性分析。由于Meta分析均只纳入2项研究,剔除任华益等[10]或Park JA等[17]的研究后,Meta分析合并效应量均发生显著改变,即整体稳定性与可靠性欠佳。上述Meta分析均无显著异质性,P异质性均>0.10。此外,由于纳入研究数量的限制,发表偏倚仍无法排除。
2.3.4 血液毒性、消化道毒性、整体不良事件发生率 ①血液毒性发生率方面,任华益等[10]提示隐性遗传模型下MTHFR C677T多态性与白细胞减少、G3-4白细胞减少的发生风险显著相关(P<0.05),Ana Patino-Garcia等[21]提示MTHFR C677T多态性与G3-4血液毒性的发生风险显著相关(P<0.05),而Lambrecht L等[11]提示MTHFR C677T多态性与粒细胞减少、血小板减少、血红蛋白降低均无显著相关性(P>0.05)。②消化道毒性发生率方面,Jabeen S等[18]提示MTHFR C677T多态性与消化道毒性显著相关(P<0.05)。③整体不良事件发生率方面,周新科等[19]提示MTHFR C677T多态性与整体不良事件无显著相关性(P>0.05)。
2.4 MTHFR A1298C多态性与HD-MTX不良反应的相关性分析
5项研究[17-21]报道了MTHFR A1298C基因多态性与HD-MTX不良反应的相关性。仅单项研究报道了相关结局指标的具体数据,因此进行描述性分析。(1)血液毒性发生率方面,Windsor RE等[20]的研究中MTHFR A1298C多态性与血红蛋白降低显著相关(P<0.05),而Ana Patino-Garcia等[21]研究中表明无此相关性。(2)肝毒性发生率方面,Park JA等[17]与Jabeen S等[18]提示,MTHFR A1298C多态性与肝毒性、G1-2肝毒性、G3-4肝毒性均无显著相关性(P>0.05)。(3)肾毒性发生率方面,Park JA 等[17]与 Ana Patino-Garcia 等[21]提 示 ,MTHFR A1298C多态性与肾毒性、G1-2肾毒性、G3-4肾毒性(AA/ACvs.CC:OR=0.52)均无显著相关性(P>0.05)。(4)口腔黏膜炎发生率方面,Park JA等[17]与Jabeen S等[18]提示,MTHFR A1298C多态性与口腔黏膜炎、G1-2口腔黏膜炎、G3-4口腔黏膜炎(AA/ACvs.CC:OR=0.40)均无显著相关性(P>0.05)。(5)消化道毒性发生率方面,Ana Patino-Garcia等[21]提示无显著相关性(P>0.05)。(6)整体不良事件发生率方面,周新科等[19]也提示无显著相关性(P>0.05)。
2.5 RFC1 G80A多态性与HD-MTX不良反应的相关性分析
4项研究[16-18,21]报道了RFC1G80A基因多态性与HD-MTX不良反应的相关性。仅单个研究报道了相关结局指标的具体数据,因此进行描述性分析。(1)血液毒性发生率方面,2项研究[16,21]提示无显著相关性(P>0.05)。(2)肝毒性发生率方面,3项研究[16-18]提示,RFC1G80A多态性与肝毒性、G1-2肝毒性、G3-4肝毒性(AA/GAvs.GG:OR=0.27)无显著相关性(P>0.05)。(3)肾毒性发生率方面,2项研究[17,21]提示,RFC1G80A多态性与肾毒性、G1-2肾毒性、G3-4肾毒性(AA/GAvs.GG:OR=0.81)无显著相关性(P>0.05)。(4)口腔黏膜炎发生率方面,Park JA等[17]提示亚洲患儿中RFC1G80A多态性与G1-2口腔黏膜炎(AA/GAvs.GG:OR=16.80)、G3-4口腔黏膜炎(AA/GAvs.GG:OR=0.06)显著相关(P<0.05),而在Jabeen S等[18]的研究中无显著相关性。(5)消化道毒性发生率方面,Ana Patino-Garcia等[21]提示RFC1G80A多态性与消化道毒性无显著相关性(P>0.05)。
2.6 MDR1 C3435T多态性与HD-MTX不良反应的相关性分析
仅2项研究[16,20]报道了高加索人群中MDR1C3435T多态性与HD-MTX不良反应的相关性。Windsor RE等[20]指出,MDR1C3435T多态性与口腔黏膜炎发生风险有显著相关性(CCvs.TT:OR=7.5,P<0.05)。而Hegyi M等[16]提示,MDR1C3435T多态性与血液毒性、肝毒性无显著相关性(Tvs.C:P>0.05)。
3 讨论
3.1 基因多态性与HD-MTX不良反应的相关性
基于对 6 项研究[10-11,17-19,21]的 Meta分析和描述性分析,本研究发现,骨肉瘤患者中MTHFR C677T突变可能导致HD-MTX不良反应的发生风险增加,如G3-4血液毒性、肾毒性、G3-4肾毒性、口腔黏膜炎、G3-4口腔黏膜炎、消化道毒性等,但不包括恶性血液肿瘤患者中与MTHFR C677T显著相关的肝毒性[22-23]。受Meta分析纳入的研究数量限制,亚组分析未能充分开展,但基于年龄分层的亚组分析表明,MTHFR C677T与HD-MTX特定不良反应(G3-4肾毒性)的相关性还可能受年龄影响。基于对5项研究[17-21]的Meta分析和描述性分析,本文发现MTHFR A1298C多态性可能与更低的G3-4毒性风险有关,如G3-4肝毒性、G3-4肾毒性、G3-4口腔黏膜炎,但均无统计学意义。总体来说,骨肉瘤患者中MTH-FR C677T突变可能导致HD-MTX不良反应发生风险增加,而MTHFR A1298C多态性可能导致不良反应发生风险降低(但无统计学意义),这与血液恶性肿瘤患者中系统评价的研究相关结果[7,22-23]大体一致。
基于对4项研究[16-18,21]的描述性分析,本文发现骨肉瘤患者中RFC1G80A多态性与HD-MTX不良反应无显著相关性,与血液恶性肿瘤患者中系统评价的研究结果类似[24],但相关性还可能受种族、年龄、不良事件的定义与分级影响。基于对2项研究[16,20]的描述性分析,仅纳入较小样本量的单个研究提示MDR1C3435T突变可能降低口腔黏膜炎发生风险,但其他结局指标中均无相关性。总体来看,由于受纳入研究数量与质量的限制,RFC1G80A或MDR1C3435T多态性与HD-MTX不良反应的相关性仍不明确。
3.2 HD-MTX相关不良反应的发生机制
同多数药源性不良反应类似,HD-MTX引起不良反应的机制也尚不明确。MTX的血浆蛋白结合率约50%,部分经肝细胞代谢转化为多聚谷氨酸化的MTX(PGMTX),PGMTX被认为是MTX发挥抗增殖活性的活性物[25]。MTX几乎90%通过肾经尿液以原型排泄,少量药物以原型排泄入胆汁并进入肠肝循环,大约10%原型药物会由肝的醛氧化酶代谢为7-羟基MTX(7-OHMTX)[26]。大部分MTX会在给药后12 h内排泄,少量MTX及其代谢产物以结合型(PGMTX、7-OHMTX)贮存于肾和肝等组织中。HD-MTX相关不良反应多见于代谢与增殖迅速的组织,如骨髓、肝、肾、消化道等,HD-MTX对不同系统、器官产生损伤的机制可能不一致。由于MTX对上皮细胞具有直接损伤作用,口腔黏膜炎常是HD-MTX毒性反应的最早期症状,且与较高水平的MTX血药浓度有关[27]。而HD-MTX相关的肝、肾损伤则可能与蓄积在肝、肾组织的PGMTX、7-OHMTX有关,不一定因较高的MTX血药浓度引起。与游离MTX相比,PGMTX对二氢叶酸还原酶(DHFR)的结合亲和力更强,抑制作用更强,且更易于在细胞内蓄积,因此PGMTX的抗增殖活性更强,也导致不良反应发生风险更高、程度更严重[28]。与游离MTX相比,7-OHMTX对DHFR抑制作用较弱,但因水溶性较差,易于在肾内沉积、进而导致肾损害[29]。
3.3 本研究的优势、意义与局限性
目前,尚无针对骨肉瘤患者中上述基因多态性和HD-MTX不良反应相关性的系统评价。HD-MTX用于骨肉瘤时剂量可达10 g/m2,剂量为恶性血液肿瘤患者中3倍以上,更高的MTX血药浓度和更长的暴露时间导致骨肉瘤患者中MTX代谢产物(如PGMTX、7-OHMTX)水平显著高于恶性血液肿瘤患者,因此二者不良反应发生率与严重程度也有所不同。本研究首次系统回顾并整合了骨肉瘤患者的有关研究证据,但尚存在以下局限性:目前相关的原始研究数与样本量均较少,未能充分开展亚组分析,Meta分析结果的稳定性一般,且发表偏倚无法排除,仍需要进一步扩大样本验证本研究结论。此外,不同研究间结局指标的分级与定义存在差异,且部分研究未报告结局指标具体数值,所以部分结局指标无法纳入Meta分析,只可进行描述性分析。因此,仍需要多中心、更大样本量、更高质量的原始研究评估骨肉瘤中相关基因多态性对HD-MTX不良反应的影响。
综上所述,骨肉瘤患者中MTHFR C677T突变可能导致HD-MTX不良反应(如G3-4血液毒性、肾毒性、口腔黏膜炎、消化道毒性)发生风险增加,MTHFR A1298C多态性与HD-MTX不良反应无显著相关性。RFC1G80A或MDR1C3435T多态性与HD-MTX不良反应的相关性尚不明确。临床用药时,应结合MTHFR基因的检测结果与患者个体的临床情况,综合评估HD-MTX不良反应发生风险,必要时进行剂量调整,以最大限度地保证HD-MTX临床用药的安全性,最终改善骨肉瘤患者的临床结局。
