HPLC法同时测定大黄药材中8个非蒽醌类成分的含量Δ
2019-08-13陆文瑾窦志华曹瑞倪丽丽戴莹宜兴市第二人民医院药剂科江苏宜兴214221南通大学附属南通第三医院药学部江苏南通226006南京中医药大学药学院南京21002
陆文瑾,窦志华,曹瑞,倪丽丽,戴莹(1.宜兴市第二人民医院药剂科,江苏宜兴214221;2.南通大学附属南通第三医院药学部,江苏南通 226006;.南京中医药大学药学院,南京 21002)
大黄为蓼科植物掌叶大黄(Rheum palmatumL.)或唐古特大黄(Rheum tanguticumMaxim.et Balf.)或药用大黄(Rheum officinaleBail.)的干燥根和根茎[1],是世界范围内广泛应用的中草药之一[2-3]。我国国家药品标准中的800多个中成药处方中均含有大黄,故其质量的优劣可影响用药的有效性和安全性[4-5]。2015年全国范围内的抽检结果显示,目前市场上流通的大黄药材合格率仅约为80%,其检验项目包括性状、显微鉴别、薄层鉴别、土大黄苷检查、总灰分检查、游离型蒽醌类成分含量测定等[6]。大黄中含有蒽醌类及蒽酮类、鞣质类、二苯乙烯类、苯丁酮类等非蒽醌类成分[7],但部分研究仅以大黄酸、大黄素、大黄酚、芦荟大黄素和大黄素甲醚等蒽醌类成分作为评价大黄质量的指标,存在一定的局限性[8],而大黄中含有的非蒽醌类成分也同样具有一定的药理作用[9]。如蒽酮类成分泻下作用最强[10],收敛止血作用主要为鞣质类成分[11],二苯乙烯苷类成分具有抗氧化、抗肿瘤、保肝、调脂、预防并治疗动脉粥样硬化作用[12],苯丁酮苷类是大黄中具有活性的一类重要化合物[13]。2015年版《中国药典》(一部)[1]仅对大黄药材中5个游离型蒽醌类成分的含量作出规定:不得少于0.20%,其酸解后的总蒽醌含量不得少于1.5%;《欧洲药典》(9.0版)[14]也仅规定了总蒽醌含量不得少于2.2%。鉴于对单一组分的检测尚无法全面评价大黄的质量,因此增加非蒽醌类成分的含量测定对大黄质量标准的完善具有重要意义[15]。
本课题组前期建立了22批大黄药材的高效液相色谱(HPLC)指纹图谱,并在280 nm波长处得到了41个共有峰,通过外标法测定了5个游离型蒽醌和总蒽醌的含量,通过一测多评法测定了8个结合型蒽醌的含量[16]。在此基础上,本研究建立了同时测定大黄药材中没食子酸、儿茶素、表儿茶素、白藜芦醇4′-O-葡萄糖苷、表儿茶素没食子酸酯、白藜芦醇4′-O-β-D-(6″-O-没食子酰)-葡萄糖苷、番泻苷A、4′-羟基苯基-2-丁酮-4′-O-β-D-(2″-O-没食子酰-6″-O-对羟基桂皮酰)-葡萄糖苷等8个非蒽醌类成分含量的HPLC法,旨在为建立更全面的大黄质量评价标准提供参考。
1 材料
1.1 仪器
Alliance e2695型HPLC仪,包括e2695型分离单元、2998型二极管阵列检测器、Empower 3色谱工作站(美国Waters公司);SK5200H型超声波清洗器(上海科导超声仪器有限公司);BT 25S型十万分之一电子天平(德国Sartorius公司)。
1.2 药品与试剂
没食子酸对照品(批号:150226,纯度:≥98%)、儿茶素对照品(批号:141224,纯度:≥98%)、表儿茶素对照品(批号:140730,纯度:≥98%)、表儿茶素没食子酸酯对照品(批号:140923,纯度:≥98%)、番泻苷A对照品(批号:CHB170508,纯度:≥98%)均购自成都克洛玛生物科技有限公司;白藜芦醇4′-O-葡萄糖苷对照品(批号:38963-95-0,纯度:98%)、白藜芦醇4′-O-β-D-(6″-O-没食子酰)-葡萄糖苷对照品(批号:92834097-0,纯度:98%)、4′-羟基苯基-2-丁酮-4′-O-β-D-(2″-O-没食子酰-6″-O-对羟基桂皮酰)-葡萄糖苷(批号:950184-00-6,纯度:98%)均购自上海一林生物科技有限公司;甲醇为色谱纯,其他试剂均为分析纯,水为纯净水。
1.3 药材
22批大黄药材中S2、S18、S22为中国食品药品检定研究院标准药材粉末,S21购自南通三越中药饮片有限公司,其余药材样品均由南通市食品药品监督中心葛建华主任中药师馈赠。除标准药材外,其余19批均由葛建华主任中药师鉴定为蓼科植物掌叶大黄(R.palmatumL.)或唐古特大黄(R.tanguticumMaxim.et Balf.)或药用大黄(R.officinaleBail.)的干燥根和根茎。除标准药材粉末,其余药材均粉碎成粉末,过四号筛,备用。大黄药材来源见表1。

表1 大黄药材来源Tab 1 Source of Rheum palmatum
2 方法与结果
2.1 色谱条件
色谱柱:Symmetry C18(250 mm×4.6 mm,5 μm);流动相:甲醇(A)-0.1%磷酸水溶液(B),梯度洗脱(0~10 min,5%A→30%A;10~40 min,30%A→60%A;40~60 min,60%A;60~70 min,60%A→100%A;70~80 min,100%A);检测波长:280 nm;流速:1.0 mL/min;柱温:30℃;进样量:30 μL。在该色谱条件下,分离度均大于1.5,理论板数以没食子酸计均不低于8 000,空白对照对测定无干扰,详见图1。

图1 高效液相色谱图Fig 1 HPLC chromatograms
2.2 溶液的制备
2.2.1 供试品溶液 取样品粉末约0.15 g,精密称定,置于25 mL量瓶中,加甲醇24 mL,超声(功率:200 W,频率:53 kHz)处理30 min,冷却后,加甲醇定容至刻度,摇匀,经0.45 μm微孔滤膜滤过,取续滤液,即得。
2.2.2 对照品溶液 精密称取儿茶素对照品9.35 mg、白藜芦醇4′-O-β-D-(6″-O-没食子酰)-葡萄糖苷对照品4.6 mg,分别置于2 mL量瓶中;另取没食子酸对照品6.16 mg、表儿茶素没食子酸酯对照品4.16 mg、番泻苷A对照品8.04 mg、白藜芦醇4′-O-葡萄糖苷对照品5.45mg、4′-羟基苯基-2-丁酮-4′-O-β-D-(2″-O-没食子酰-6″-O-对羟基桂皮酰)-葡萄糖苷对照品11.72 mg,分别置于5 mL量瓶中;另取表儿茶素对照品5.09 mg,置于10 mL量瓶中;分别加甲醇溶解并定容至刻度,摇匀,得各单一对照品贮备液。分别精密量取上述没食子酸对照品贮备液、白藜芦醇4′-O-β-D-(6″-O-没食子酰)-葡萄糖苷对照品贮备液各0.5 mL,白藜芦醇4′-O-葡萄糖苷对照品贮备液0.7 mL,儿茶素对照品贮备液0.8 mL,表儿茶素没食子酸酯对照品贮备液、番泻苷A对照品贮备液各1.0 mL,4′-羟基苯基-2-丁酮-4′-O-β-D-(2″-O-没食子酰-6″-O-对羟基桂皮酰)-葡萄糖苷对照品贮备液1.25mL,表儿茶素对照品贮备液1.5 mL,置于同一10 mL量瓶中,加甲醇定容至刻度,摇匀,制得没食子酸、儿茶素、表儿茶素、白藜芦醇4′-O-葡萄糖苷、表儿茶素没食子酸酯、白藜芦醇4′-O-β-D-(6″-O-没食子酰)-葡萄糖苷、番泻苷A、4′-羟基苯基-2-丁酮-4′-O-β-D-(2″-O-没食子酰-6″-O-对羟基桂皮酰)-葡萄糖苷质量浓度分别为0.061 6、0.374、0.076 35、0.076 3、0.083 2、0.115、0.160 8、0.293 mg/mL的混合对照品贮备液。精密量取上述混合对照品贮备液1 mL,置于25 mL量瓶中,加甲醇定容至刻度,摇匀,即得没食子酸、儿茶素、表儿茶素、白藜芦醇4′-O-葡萄糖苷、表儿茶素没食子酸酯、白藜芦醇4′-O-β-D-(6″-O-没食子酰)-葡萄糖苷、番泻苷A、4′-羟基苯基-2-丁酮-4′-O-β-D-(2″-O-没食子酰-6″-O-对羟基桂皮酰)-葡萄糖苷质量浓度分别为0.002 464、0.014 96、0.003054、0.003 052、0.003 328、0.004 6、0.006 432、0.011 72 mg/mL的混合对照品溶液。
2.2.3 空白对照溶液 以甲醇为空白对照。
2.3 线性关系考察
分别精密量取“2.2.2”项下混合对照品溶液2.5、12.5、25 μL及混合对照品贮备液 5、10、20、30、40 μL,按“2.1”项下色谱条件进样测定,记录峰面积。以待测成分进样量(x,ng)为横坐标、峰面积(y)为纵坐标进行线性回归,回归方程与线性范围见表2。
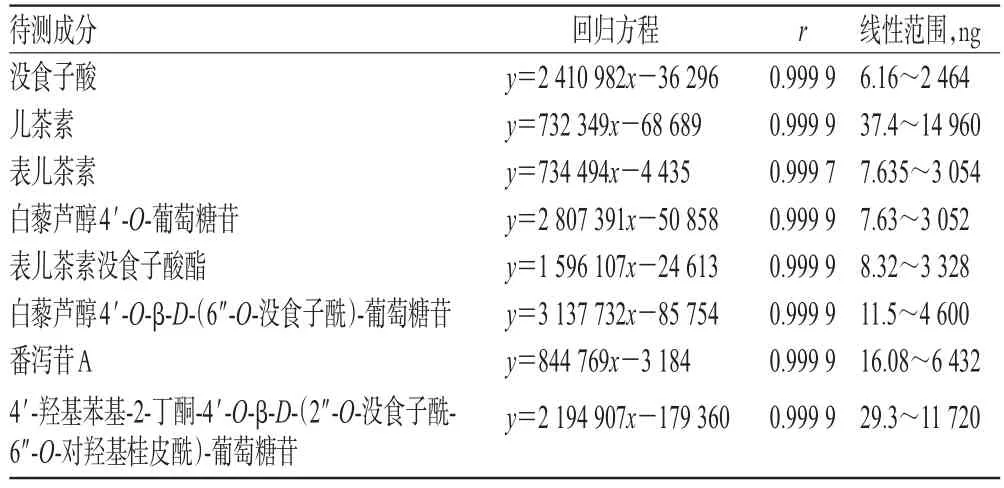
表2 回归方程与线性范围Tab 2 Regression equations and linear ranges
2.4 定量限与检测限考察
精密量取“2.2.2”项下混合对照品溶液适量,倍比稀释,以信噪比10∶1、3∶1分别计算定量限、检测限。结果,没食子酸、儿茶素、表儿茶素、白藜芦醇4′-O-葡萄糖苷、表儿茶素没食子酸酯、白藜芦醇4′-O-β-D-(6″-O-没食子酰)-葡萄糖苷、番泻苷A、4′-羟基苯基-2-丁酮-4′-O-β-D-(2″-O-没食子酰-6″-O-对羟基桂皮酰)-葡萄糖苷的定量限分别为 3.48、4.30、6.40、4.40、3.39、2.87、8.40、4.95 ng,检测限分别为2.32、2.58、2.40、2.64、2.26、1.23、4.20、2.97 ng。
2.5 精密度试验
取“2.2.2”项下混合对照品贮备液适量,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,没食子酸、儿茶素、表儿茶素、白藜芦醇4′-O-葡萄糖苷、表儿茶素没食子酸酯、白藜芦醇4′-O-β-D-(6″-O-没食子酰)-葡萄糖苷、番泻苷A、4′-羟基苯基-2-丁酮-4′-O-β-D-(2″-O-没食子酰-6″-O-对羟基桂皮酰)-葡萄糖苷峰面积的RSD分别为1.66%、1.72%、2.27%、1.76%、2.29%、1.81%、2.53%、1.96%(n=6),表明仪器精密度良好。
2.6 稳定性试验
取“2.2.1”项下供试品溶液(编号:S21)适量,分别于室温下放置0、3、6、12、18、24 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,没食子酸、儿茶素、表儿茶素、白藜芦醇4′-O-葡萄糖苷、表儿茶素没食子酸酯、白藜芦醇4′-O-β-D-(6″-O-没食子酰)-葡萄糖苷、番泻苷A、4′-羟基苯基-2-丁酮-4′-O-β-D-(2″-O-没食子酰-6″-O-对羟基桂皮酰)-葡萄糖苷峰面积的RSD分别为4.84%、4.20%、4.14%、4.72%、4.16%、4.33%、1.36%、1.96%(n=6),表明供试品溶液于室温下放置24 h内稳定性良好。
2.7 重复性试验
取样品粉末(编号:S21),共6份,每份约0.15 g,精密称定,按“2.2.1”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品中8个成分的含量。结果,没食子酸、儿茶素、表儿茶素、白藜芦醇4′-O-葡萄糖苷、表儿茶素没食子酸酯、白藜芦醇4′-O-β-D-(6″-O-没食子酰)-葡萄糖苷、番泻苷A、4′-羟基苯基-2-丁酮-4′-O-β-D-(2″-O-没食子酰-6″-O-对羟基桂皮酰)-葡萄糖苷的平均含量分别为0.442、4.580、0.060、0.314、1.280、0.377、3.953、1.000 mg/g,RSD分别为1.53%、3.65%、1.23%、2.21%、2.29%、1.47%、2.59%、2.91%(n=6),表明本方法重复性良好。
2.8 加样回收率试验
取已知含量的样品粉末(编号:S21),共6份,每份约0.075 g,分别加入一定量的各单一对照品贮备液适量,按“2.2.1”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表3。
2.9 耐用性试验
取样品粉末(编号:S21)适量,按“2.2.1”项下方法制备供试品溶液,再按“2.1”项下色谱条件[流动相B不同浓度比例(0.05%磷酸水溶液、0.10%磷酸水溶液、0.15%磷酸水溶液)、不同流速(0.9、1.0、1.1 mL/min)、不同柱温(20、25、30 ℃)]进样测定,记录峰面积并按标准曲线法计算样品中8个成分的含量,结果见表4。结果表明,该方法能够满足试验要求,耐用性良好。
2.10 样品含量测定
取22批样品粉末适量,按“2.2.1”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算各批样品中8个成分的含量,结果见表5。

表3 加样回收率试验结果(n=6)Tab 3 Results of recovery tests(n=6)
3 讨论
有研究指出,在280 nm波长处,大黄成分检出最为全面[17]。鉴于此,本研究在200~800 nm波长范围内对样品进行了全波长扫描。结果发现,8个待测成分在280 nm波长处均有较强吸收,故选择280 nm作为检测波长。同时,笔者又考察了甲醇-0.1%磷酸水溶液、乙腈-0.1%磷酸水溶液两种流动相体系对待测成分分离情况的影响。结果发现,以甲醇-0.1%磷酸水溶液为流动相时的出峰数目较多,且分离度良好,故选择甲醇-0.1%磷酸水溶液作为本研究的流动相。
虽然有研究采用HPLC法同时测定了大黄中2个蒽酮、3个鞣质和4个苯丁酮类成分含量[18],4个苯丁酮类成分含量[19],2个蒽酮和2个鞣质类成分含量[4,20],1个蒽酮和2个鞣质类成分含量[21]以及2个苯丁酮类和1个二苯乙烯类成分的含量[22],但均未建立鞣质类成分表儿茶素和二苯乙烯类成分白藜芦醇4′-O-β-D-(6″-O-没食子酰)-葡萄糖苷含量的测定方法。本研究结果显示,大黄药材样品中这两个成分的含量较高,分别为0.060~16.700、0.341~16.966 mg/g,因此有必要对其进行定量分析。
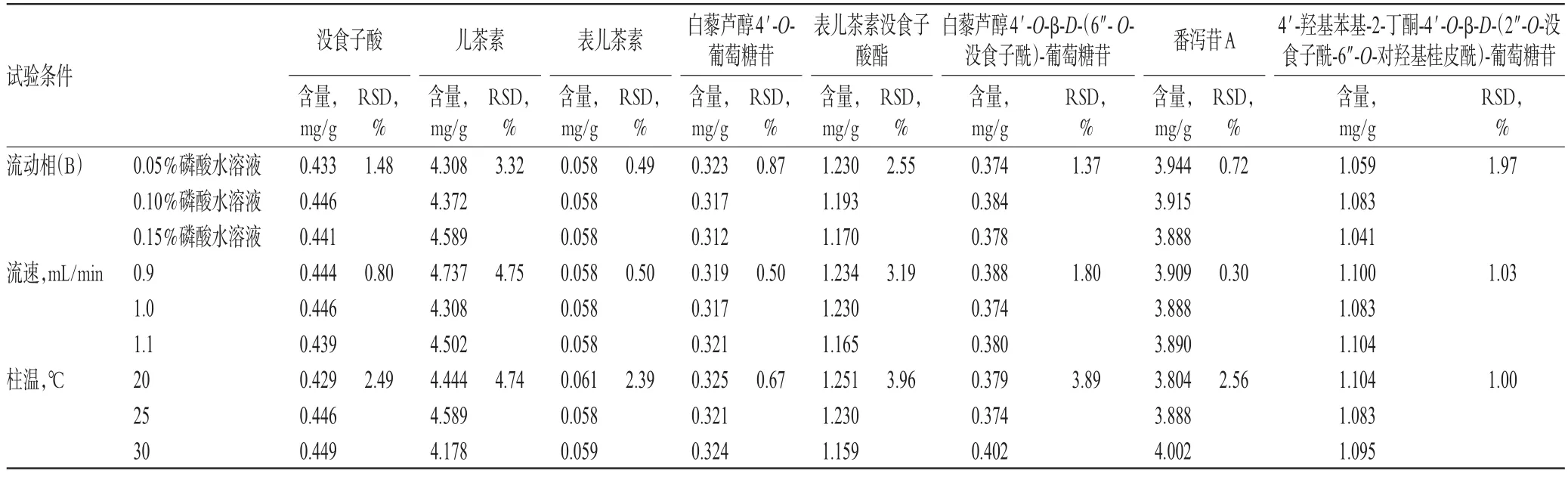
表4 耐用性试验结果Tab 4 Results of durability tests
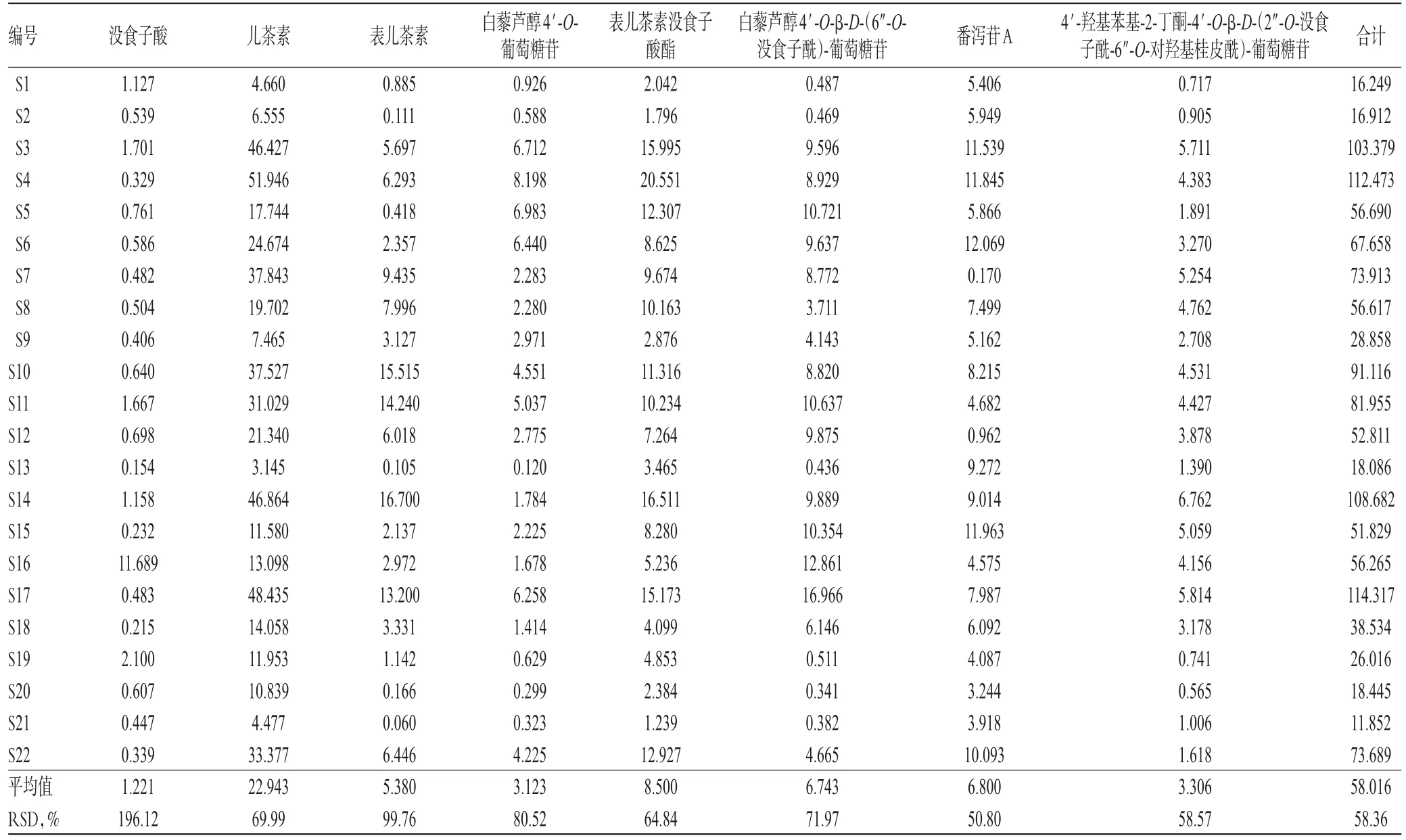
表5 样品含量测定结果(n=3,mg/g)Tab 5 Results of content determination of samples(n=3,mg/g)
含量测定结果显示,22批大黄药材中8个成分含量存在较大差异,S1、S2、S21中8个成分的含量相对较低,而S3、S4、S14、S17含量相对较高,其含量差异可能与药材原植物的生长年限有关。本课题组在大黄产区考察发现,药用大黄、掌叶大黄和唐古特大黄的生长年限一般分别为1、3、5年;同一基源、同一产区的成分含量也会存在较大差异,这可能与其生长环境如海拔、经度、纬度、光照、种子遗传等有关[4,23-24]。
综上所述,本研究所建方法简便、准确、专属性强,可用于同时测定大黄药材中8个非蒽醌类成分的含量。
