2型糖尿病合并非酒精性脂肪性肝病患者肝脏硬度和脂肪变性程度研究
2019-08-12叶春艳李文坚
张 凡 叶春艳 何 军 韩 艳 李文坚
近年来,随着不良生活习惯的增加和饮食结构的改变,我国肥胖患者日益增多,且趋向低龄化。2型糖尿病(type 2 diabetes mellitus,T2DM)合并非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的发生率也逐年增加,并且多数存在代谢综合征。目前NAFLD患者的肝脏发生脂肪变性及进一步纤维化和肝硬化的机制,并不完全清楚。肝脏活检是评价肝纤维化的金标准,但肝活检是有创的,且肝组织活检标本受取样误差影响易导致肝纤维化准确性不足及肝硬化漏诊,并不适于推广为NAFLD患者常规检查手段。瞬时弹性成像技术(transient elastography,TE)可通过测量肝脏硬度值(liver stiffness measurement,LSM)反映肝纤维化程度,通过受控衰减参数(controlled attenuation parameter,CAP)定量检测肝脂肪变。由于其具有无创、简便、快速、易于操作、可重复性、安全性和耐受性好的特点,目前已被多个国家用于NAFLD患者临床评估的重要手段。本研究纳入198例T2DM合并NAFLD患者,利用FibroScan瞬态弹性成像技术评估患者肝脏脂肪变性和纤维化程度。
资料与方法
1.研究对象:前瞻性纳入2017年2月~2018年7月常州市第三人民医院诊断为T2DM合并NAFLD的住院患者198例。T2DM 的诊断均符合1999年WHO及国际糖尿病联盟(IDF)制定的诊断标准。NAFLD诊断符合2010年《非酒精性脂肪性肝病诊疗指南》标准,超声诊断弥漫性脂肪肝至少符合以下判定标准中的两项:①肝脏有弥漫性的回声增强;②肝脏内管道结构不清;③肝区远场超声束回声衰减。排除标准:①<18岁;②每周饮酒折合酒精量>140g(男性)或70g(女性);③除外病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性、自身免疫性肝病等可导致脂肪肝的特定疾病;④孕妇;⑤肝脏占位性病变;⑥置入有心脏起搏器;⑦拒绝行FibroScan检查。所有受试者均签署知情同意书并经常州市第三人民医院伦理学委员会批准。
2.人口学特征及生化指标测定:常规测量患者身高、体重,计算体重指数(body mass index,BMI)=体重/身高2(kg/m2)。参考国家卫生健康委员会(原卫生部)中国超重和肥胖症预防控制指南定义,BMI<18.5 kg/m2为体重过低;18.5~23.9kg/m2为正常体重;24.0~27.9kg/m2为超重;≥28.0kg/m2为肥胖。测量患者血压,收缩压<140mmHg(1mmHg=0.133kPa)且舒张压<90mmHg为正常血压;收缩压140~159mmHg和(或)舒张压90~99mmHg为1级高血压(轻度);收缩压160~179mmHg和(或)舒张压100~109mmHg为2级高血压(中度);收缩压≥180mmHg和(或)舒张压≥110mmHg为3级高血压(重度)。全自动生物化学分析仪(7600S)检测空腹血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、谷氨酰转肽酶(GGT)、碱性磷酸酶(ALP)、总胆红素(TBIL)、甘油三酯(TG)、总胆固醇(CHOL)、白蛋白(ALB)、糖化血红蛋白(HbA1c)等指标。
3.LSM及CAP测定:使用FibroScan-502机型(法国Echosens公司)M型探头同时完成LSM及CAP测定,分别用于无创定量评价肝纤维化及脂肪变程度。测量时患者仰卧,右手放在头后,暴露肝右叶区的肋间隙。通常取剑突水平线、右腋中线及肋骨下缘所包围的区域为检测区域。探头垂直紧贴于皮肤,于肋间隙选定测量位置, 检查者按探头按钮开始采集图像并获得测量值。10次成功测定值的中位数即为最终测定值,对于有效TE检测,要求操作成功率≥60%且四分位数间距(inter quartile range,IQR)/中位数(median)即IQR/M≤0.3。依LSM值将肝纤维化分为4个等级[1]:<7.0kPa为F0F1(无或轻微纤维化);7.0~8.6kPa为F2(显著纤维化);8.7~10.2kPa为F3(进展期纤维化);≥10.3kPa为F4(肝硬化)。依CAP值将肝脂肪变分为4个等级:<238dB/m为S0(无肝脂肪变);238~258dB/m为S1(轻度肝脂肪变);259~291dB/m为S2(中度肝脂肪变);≥292dB/m为S3(重度肝脂肪变)。
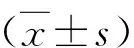
结 果
1.一般情况:本次前瞻性纳入诊断为T2DM合并NAFLD的住院患者共198例,其中21例LSM测定失败,6例血清检测不完整,共171例(86.4%)患者纳入分析。患者一般情况、生化指标、纤维化及脂肪变情况见表1。
2.CAP值及LSM值分析:所有患者的CAP值为315.2±42.5dB/m,不同肝脂肪变等级的CAP值分别为:S0:187.8±22.1dB/m;S1:251.4±6.1dB/m;S2:277.4±9.1dB/m;S3:335.6±27.0dB/m。所有患者的LSM值为中位数为6.8kPa,IQR为5.1~9.0kPa,不同肝脂肪变等级的LSM值分别为:S0:中位数为3.6kPa,IQR为2.8~3.7kPa;S1:中位数为4.6kPa,IQR为4.2~5.6kPa; S2:中位数为5.3kPa,IQR为4.2~6.2kPa;S3:中位数为7.7kPa,IQR为6.0~10.1kPa。

表1 171例T2DM合并NAFLD患者的一般情况 [n(%),M(IQR)]
171例患者中,有4.1%(7/171)患者有轻度脂肪变性,有21.6%(37/171)患者有中度脂肪变性,有71.3%(122/171)患者重度脂肪变性。有28.7%(49/171)患者存在显著肝纤维化(F2~F3,7.0~10.2kPa),有17.5%(30/171)患者LSM值提示肝硬化(F4,≥10.3kPa)。与没有或轻中度脂肪变性(S0~S2)患者比较,重度脂肪变性(S4)患者中显著肝纤维化(LSM:7.0~10.2kPa)比例及肝硬化(LSM≥10.3kPa)比例均更高,差异有统计学意义,详见表2。

表2 不同肝脂肪变性程度患者肝纤维化程度比较 [n(%)]
3.肝纤维化危险因素单因素及多因素Logistic回归分析:以LSM≥7kPa与患者年龄、性别、BMI、高血压、ALT、AST、GGT、ALP、TBIL、TG、CHOL、ALB、HbA1c、CAP做单因素Logistic回归分析,结果提示高BMI、高ALT、高AST及高CAP值可能是肝纤维化发生的独立危险因素,而患者年龄、性别、血压、GGT、ALP、TBIL、TG、CHOL、ALB、HbA1c跟肝纤维化没有直接关联。因AST与ALT存在较强的共线性,故只保留ALT,以LSM≥7kPa与年龄、性别、BMI、高血压、ALT、GGT、ALP、TBIL、TG、CHOL、ALB、HbA1c、CAP做多因素Logistic回归分析,结果提示高ALT和高CAP值可能是肝纤维化发生的独立危险因素,详见表3。
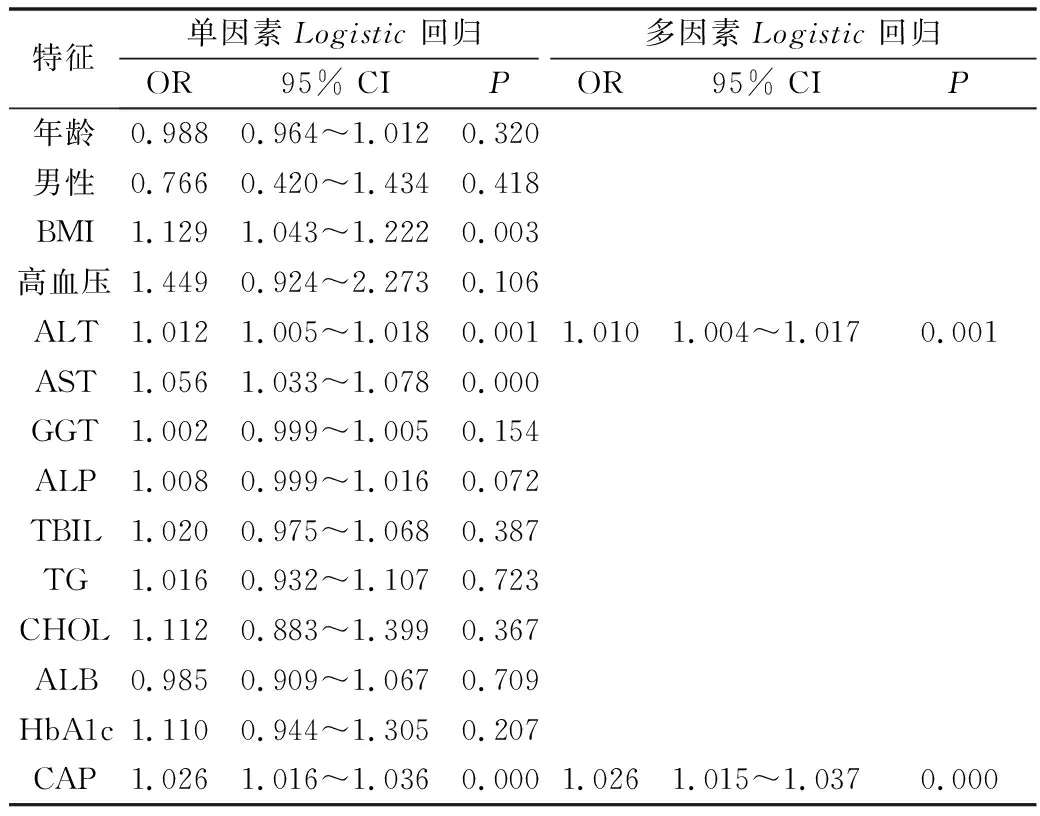
表3 肝纤维化危险因素单因素及多因素Logistic回归分析
讨 论
既往研究认为,肝脏脂肪变性是由于T2DM和肥胖患者存在胰岛素抵抗造成的[2]。但一些研究表明,在很多病例里,脂肪变性先于血糖升高及代谢综合征发生[3,4]。因此,非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)和T2DM之间可能存在一种双向的因果关系[5,6]。NAFLD患者有较高比率会发展为非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH),进一步发展为肝硬化。目前多数医生和患者对于影响患者生命和生活质量的糖尿病的并发症越来越重视,但是既往更多关注心血管等方面的问题,肝脏作为一个新的靶器官受到了越来越多的关注。随着现代人的饮食习惯和生活方式的改变,肥胖的群体日益庞大,越来越多的糖尿病患者出现肝酶(ALT/AST)升高,而肝脏超声检查也会发现不同程度的脂肪变性。
随着治疗慢性丙型肝炎病毒(HCV)感染和控制慢性乙型肝炎病毒(HBV)复制的有效药物的不断开发,由于肝炎病毒感染引起的肝硬化的比率正逐年降低。而T2DM的发生率呈逐年增加趋势,全世界预计在2030年达到7.7%,在T2DM患者中NAFLD的发生率很高,达到近60%,脂肪变性引起的肝硬化比率将越来越高[7,8]。NASH患者患肝细胞癌的风险很高,估计达0.3%/年,所以早期诊断和分期筛选十分重要[9]。
在大多数病例里,脂肪变性是发展成为NASH的第一步。笔者利用FibroScan的CAP这一非侵入性的工具对患者肝脏脂肪变性分级评估。研究证实CAP在鉴别中重度肝脂肪变有较高的敏感度和特异性,在鉴别中度肝脂肪变时的准确性达到93%,而鉴别重度肝脂肪变的准确性为94%[10]。本研究中有97.1%的患者有脂肪变性,其中中度和重度的病例有93.0%。
T2DM合并NAFLD的患者,如果疑似为NASH,应建议行肝脏组织活检。但由于糖尿病的发生率很高,常规开展肝活检很难实现,TE被越来越多的作为肝活检的替代方法应用于肝纤维化的评估。TE技术最早被用于评估丙肝患者的肝脏纤维化,后来逐步应用于慢性乙肝患者和NAFLD患者,作为评估肝脏纤维化,尤其是对中重度肝纤维化的鉴别的一个可靠性指标。非侵入性、快速简便、可重复、价格便宜、可多中心检测是TE技术的优点。该技术最大的缺点是测量的有效性问题,只使用M探针的情况下,只有85%的测量有效[11]。如果使用M和XL探针,可以有多达93%的患者有效测量[12]。本研究中有效测量为89.4%,测量失败的患者多数为超重或肥胖患者。T2DM患者由于大多数要进行定期体检,可以更容易进行肝脏疾病的筛查。本研究中,通过TE检测LSM值,提示有28.7%患者存在显著肝纤维化(7.0~10.2kPa),有17.5%患者有肝硬化(≥10.3kPa),一共有46.2%患者可能有较为严重的肝脏纤维化改变。
目前,肝纤维化分级的LSM界值尚无统一标准。评估显著纤维化的界值,有7.0kPa、8.0kPa和7.6kPa等标准[13,14]。评估丙肝患者肝硬化的界值,有12.5kPa和14.0kPa, 评估乙肝患者肝硬化的界值,有12.5kPa和13.4kPa,对酒精性脂肪性肝炎(ASH)患者,建议的界值是22.4kPa[15~17]。有研究提出7.0kPa较低,建议用>8.0kPa作为判断显著肝纤维化的标准值,使用>8.0kPa预测糖尿病患者肝纤维化程度,发现有17.2%的患者存在显著肝纤维化[1,13]。本研究中,如果使用8.0kPa作为界值,显著肝纤维化患者的比例将变成34.5%(59/171)。不管采用哪个标准,可以明确的是,T2DM合并NAFLD的患者中显著肝纤维化的比例均较高。肝功能检测可以做为T2DM合并NAFLD的患者常规检查项目,转氨酶的升高常常预示着炎症的存在,可能为NASH,需排除病毒感染因素。
使用FibroScan的TE技术完成LSM及CAP测定简便而快速,重度肝脏脂肪变性提示肝脏显著纤维化的可能性明显增加[13]。本研究中,与没有或轻中度脂肪变性(S0~S2)患者比较,重度脂肪变性(S4)患者中显著肝纤维化(LSM:7.0~10.2kPa)比例及肝硬化(LSM≥10.3kPa)比例均更高,也证明了这一点。但是,在轻中度脂肪变性患者中也有显著肝纤维化及肝硬化病例,因此,利用LSM评估糖尿病患者的肝纤维化程度应应用于全体人群,而不局限于重度脂肪变性患者。
本研究发现,高ALT和高CAP值可能是T2DM合并NAFLD的患者肝纤维化发生的独立危险因素,通过检测转氨酶及CAP可以评估患者发生肝纤维化的风险。年龄、性别、血压等因素未发现与肝纤维化的发生有直接关联。本研究通过无创技术TE,测量LSM和CAP值,发现T2DM合并NAFLD的患者中,97.1%有不同程度的脂肪变性,46.2%有显著的肝纤维化。因此,LSM检测应该作为T2DM合并NAFLD的患者的常规检查,尤其是对于有转氨酶升高或者CAP值较高的患者,LSM应作为重要评估指标。肝纤维化分级的LSM界值尚待进一步研究确定,但>7.0kPa提示患者有较为明显的肝脏损害,必要时可选择行肝组织活检明确诊断。本研究的不足之处是没有用肝脏组织活检等方法对肝纤维化进行评估,来确定肝纤维化的程度。另外,也不能完全排除排除有无其他可能引起肝脏损害的疾病存在。
总之,利用FibroScan的TE技术,通过CAP定量检测肝脂肪变性程度,通过测量LSM反映肝纤维化程度,可以有效地对T2DM合并NAFLD的患者肝脂肪变、肝脏纤维化进行筛查和评估,具有较好的临床应用价值。
